孕中期丙泊酚麻醉對子代認知和海馬miRNAs的影響*
趙黎麗,羅佛全,龔海霞,劉添銀△,曹蒙蒙
1.南昌大學第一附屬醫院麻醉科,江西南昌 330006;2.浙江省人民醫院麻醉科,浙江杭州 310000;3.江西省九江市第一人民醫院麻醉科,江西九江 332000
有研究表明,在突觸形成高峰期(妊娠期和嬰兒期)幾乎所有全身麻醉藥物都可引起神經退行性病變[1]。臨床上大多數孕婦的非產科手術是在全身麻醉下完成的。對胎兒及孕婦而言,孕中期是進行非產科手術最合適的孕期手術時間[2]。孕期母體丙泊酚的使用對子代出生后神經行為學(例如學習記憶)的不良影響已有相關研究證實[3-7],但其確切的機制還在探討中。近期有研究支持microRNAs(miRNAs)在麻醉誘導的神經發育毒性中可能發揮作用[8]。本研究通過建立孕中期母體丙泊酚麻醉模型,觀察子代認知功能的變化,分析子代海馬組織miRNAs表達譜,試圖尋找差異表達的miRNAs及進行生物信息學分析,為治療或預防孕中期母體丙泊酚麻醉所致的子代神經毒性探索新靶點。
1 材料與方法
1.1實驗動物與分組 本實驗的開展獲南昌大學第一附屬醫院動物倫理委員會批準,本實驗所用SD大鼠購自湖南斯萊克景達實驗動物有限公司。選擇清潔級健康SD大鼠30只,其中雄性10只、雌性20只,月齡9~10周,體質量270~310 g。采用標準飼養條件:室內溫度22 ℃,濕度(55±5)%,照明采用自動晝夜交替循環模式,大鼠可自由攝食、飲水。雌雄鼠同籠前進行Morris水迷宮(MWM)實驗,判斷其學習記憶能力以排除遺傳不良影響。剔除找不到平臺的大鼠后將雌鼠和雄鼠按2∶1同籠以完成受孕。同籠后實驗員于每日清晨對雌鼠進行陰道涂片,在顯微鏡下陰道涂片發現精子記為母鼠第1天懷孕。選取孕14 d的母鼠,采用隨機數字表法分為2組,丙泊酚麻醉組(P組)和脂肪乳劑對照組(C組),每組10只。
1.2孕鼠干預 將孕鼠輕柔地固定在自制固定裝置中,鼠尾暴露在外,將鼠尾浸泡在溫水中數分鐘,清潔表面污物,待鼠尾靜脈擴張顯露后用酒精消毒鼠尾,從鼠尾靜脈置入24 G靜脈留置針并固定牢靠。P組經鼠尾靜脈留置針靜脈注射誘導劑量丙泊酚20 mg/kg(阿斯利康制藥有限公司,產品批號:X17147A),翻正反射消失后以20 mg/(kg·h)持續靜脈泵注丙泊酚4 h。C組經鼠尾靜脈注射與丙泊酚等劑量的20%中長鏈脂肪乳劑(廣州百特僑光醫療用品有限公司,產品批號:GM190401)。母鼠麻醉手術期間采用無創心電監護儀監測脈搏血氧飽和度、心率,脈搏血氧飽和度<95%的孕鼠剔除本研究。處理結束后待孕鼠翻正反射恢復后放回飼養籠繼續飼養,待其分娩。為排除孕中期單純丙泊酚麻醉可能造成孕鼠內環境紊亂,每組選取6只孕鼠于丙泊酚或脂肪乳劑輸注結束時行股動脈采血0.5 mL用于動脈血氣分析。所有用于動脈血氣分析的孕鼠不再用于后續實驗。
1.3子鼠行為學實驗 子鼠出生后進行下列實驗:(1)7 d時兩組子鼠行懸崖回避實驗;(2)30~34 d時兩組子鼠行MWM實驗。
1.4子鼠海馬miRNAs芯片檢測及生物信息學分析 取出生后7 d和30 d時的兩組子鼠海馬組織行miRNAs芯片檢測,并選取數個差異表達miRNAs進行實時熒光定量PCR(qPCR)驗證。采用在線數據庫預測差異表達miRNAs的靶基因,進行KEGG通路富集分析。
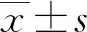
2 結 果
2.1兩組懸崖回避時間比較 懸崖回避實驗結果顯示,C組懸崖回避時間為(5.95±1.91)s,P組懸崖回避時間為(8.18±1.98)s,與C組比較,P組子鼠轉身或后退時間延長,提示孕中期母體丙泊酚麻醉損傷子鼠早期神經發育。
2.2兩組子鼠逃避潛伏期的比較 在MWM定位航行訓練中,P組與C組比較,第4天和第5天逃避潛伏期延長(P<0.05),見表1。在MWM空間探索實驗中,各組平臺穿越次數比較,P組少于C組(P<0.05);兩組子鼠靶象限停留時間和游泳速度差異無統計學意義(P>0.05),見表2。提示孕中期丙泊酚麻醉對SD大鼠子代學習記憶有損傷作用。
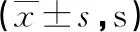
表1 兩組子鼠逃避潛伏期的比較
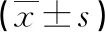
表2 兩組子鼠空間探索實驗的比較
2.3子鼠海馬組織miRNAs芯片檢測結果
2.3.1差異表達的miRNAs 在miRNAs芯片檢測之前對抽提的RNA進行質量檢測,Agilent2100 Nanodrop質檢結果顯示8個標本RNA質量均滿足實驗要求,可進行后續實驗。miRNAs芯片結果顯示,以差異倍數≥2且P<0.05作為差異表達標準時,與C組比較,7 d時P組子鼠海馬組織有9個miRNAs表達水平上調,包括miR-134-3p、miR-138-2-3p、miR-3068-3p、miR-328b-3p、miR-3552、miR-3572、miR-5132-3p、miR-547-5p、miR-671。與C組比較,30 d時P組有3個miRNAs表達下調,包括miR-374-5p、miR-124-5p、miR-362-3p。
2.3.2miRNAs表達的驗證 選取7 d時差異表達miRNAs中的miR-134-3p和30 d時差異表達miRNAs中的miR-362-3p進行qPCR驗證,結果顯示,與C組比較,P組7 d時子鼠的miR-134-3p上調,P組30 d時子鼠的miR-362-3p下調,與miRNAs芯片表達結果一致。見表3。
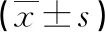
表3 miRNAs表達的驗證
2.3.3差異表達miRNAs生物信息學分析 采用TargetScan和miRDB兩個數據庫對7 d和30 d時差異表達的miRNAs進行預測,分別預測到1 093個和312個靶基因。應用在線軟件DAVID軟件進行靶基因的KEGG通路富集分析。7 d時KEGG通路富集分析前20名見圖1,30 d時KEGG通路富集分析前20名見圖2。
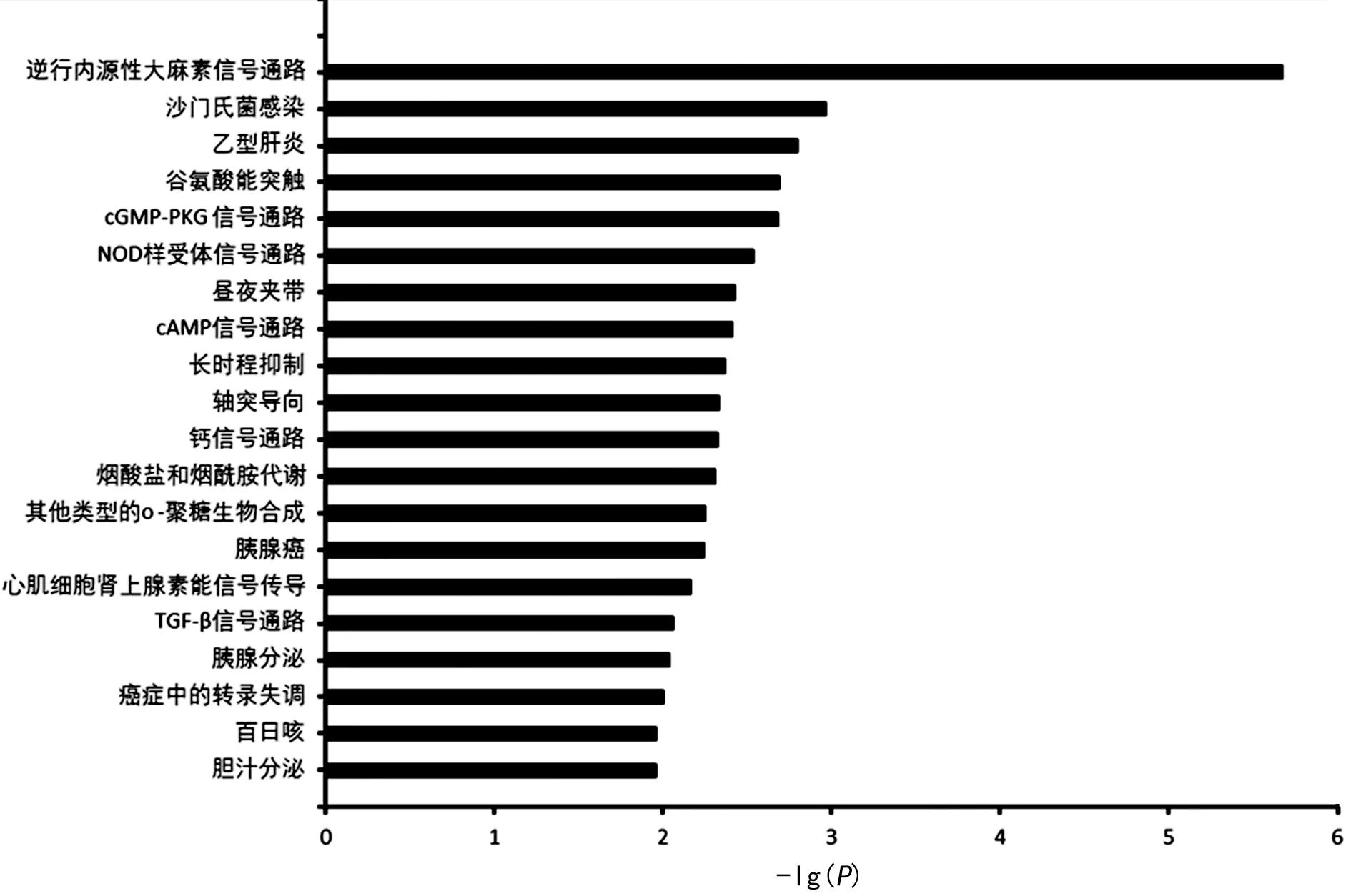
圖1 7 d時兩組差異表達miRNAs的靶基因KEGG通路富集分析
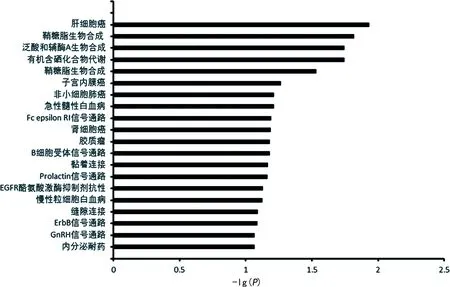
圖2 30 d時兩組差異表達miRNAs的靶基因KEGG通路富集分析
3 討 論
在本研究中通過給孕中期大鼠尾靜脈注射丙泊酚來探討其對子代認知功能及海馬組織miRNAs表達的影響。7 d時子鼠懸崖回避實驗結果提示孕中期母體丙泊酚麻醉損傷子鼠早期神經發育。30~34 d時MWM實驗結果發現孕中期母體丙泊酚麻醉會損傷子代遠期空間學習記憶。孕中期母體丙泊酚麻醉可以改變子鼠海馬組織miRNAs表達。
有研究表明,麻醉相關的miRNAs基因靶點參與軸突引導、DNA轉錄和蛋白磷酸化相關的幾個神經發育通路[9]。因此,確定這些差異表達的miRNAs的靶點可能有助于闡明介導不同麻醉藥對神經和生理功能作用的具體途徑。本研究取孕中期母體丙泊酚麻醉后子代7 d和30 d時的海馬組織進行miRNAs微陣列分析,尋找差異表達的miRNAs并進行了后續的生物信息學分析。7 d時差異表達miRNAs的靶基因KEGG通路富集分析發現,這些靶基因大量參與神經發育、突觸塑形相關的生物學過程,例如樹突形態發育、轉錄調控、學習、鈣離子轉運、蛋白磷酸化等。同時它們在谷氨酸能突觸、cGMP-PKG信號通路、cAMP信號通路、長時程抑制、軸突導向、鈣離子信號通路上都有富集,這些通道與神經發育、突觸塑形都有相關性。在這些差異表達的miRNAs分子中,有一些已被研究證實與神經系統功能相關。miR-134早在2006年就被Nature雜志報道為一種調節樹突棘發育的腦特異性miRNA[10]。miR-134可以通過下調大鼠的Limk1/cofilin信號參與慢性應激誘導的神經元結構可塑性和類抑郁樣行為[11]。miR-328a可能通過上調β-分泌酶水平參與戊四氮誘導的大鼠記憶功能障礙[12]。miR-138-5p在體外通過靶向甲狀腺激素受體相互作用蛋白16表達調控神經干細胞的增殖和分化[13]。7 d和30 d子鼠差異表達miRNAs未產生過多交集,反映出miRNAs的表達具有時間特異性。30 d時P組差異表達的miRNAs靶基因KEGG通路富集分析發現,預測靶基因在生物學過程、細胞成分、分子功能與7 d時已有了很大不同,與神經發育相關的靶基因減少。嚙齒類動物大腦發育的高峰期主要集中在出生后前2周[14]。7 d時子鼠處于大腦發育的高峰期,母體丙泊酚麻醉對子代神經發育的不良影響可在分子或細胞水平被觀察到是不難理解的。而30 d時子鼠的大腦已處于成熟期,故而差異表達的miRNAs預測的靶基因KEGG通路富集分析與神經發育相關性減少。
綜上所述,本研究發現孕中期母體丙泊酚麻醉損傷子代早期神經發育和遠期空間學習記憶。這可能與子鼠海馬組織miRNAs的表達譜改變相關。這些差異表達的miRNAs靶基因及其相關通路的研究將為揭示孕中期母體丙泊酚麻醉導致的子代神經發育毒性機制提供新思路。

