血清CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ在胃癌中的表達及意義*
史躍燕,林 蘭,顧益鳳,劉紅利
江蘇省南通市腫瘤醫院檢驗科,江蘇南通 226000
我國每年新增胃癌病例數高達40萬,死亡病例數達35萬,新增病例數和死亡病例數均占全球總病例數的40%[1],但我國胃癌早期檢出率不到10%[2],與韓國和日本相比,差距較大[3]。據預測,2040年中國胃癌新增病例及死亡病例將分別增加67.6%和82.4%[4]。胃癌對人類的健康構成了嚴重的威脅[5]。胃癌早期是指癌組織限于胃黏膜層及黏膜下層,不論其范圍大小和有無淋巴結轉移[6],胃癌早期患者經有效治療后,5年生存率可達90%[7]。若病灶未及時發現和治療,胃癌發展期患者經手術治療后,5年生存率僅在30%左右[8]。因此有效篩查胃癌早期對預防和改善胃癌患者的預后有著十分重要的意義[9]。腫瘤標志物癌胚抗原(CEA)、糖類抗原(CA)19-9、CA72-4、胃泌素-17(G-17)、胃蛋白酶原(PG)Ⅰ、PGⅡ等因其檢測簡便、創傷小在胃癌早期篩查中的應用越來越廣泛。但是單項腫瘤標志物檢測也容易造成胃癌早期的漏診[10],因此合理地選擇聯合檢測項目既能提高篩查率又可以降低患者的負擔,部分腫瘤標志物還可用于術后療效監測。
1 資料與方法
1.1一般資料 選取2019年8月至2020年5月本院胃癌住院患者68例為胃癌組,其中男51例,女17例,48例進行了手術治療;賁門+胃底部癌30例,胃竇+胃角部癌26例,胃體部癌11例,全胃癌1例。選取同期本院的胃部良性病變患者84例為良性病變組,體檢健康者150例為對照組。胃部良性病變患者中胃息肉34例,胃炎32例,胃息肉伴胃炎患者15例,胃排空障礙者3例。
1.2方法 所有受試者均為清晨空腹抽取靜脈血,自然凝固后離心取上清液,行實驗室質量控制,質控均在控后測定結果,CEA、CA19-9、CA72-4采用電化學發光法在羅氏E601全自動化學發光免疫分析儀上測定,PGⅠ、PGⅡ和G-17在Maglimi全自動化學發光儀上測定。
1.3統計學處理 采用SPSS21.0軟件進行數據處理和分析。不呈正態分布的計量資料以M(P25,P75)表示,多個獨立樣本比較采用Kruskal-WalisH檢驗,多樣本兩兩比較采用Mann-WhitneyU檢驗;采用Spearman相關進行相關性分析;采用受試者工作特征(ROC)曲線評價各檢測指標的診斷價值。以P<0.05為差異有統計學意義 。
2 結 果
2.1各組CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ水平及PGⅠ/PGⅡ(PGR)比較 G-17、PGⅡ和PGR在對照組和良性病變組間比較,差異有統計學意義(P<0.05);CEA、CA72-4、PGⅠ、PGⅡ和PGR在良性病變組和胃癌組間比較,差異有統計學意義(P<0.05);與對照組比較,胃癌組CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ、PGR差異均有統計學意義(P<0.05)。見表1。
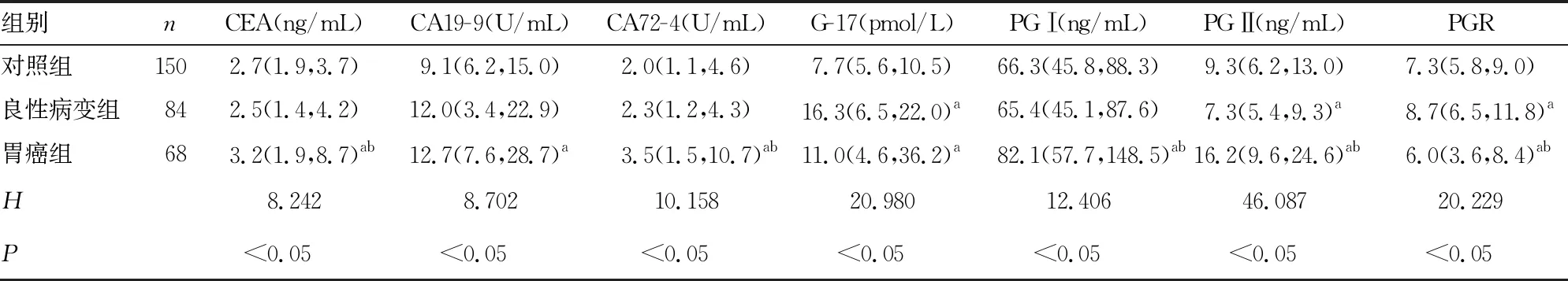
表1 對照組、良性病變組和胃癌組腫瘤標志物測定結果[M(P25,P75)]
2.2CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ、PGR與胃癌患者臨床病理特征間的關系 CA19-9水平、PGR在胃癌患者不同病變部位間比較,差異有統計學意義(P<0.05),兩兩比較結果表明,CA19-9在賁門+胃底部和胃竇+胃角部間比較,差異有統計學意義(P<0.05)。各腫瘤標志物水平和PGR在胃癌患者是否轉移、性別和年齡間的比較,差異均無統計學意義(P>0.05)。見表2。
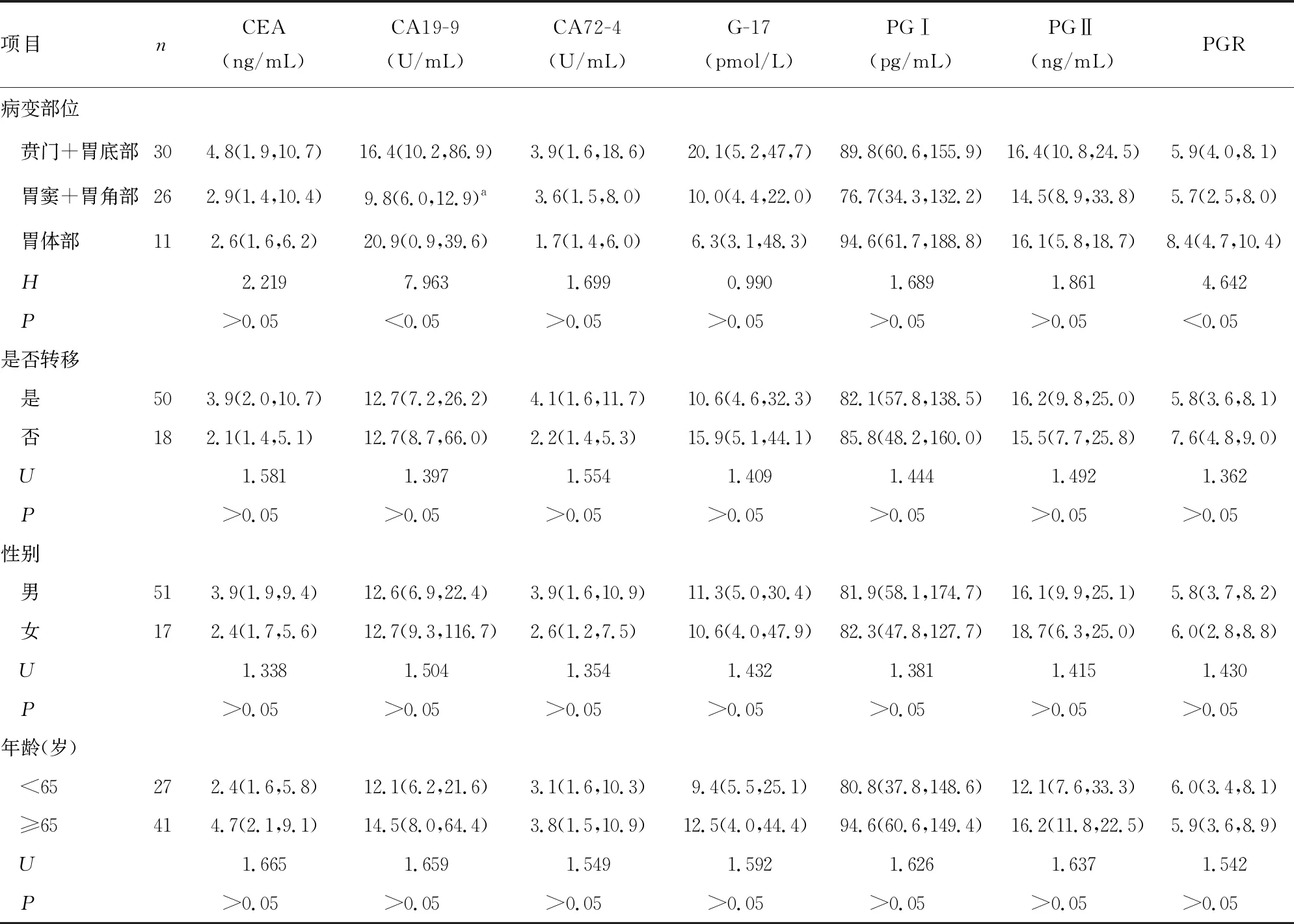
表2 CEA、CA19-9、CA72-4、G-17、PGⅠ、PGⅡ、PGR與胃癌患者臨床病理特征間的關系[M(P25,P75)]
2.3Spearman相關性分析 相關性分析結果表明,CEA和CA19-9(P=0.009,r=0.316)、CEA和CA724(P=0.001,r=0.427)、PGⅠ和PGⅡ(P=0.001,r=0.616)、PGⅠ和G-17(P=0.013,r=0.299)、PGⅡ和G-17(P=0.013,r=0.299)均呈正相關,其余腫瘤標志物間無明顯相關性(均P>0.05)。
2.4ROC曲線分析 PGⅡ診斷胃癌的靈敏度為63.2%,特異度為86.0%,曲線下面積(AUC)為0.725,診斷效能明顯優于其他腫瘤標志物,見表3。同時選取診斷效能較高的前3種腫瘤標志物(CA19-9、PGⅠ、PGⅡ)進行聯合診斷,結果發現3項指標聯合診斷并無優勢,PGⅠ和PGⅡ聯合診斷的準確度最高,見表4。
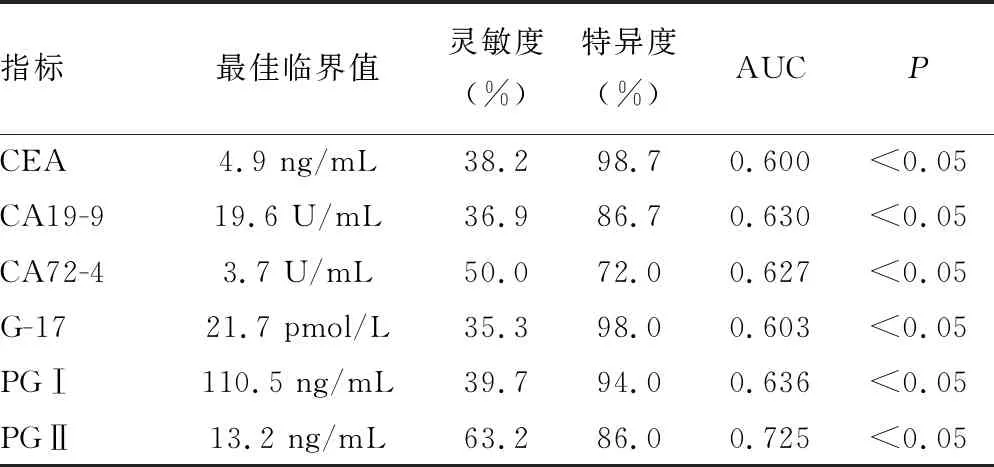
表3 各血清腫瘤標志物對胃癌的診斷價值
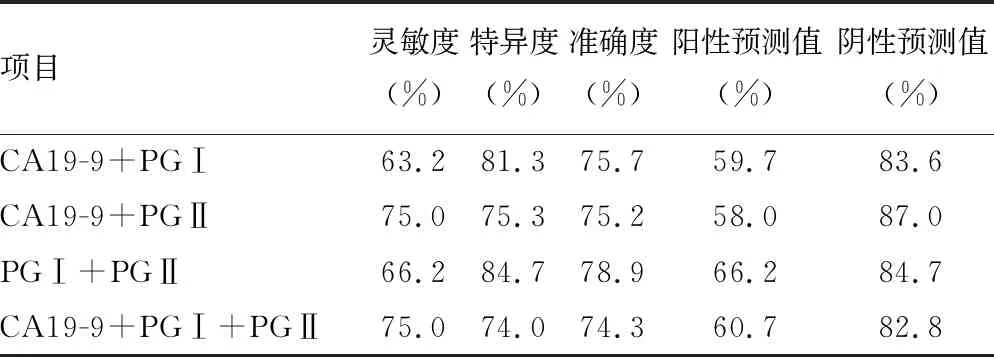
表4 CA19-9、PGⅠ、PGⅡ聯合診斷對胃癌的診斷價值
2.5胃癌患者手術前后G-17和PGⅡ水平比較 68例胃癌患者中有48例進行了手術治療,手術前后G-17水平差異有統計學意義(P=0.001),但PGⅡ水平差異無統計學意義(P=0.593),見圖1。
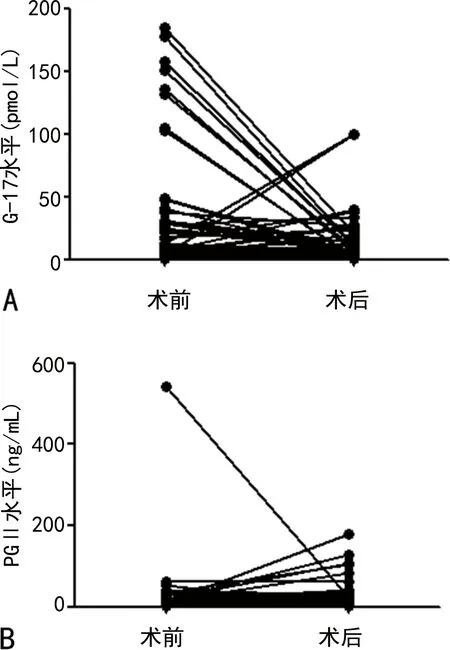
注:A為胃癌患者手術前后G-17水平變化情況;B為胃癌患者手術前后PGⅡ水平變化情況。
3 討 論
PG是胃蛋白酶的無活性前體,根據電泳遷移率將遷移率較快且免疫原性相近的1~5組分稱為PGⅠ,組分6和7則稱為PGⅡ。PGⅠ主要由胃底腺細胞分泌,因此能反映胃底腺細胞的分泌功能。而PGⅡ由胃賁門的賁門腺、胃竇部的幽門腺和近十二指腸腺產生[11],由于PGⅡ分布較為廣泛,結果相對穩定,能反映全胃功能。
在本研究中PGⅠ在良性病變組和對照組間的水平差異無統計學意義(P>0.05),而PGⅡ、G-17和PGR差異均有統計學意義(P<0.05),可能由于胃癌患者早期胃黏膜分泌異常,壁細胞分泌胃酸減少,使得胃蛋白酶轉化量下降,從而出現PGⅠ水平正常的假象[12]。
G-17主要由胃竇G細胞分泌,在胃腸激素中生物活性最強,能夠促進多種消化液和消化酶的分泌[13],主要生理學功能是促進腸嗜鉻細胞釋放組胺,進一步刺激壁細胞分泌胃酸,從而有效地促進胃黏膜的生長分化。G-17通過促進缺氧誘導因子-1α的表達調控血管內皮生長因子,促進血管內皮的生成和生長,為胃癌細胞的浸潤和轉移提供條件[14]。南壽山等[15]研究結果表明,G-17和PG聯合檢測可用于胃癌早期篩查。肖佛義等[16]的研究表明胃泌素在胃癌早期進程中有重要作用。本研究結果顯示,對照組G-17水平明顯低于良性病變組和胃癌組,但良性病變組和胃癌組G-17水平差異無統計學意義(P>0.05),表明G-17對胃癌療效監測有一定的臨床意義。本研究結果表明,G-17水平和胃癌是否轉移無關,原因可能與標本量,胃癌發病區域等因素有關。飲食狀況、炎癥、胃酸分泌量等都會影響G-17的分泌,因此臨床應聯合PG對胃癌患者進行早期篩查[11]。
ZHANG等[17]經過長期隨訪發現,PG異常伴幽門螺桿菌(Hp)感染的人群胃癌發生率最高(5.6%),PG異常而Hp陰性的人群胃癌發生率為4.76%,PG正常而Hp陽性的人群胃癌發生率為1.84%,與本研究中PGⅠ、PGⅡ對胃癌的診斷效率最高(AUC分別是0.636、0.725)相符合。G-17、PGⅡ和PGR在對照組和良性病變組間比較,差異有統計學意義(P<0.05),據此推斷G-17和PGⅡ可能在胃部良性病變過程中便發揮作用,這兩項指標水平升高的患者應采用胃鏡做一步篩查。各腫瘤標志物在胃癌患者是否轉移、性別和年齡間比較,差異均無統計學意義(P>0.05)。相關性分析表明PGⅠ與PGⅡ呈正相關(P=0.001,r=0.616),二者均是胃癌初篩較好的指標。
CA19-9水平在賁門+胃底部和胃竇+胃角部間比較,差異有統計學意義(P<0.05),但CEA、CA19-9、CA72-4均系廣譜腫瘤標志物,尤其是CA72-4為發現較早的胃癌腫瘤標志物,在多種腫瘤中均為陽性[18],對胃癌診斷的靈敏度和特異度都無法滿足胃癌早期篩查的需求。使用胃鏡進行腫瘤篩查的患者依從性差,費用昂貴,難以用于大規模早期篩查。研究發現,多項指標聯合檢測能提高胃癌高風險人群的檢出率[19-20]。在本研究中,單項檢測PGⅡ對胃癌診斷效能最高,選取診斷效能較高的前3項腫瘤標志物(CA19-9、PGⅠ、PGⅡ)進行聯合診斷,發現3項指標聯合診斷并無優勢,PGⅠ和PGⅡ聯合診斷的準確度最高。
因此,上述胃癌腫瘤標志物中,PGⅡ在胃癌早期大規模篩查中的診斷價值最大,其次是PGⅠ,合理地選擇聯合診斷項目,可提高診斷效能。G-17可作為胃癌術后動態監測指標,由于本研究標本量不夠大,還需擴大標本量作進一步研究。

