UPLC-QE-Orbitrap-MS/MS結合網(wǎng)絡藥理學和實驗驗證探討西洋參治療動脈粥樣硬化的作用機制
何 林,彭 偉,張學建,陶飛燕*,吳純潔*
1成都中醫(yī)藥大學藥學院,成都 611137;2四川中煙工業(yè)有限責任公司,成都 610066
動脈粥樣硬化(atherosclerosis,AS)是引發(fā)血管疾病的主要原因,其病變以動脈部分脂質沉積為特征,伴有平滑肌細胞和纖維基質增殖,逐漸發(fā)展為動脈粥樣硬化斑塊[1]。AS的臨床表現(xiàn)包括缺血性心臟病、缺血性中風和外周血管病等[2]。AS的發(fā)病機制十分復雜,具有多種信號傳導途徑,實驗和臨床研究表明其可能與炎癥、氧化應激、先天和適應性免疫、感染等有關。目前傾向于“損傷反應-炎癥學說”,性質與炎癥相似,但尚無定論[3,4]。
西洋參(Panacis Quinquefolii Radix)是五加科人參屬植物的干燥根,含有豐富的人參皂苷[5]。研究表明,多種人參皂苷具有抗炎、免疫調節(jié)和保護心血管系統(tǒng)等藥理活性[6]。西洋參傳統(tǒng)干燥方式為烘干,但干燥后的成品表皮皺縮,顏色焦黃,質地堅硬,切片或粉碎困難。冷凍干燥(凍干)可在低溫和真空下將物料脫水干燥。采用冷凍干燥制備的西洋參(freeze-drying Panacis Quinquefolii Radix,F(xiàn)DPQ)表皮平整,顏色鮮亮,質地疏松,復水性好,服用方便,脫水徹底,易于貯藏和運輸。此外,F(xiàn)DPQ中人參皂苷Rg1、Re、Rb1的含量總和亦顯著高于烘干西洋參[7]。綜上,F(xiàn)DPQ在外觀品相和內(nèi)在成分上較烘干西洋參均有優(yōu)勢,具有廣闊的市場前景。
課題組前期研究發(fā)現(xiàn),F(xiàn)DPQ可改善動脈粥樣硬化小鼠氧化應激損傷,減少主動脈弓部位粥樣斑塊以及脂質沉積,但機制尚不明確。網(wǎng)絡藥理學可從系統(tǒng)層面揭示藥物對機體的調控作用,為研究中藥成分與疾病之間的相互關系提供新的思路[8]。本文擬采用UPLC-QE-Orbitrap-MS/MS技術結合網(wǎng)絡藥理學和分子對接的方法,探索FDPQ治療AS的藥效物質、作用靶點和潛在通路,并輔以細胞實驗進行初步驗證,以期為進一步開展相關實驗,研究作用機制奠定基礎。實驗流程設計如圖1所示。
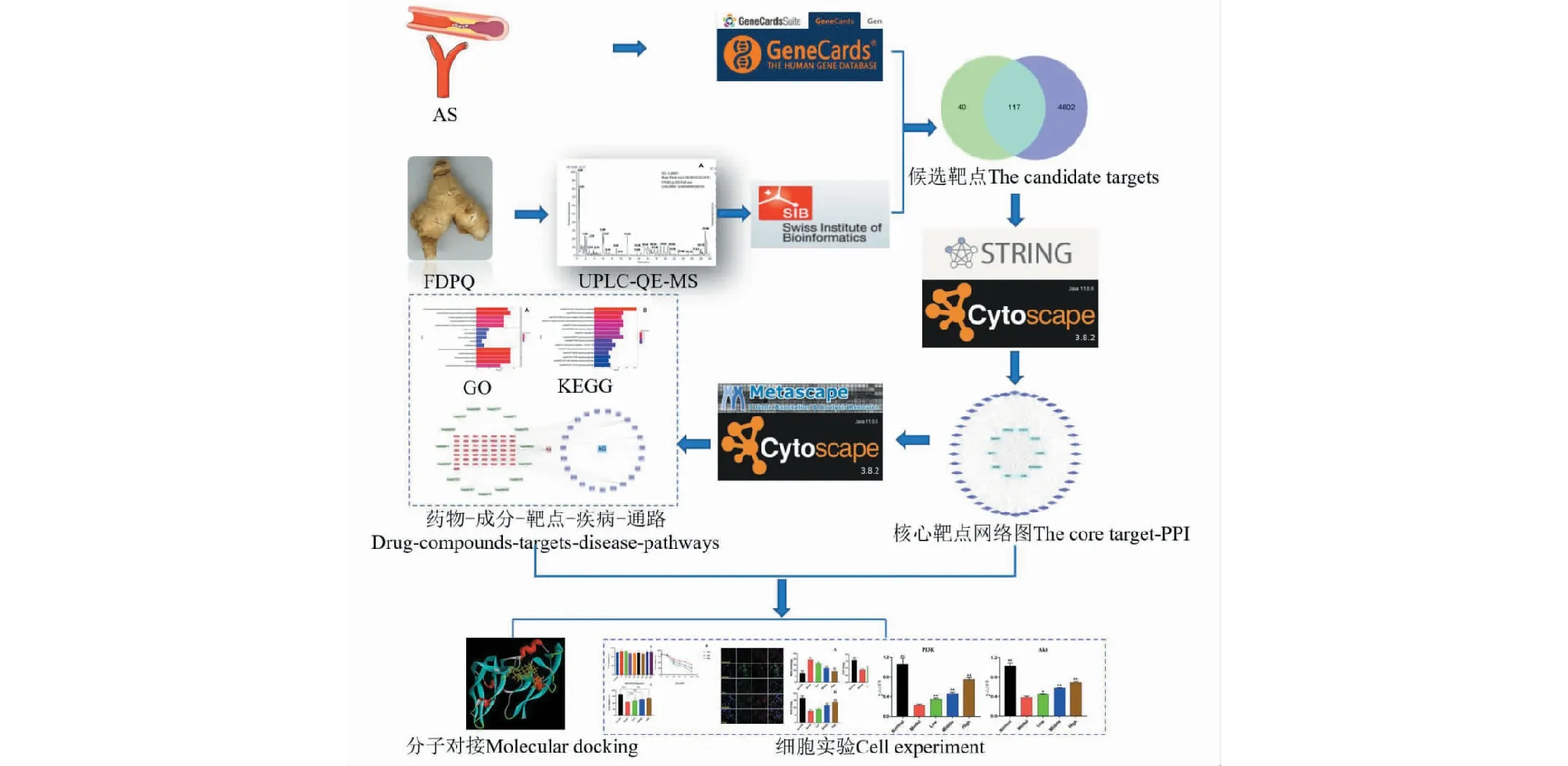
圖1 研究設計的詳細流程圖
1 材料和方法
1.1 FDPQ的制備
鮮西洋參從中國吉林省靖宇縣購買,由成都中醫(yī)藥大學吳純潔教授鑒定為五加科人參屬植物西洋參(PanaxquinquefoliumL.)的根。將鮮西洋參冷凍干燥,粉碎后過50目分析篩(孔徑為0.355 mm)。冷凍干燥工藝:-80 ℃預凍2 h后入倉,真空度抽至10 Pa,溫度由-50 ℃升至20 ℃,維持32 h。
1.2 皂苷類成分鑒定
1.2.1 試劑試藥
色譜純甲醇和乙腈購自美國Thermo Fisher Scientific;甲醇、甲酸等分析純試劑購自成都市科隆化學品有限公司。
1.2.2 供試品溶液制備
精密稱取FDPQ粉末1.0 g置具塞錐形瓶中,加入80%甲醇30 mL,超聲提取60 min,過濾,取續(xù)濾液過0.22 μm微孔濾膜,即得。
1.2.3 UPLC-Q Exactive Orbitrap-MS分析
色譜條件:色譜柱為Thermo ScientificTMAccucoreTMC18(3 mm×100 mm,2.6 μm);流速:0.35 mL/min;柱溫:35 ℃;進樣量:5 μL;流動相A為0.1%甲酸-乙腈,流動相B為0.1%甲酸-水;梯度洗脫程序為:0~3 min,10% A→20% A;3~25 min,20% A→38% A;25~30 min,38% A→85% A;30~30.1 min,85% A→100% A。
質譜條件:質譜儀為Thermo Scientific Q Exactive-MS高分辨質譜儀(美國Thermo Fisher)。電噴霧離子源,選擇正負離子模式(HESI+/ESI-),在100~1 500m/z范圍內(nèi)進行全掃描分析;離子源溫度:120 ℃,噴霧電壓:3.0 kV;毛細管溫度:320 ℃;最大噴射電流:100 A;探針加熱器溫度:350 ℃;洗脫溶劑溫度:400 ℃;鞘氣和輔助氣體均為氮氣,流速分別為35.00 L/min和10.00 L/min。
1.3 網(wǎng)絡藥理學分析
1.3.1 候選靶點庫和蛋白互作網(wǎng)絡(PPI)構建
利用SwissTargetPrediction平臺預測在FDPQ中鑒定出的皂苷類成分的潛在靶點。以“atherosclerosis”為關鍵詞,從GeneCards數(shù)據(jù)庫中收集疾病相關靶點。對成分靶點和疾病靶點求交集,建立候選靶點庫。將候選靶點導入String數(shù)據(jù)庫,選擇high confidence(0.700),將生成的文件導入Cytoscape軟件(3.8.2),篩選出MCC下的top 50樞紐基因(hub genes),并可視化獲得PPI網(wǎng)絡圖;同時進行網(wǎng)絡拓撲分析,計算出“degree”“betweenness centrality”“closeness centrality”值,進而得到核心靶點。使用的數(shù)據(jù)庫和在線分析平臺見表1。

表1 數(shù)據(jù)庫和在線分析平臺
1.3.2 GO功能和KEGG通路富集分析
利用Metascape平臺[9]對篩選出的50個樞紐基因進行基因本體論富集(gene ontology,GO)和京都基因與基因組百科全書通路分析(Kyoto encyclopedia of genes and genomes,KEGG)。均選取P<0.01的結果,并使用微生信云平臺對重要結果進行可視化。
1.4 分子對接
利用Discovery Studio(4.5 Client)軟件將篩選出的活性成分和靶點進行分子對接。首先,使用“Prepare Ligands”模塊生成活性成分的三維結構并加氫。從RCB PDB數(shù)據(jù)庫下載靶點的大分子蛋白質(具有原配體),篩選條件為:Homo sapiens、X-Ray Diffraction,分辨率在0.25~0.40 nm之間。刪掉水分后,使用“Prepare Protein”模塊去除蛋白多構象,補充非完整的氨基酸殘基,為蛋白加氫。拆分蛋白和原配體,利用LibDock方法將原配體和活性成分一同與蛋白進行對接,以LibDockScore評估活性成分和目標蛋白的親和力。LibDock方法相關參數(shù)均為默認設置。
1.5 細胞實驗
1.5.1 試劑與材料
胎牛血清(FBS)(批號:O30629)、RPMI1640培養(yǎng)基(批號:8121592)購自美國紐約GIBCO;H2O2(批號:BCCG3062)購自美國sigma;抗生素(青霉素-鏈霉素溶液)(批號:16D28C16)、PBS緩沖液(批號:16GO2A30)、胰蛋白酶(含EDTA)(批號:17A20167)、CCK-8試劑盒(批號:16H19B60)購自武漢博士德生物;RAPI lysis buffer裂解液(批號:90013B)、超氧化物歧化酶(SOD)(批號:032219190614)和丙二醛(MDA)檢測試劑盒(批號:030819190614)、BCA蛋白測定試劑盒(批號:070919919113)購自上海碧云天;JC-1探針(批號:2019042)購自江蘇凱基生物;過氧化氫酶(CAT)測定試劑盒(批號:20201218)購自南京建成生物工程研究所;Trizol(批號:213409)購自美國Thermo Fisher;DEPC水(批號:681165)購自上海吉至公司;逆轉錄試劑盒(批號:S2028)、SYBR Green q-PCR Master Mix試劑盒(批號:S2014)購自蘇州宇恒生物。
1.5.2 FDPQ提取物凍干粉制備
精密稱取FDPQ粉末適量,按“1.2.2”項下供試品溶液制備方法制備提取液,將濾液減壓濃縮至無醇味后,冷凍干燥36 h得到提取物凍干粉,凍干工藝同“1.1”項下。
1.5.3 細胞培養(yǎng)
大鼠嗜鉻細胞瘤細胞系PC12細胞購自武漢普諾賽生命科技有限公司。用含10% FBS的RPMI 1640 培養(yǎng)基在環(huán)境為37 ℃、5% CO2的培養(yǎng)箱中培養(yǎng)。每三天傳代一次,取3到5代的細胞用于實驗。
1.5.4 細胞活力測定
采用CCK-8法檢測PC12細胞的活力,確定H2O2處理PC12細胞的最佳濃度和時間,以及FDPQ提取物的最佳干預濃度。將處于對數(shù)生長期的PC12細胞接種到96孔板中(1×104個細胞/孔)。細胞完全貼壁后,加入不同濃度的FDPQ提取物(5~120 μg/mL)培養(yǎng)24 h,或加入不同濃度的H2O2培養(yǎng)12、24、48 h。干預后更換新的細胞培養(yǎng)液,每孔加入10 μL CCK-8溶液,37 ℃暗箱培養(yǎng)1 h。最后,使用iMARK酶標儀(美國伯樂)在450 nm波長下檢測各孔的吸光度(OD)值,計算細胞存活率。在測定FDPQ對H2O2誘導的PC12細胞的影響時,先用FDPQ提取物預處理PC12細胞24 h,再用確定的最佳H2O2濃度和處理時間干預細胞,最后檢測干預后的細胞活力。
1.5.5 線粒體膜電位測定
將PC12細胞接種于激光共聚焦培養(yǎng)皿(1×104個細胞/孔),用不同濃度的FDPQ提取物和最佳濃度的H2O2干預后,PBS洗滌細胞3次,加入200 μL的JC-1染色工作液(10 μg/mL),使其能夠完全覆蓋住細胞表面,避光孵育20 min,吸除殘余染液,吸取適量的1×Assay Buffer清洗細胞三次,加入含有DAPI的封閉劑孵育,最后在Olympus IX71倒置熒光顯微鏡(日本Olympus)下觀察,記錄圖像。
1.5.6 抗氧化酶活性的測定
將PC12細胞配制成細胞懸液,接種于6孔板(每孔1×106個細胞),然后用不同濃度的FDPQ提取物和最佳濃度H2O2處理。干預結束后棄去上清液,用預冷的PBS溶液沖洗細胞3次,用RAPI裂解液對細胞進行裂解,收集細胞總蛋白。按試劑盒說明書測定細胞的SOD、CAT活性和MDA水平;同時用BCA試劑盒測定細胞總蛋白含量。
1.5.7 實時熒光定量PCR(qRT-PCR)檢測mRNA表達
通過qRT-PCR法測定PI3K和Akt的mRNA表達。將PC12細胞接種在6孔板中(每孔1×106個細胞),用不同濃度的FDPQ提取物和最佳濃度的H2O2處理。隨后收集細胞,使用Trizol Plus RNA純化試劑盒分離總RNA。使用逆轉錄試劑盒合成cDNA,SYBR Green q-PCR試劑盒進行cDNA擴增。qRT-PCR分析所用引物見表2。實驗結果以2-ΔΔCT的相對定量分析表示。
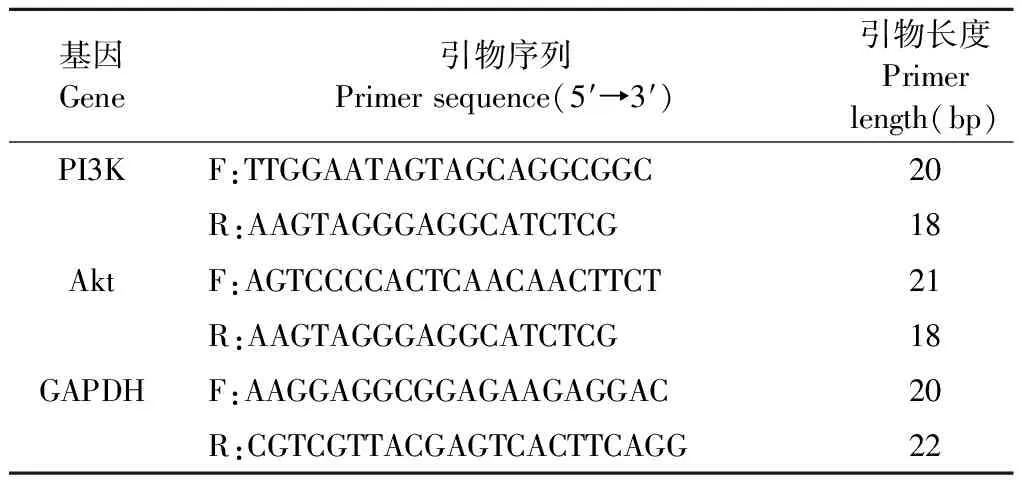
表2 qRT-PCR分析所用基因引物序列
1.5.8 統(tǒng)計和分析
所有數(shù)據(jù)均使用GraphPad Prism(9.3.1)軟件分析,實驗結果以平均值±標準差(n= 3)表示。組間差異采用單因素方差分析(one-way ANOVA),P< 0.05表示具有顯著差異。
2 結果與分析
2.1 UPLC-Q Exactive Orbitrap-MS/MS鑒定結果
本文使用高分辨質譜對FDPQ皂苷類成分進行分析鑒別。將化合物的相對分子質量、保留時間和二級質譜裂解碎片信息等與Thermo Scientific建立的化合物庫(mz Cloud和mz Vault)以及相關文獻[10-12]中的進行比對,在FDPQ中鑒定出28種皂苷類化合物。總離子流圖見圖2,化合物的詳細信息見表3。
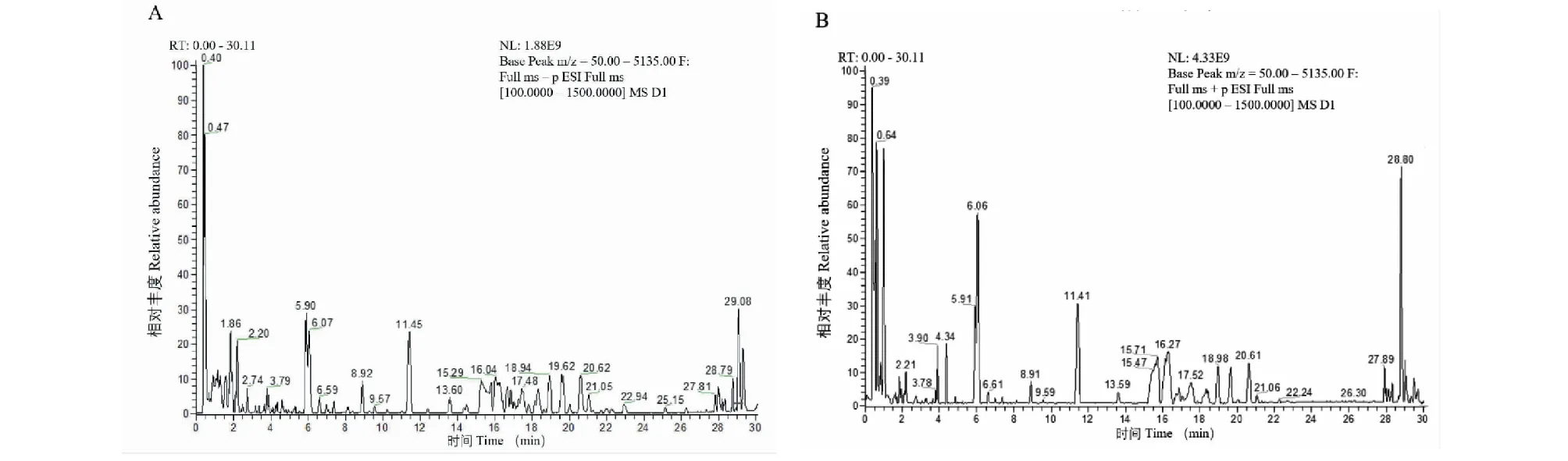
圖2 總離子流圖
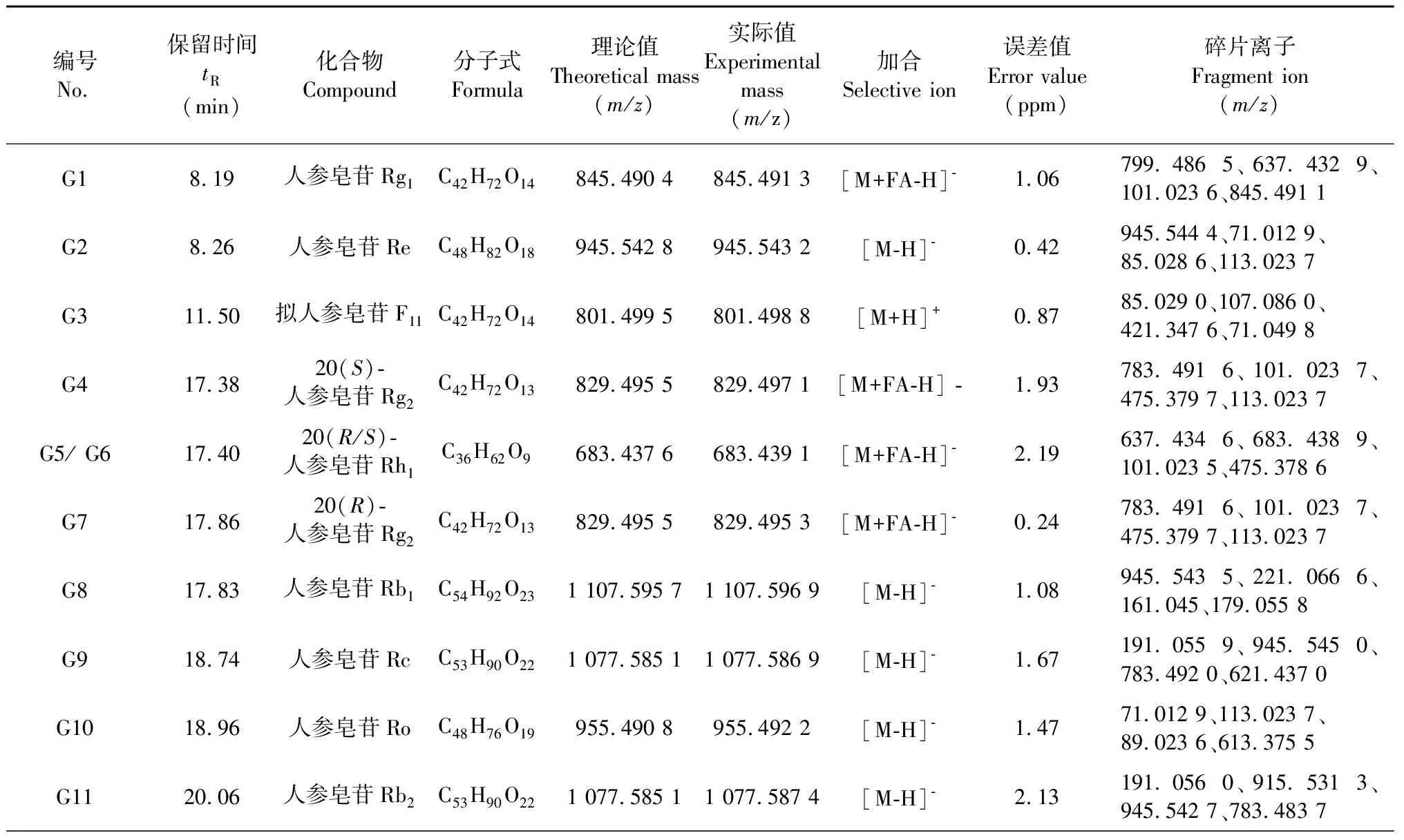
表3 FDPQ中的人參皂苷
2.2 候選靶點庫和PPI分析
通過SwissTargetPrediction和GeneCards數(shù)據(jù)庫的篩選,刪除重復值后,獲得了27個皂苷類化合物的相關靶點157個,疾病相關靶點4 719個。構建韋恩(Venny)圖(見圖3),得到二者交集靶點117個,作為候選靶點。按“1.3.1”項下的方法,使用Cytoscape軟件從候選靶點中篩選出top 50樞紐基因,并可視化獲得PPI網(wǎng)絡圖(見圖4)。如圖所示,該網(wǎng)絡有50個靶點和329條邊。以“degree”“betweenness centrality”“closeness centrality”值大于中位數(shù)為閾值進行篩選,將獲得的21個交集靶點作為核心靶點,結果見表4。“degree”值越高,表明其關聯(lián)的節(jié)點越多,重要程度越高,其中,SRC、STAT3、HSP90AA1、EGFR、MAPK1、JUN、GRB2、AKT1、PIK3CA、VEGFA排名靠前(degree > 21),表明這些靶點可能發(fā)揮著重要作用。
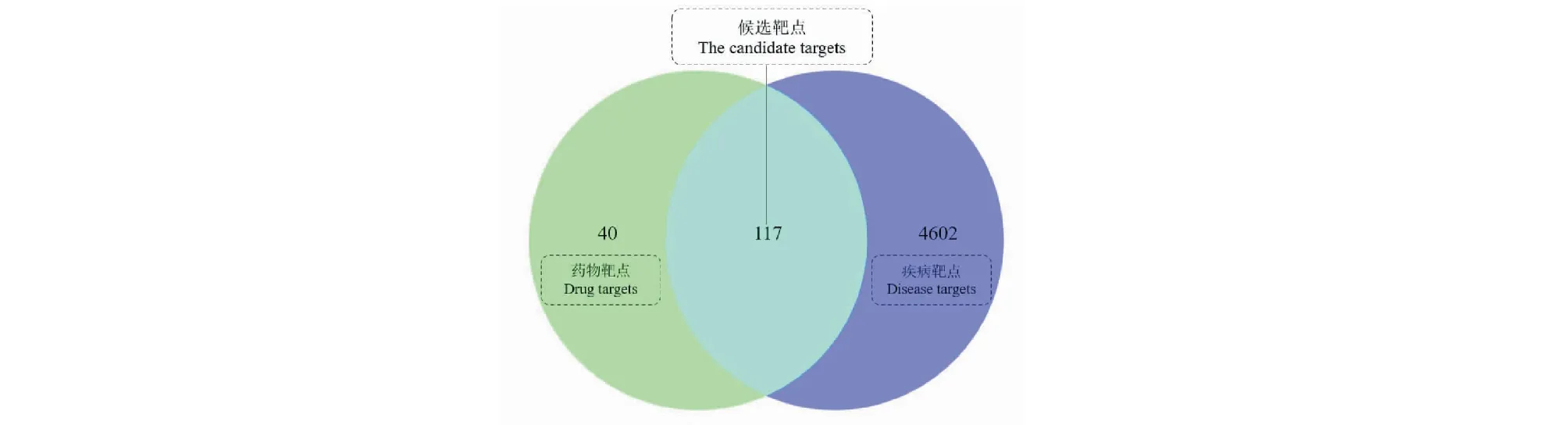
圖3 藥物和疾病靶點韋恩圖
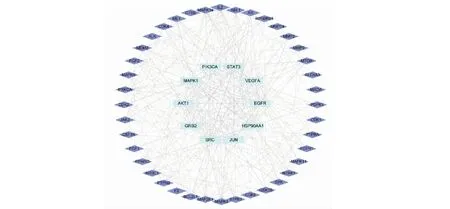
圖4 樞紐基因蛋白互作網(wǎng)絡
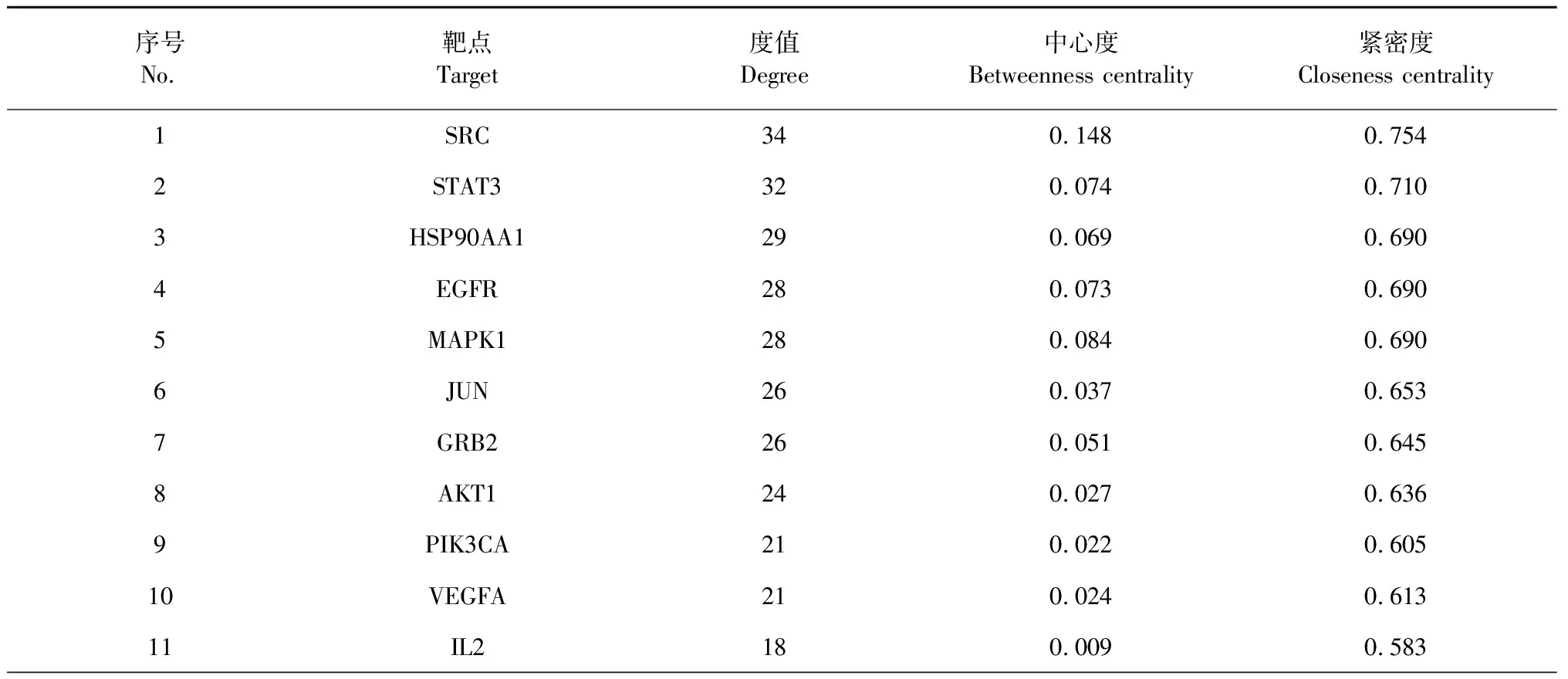
表4 FDPQ治療動脈粥樣硬化的核心靶點及拓撲參數(shù)
2.3 GO功能和KEGG通路富集分析結果
為了研究靶基因的生物學功能,對50個樞紐基因進行了三種GO功能分析,包括生物過程(biological processes,BP)、細胞組分(cellular components,CC)和分子功能(molecular functions,MF),將富集顯著的結果可視化(P< 0.01),見圖5A。BP主要包括跨膜受體蛋白酪氨酸激酶信號通路(transmembrane receptor protein tyrosine kinase signaling pathway)、酶聯(lián)受體蛋白信號通路(enzyme linked receptor protein signaling pathway)、細胞遷移正向調節(jié)(positive regulation of cell migration)等。CC主要有受體復合物(receptor complex)、黏著斑(focal adhesion)、細胞-基質結(receptor complex)等。MF主要涉及蛋白質絲氨酸/蘇氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)、蛋白激酶活性(protein kinase activity)、磷酸轉移酶活性(phosphotransferase activity)等。KEGG通路富集分析可說明FDPQ在治療AS時,作用于何種通路。50個樞紐基因篩選出了15條(P< 0.01)富集顯著且與疾病相關性大的信號通路,結果如圖5B和表5所示。主要信號通路包括PI3K-Akt信號通路、脂質和動脈粥樣硬化相關通路(lipid and atherosclerosis)、MAPK信號通路、VEGF信號通路等。
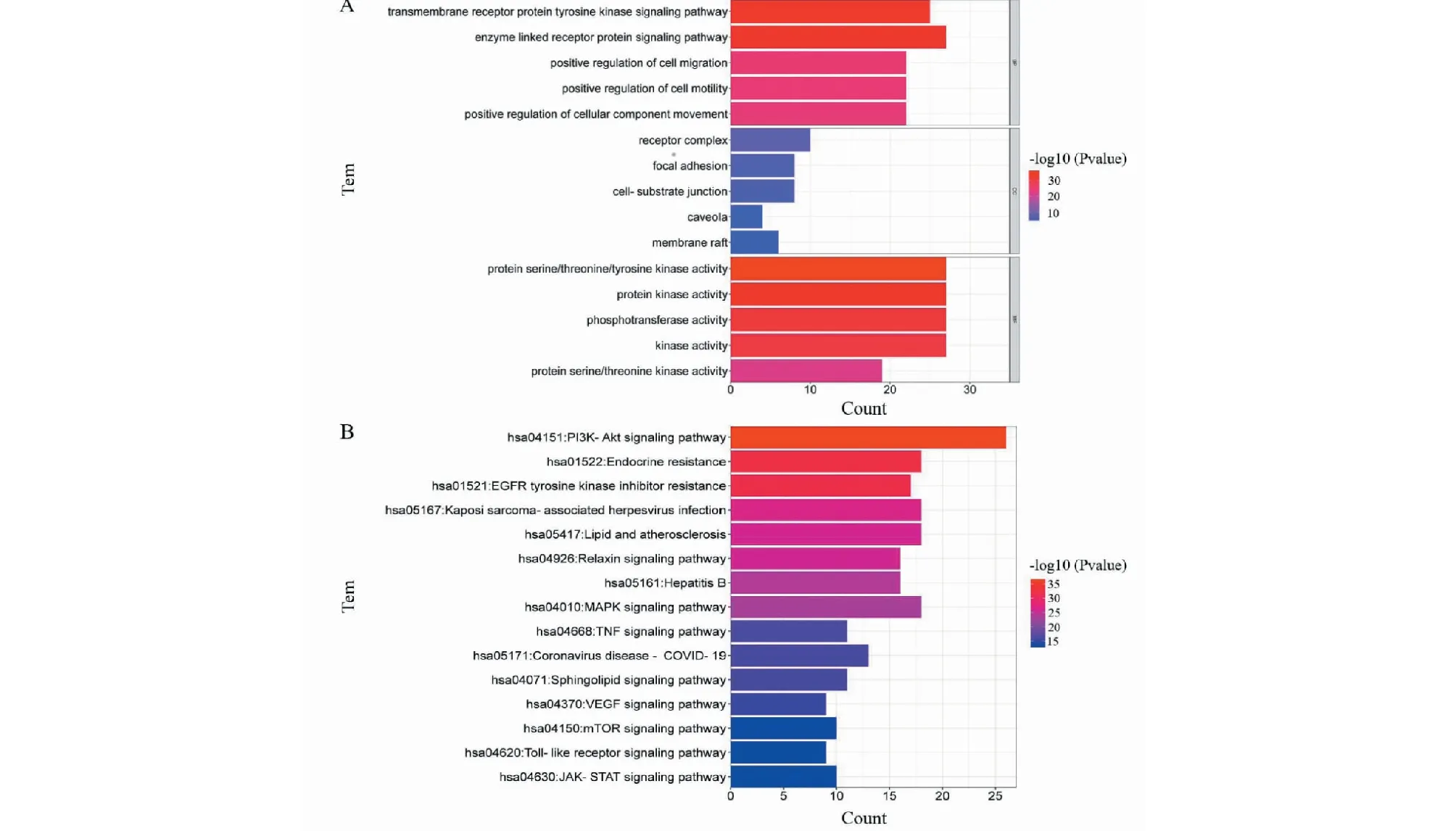
圖5 樞紐基因GO(A)和KEGG(B)通路分析
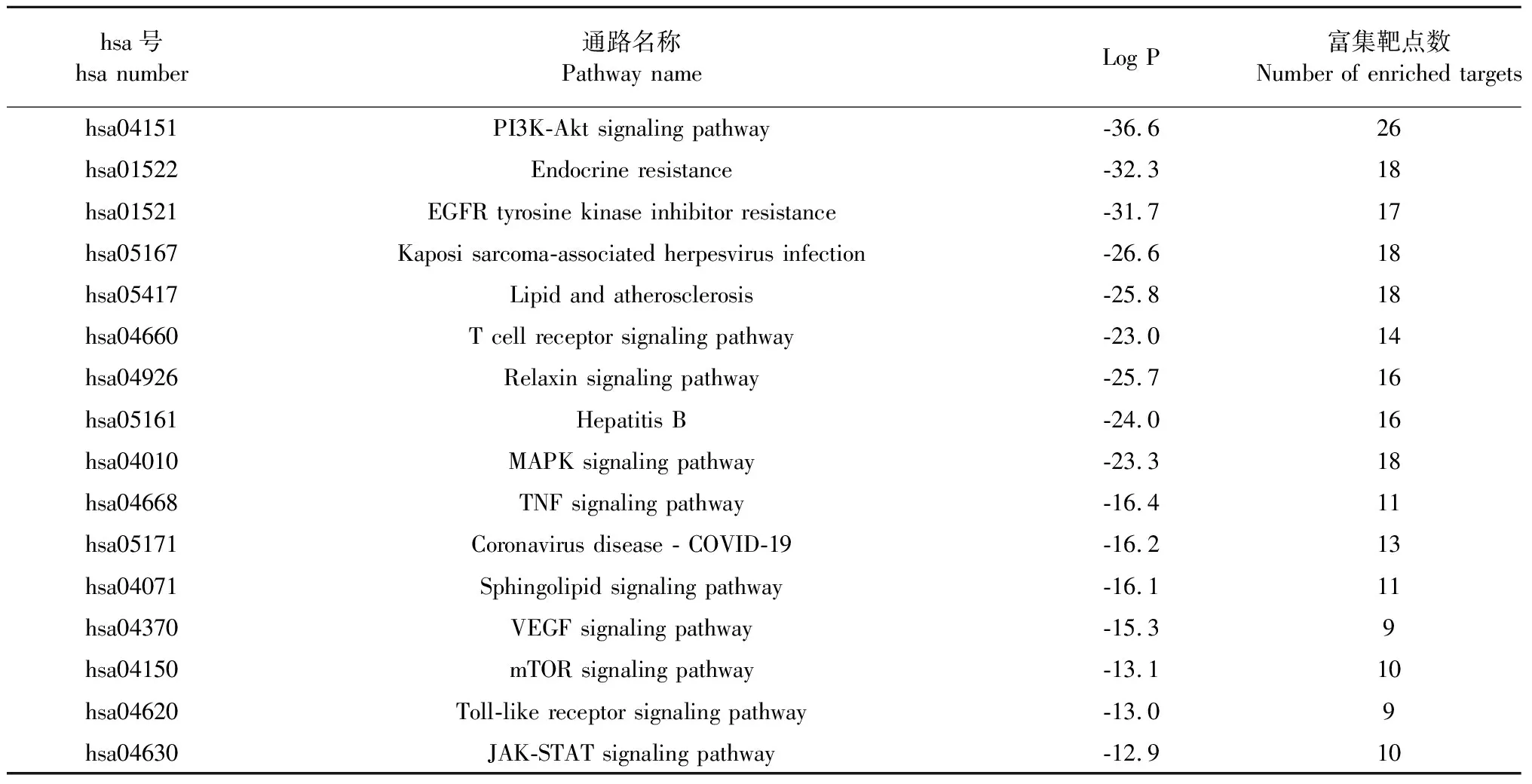
表5 樞紐基因KEGG通路分析
2.4 藥物-成分-靶點-疾病-通路網(wǎng)絡圖
為了進一步篩選FDPQ皂苷類成分治療AS的作用機制,利用Cytoscape軟件構建了藥物-成分-靶點-疾病-通路網(wǎng)絡圖(見圖6),直觀地展示了各部分間的關系。此網(wǎng)絡由90個節(jié)點和470條邊構成,其中包括動脈粥樣硬化(atherosclerosis,AS)(粉色圓角方形節(jié)點),西洋參(Panacis Quinquefolii Radix,PQ)(藍色方形節(jié)點),23個皂苷類化合物(紫色圓角方形節(jié)點),50個靶點(紅色長方形節(jié)點)和15條作用通路(綠色V形節(jié)點)。以degree值篩選關聯(lián)緊密的節(jié)點。G20、G22、G19、G5、G3、G6度值大,表明人參皂苷Rk3(G-Rk3)、人參皂苷Rh4(G-Rh4)、人參皂苷Rg4(G-Rg4)、20(R)-人參皂苷Rh1(20(R)-G-Rh1)、擬人參皂苷F11(P-F11)、20(S)-人參皂苷Rh1(20(S)-G-Rh1)可能是FDPQ治療AS的重要成分;STAT3、PIK3CA、MAPK1、AKT1、VEGFA排名靠前,提示他們是治療疾病的重要靶點;PI3K-Akt信號通路、內(nèi)分泌抵抗(endocrine resistance)、脂質和動脈粥樣硬化相關通路(lipid and atherosclerosis)、MAPK信號通路、VEGF信號通路則是治療疾病的重要信號通路。
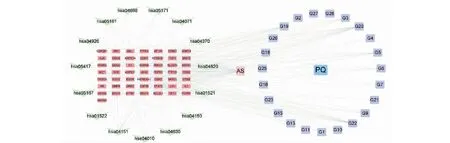
圖6 藥物-成分-靶點-疾病-通路網(wǎng)絡
2.5 分子對接結果和分析
依據(jù)前文結果,選擇STAT3、PIK3CA、MAPK1、AKT1、VEGFA等靶點與G-Rk3、G-Rh4、G-Rg4、20(R)-G-Rh1、P-F11、20(S)-G-Rh1進行對接,預測靶點和成分間的結合能力,通過與原配體的對接分數(shù)進行比較,來評估化合物和靶點蛋白的親和力。對接分數(shù)如表6所示,與原配體相比,6個化合物均與靶點VEGFA(原配體PDB ID:MES)有強烈的親和力,與靶點PIK3CA(原配體PDB ID:VY4)有較好的或與原配體相似的親和力;G-Rg4與靶點STAT3(原配體PDB ID:KQV)、MAPK1(原配體PDB ID:KE8)展現(xiàn)出較好的親和力;20(R)-G-Rh1、P-F11和靶點AKT1(原配體PDB ID:G4K)的親和力與原配體的相似。因此,推測G-Rk3、G-Rh4、G-Rg4、20(R)-G-Rh1、P-F11可能是FDPQ治療AS的主要活性成分,PIK3CA、VEGFA是主要的潛在靶點。靶點和活性成分的典型對接結果如圖7所示。其中,20(R)-G-Rh1相較于原配體和靶點VEGFA有著最高的對接得分。20(R)-G-Rh1以良好的姿態(tài)鑲嵌于靶點VEGFA的結合區(qū)域中,殘基CYS68、ILE46、ASP63、TYP45在對接過程中發(fā)揮了重要作用。殘基ASP63的羧基與配體的C12羥基氫形成了弱氫鍵,氫鍵距離為4.45 nm;TYR45的酚羥基與配體的羥基氫形成了弱氫鍵,氫鍵距離為5.48 nm。殘基CYS68和ILE46分別在配體的兩端發(fā)生了疏水相互作用,見圖7(E-3)。
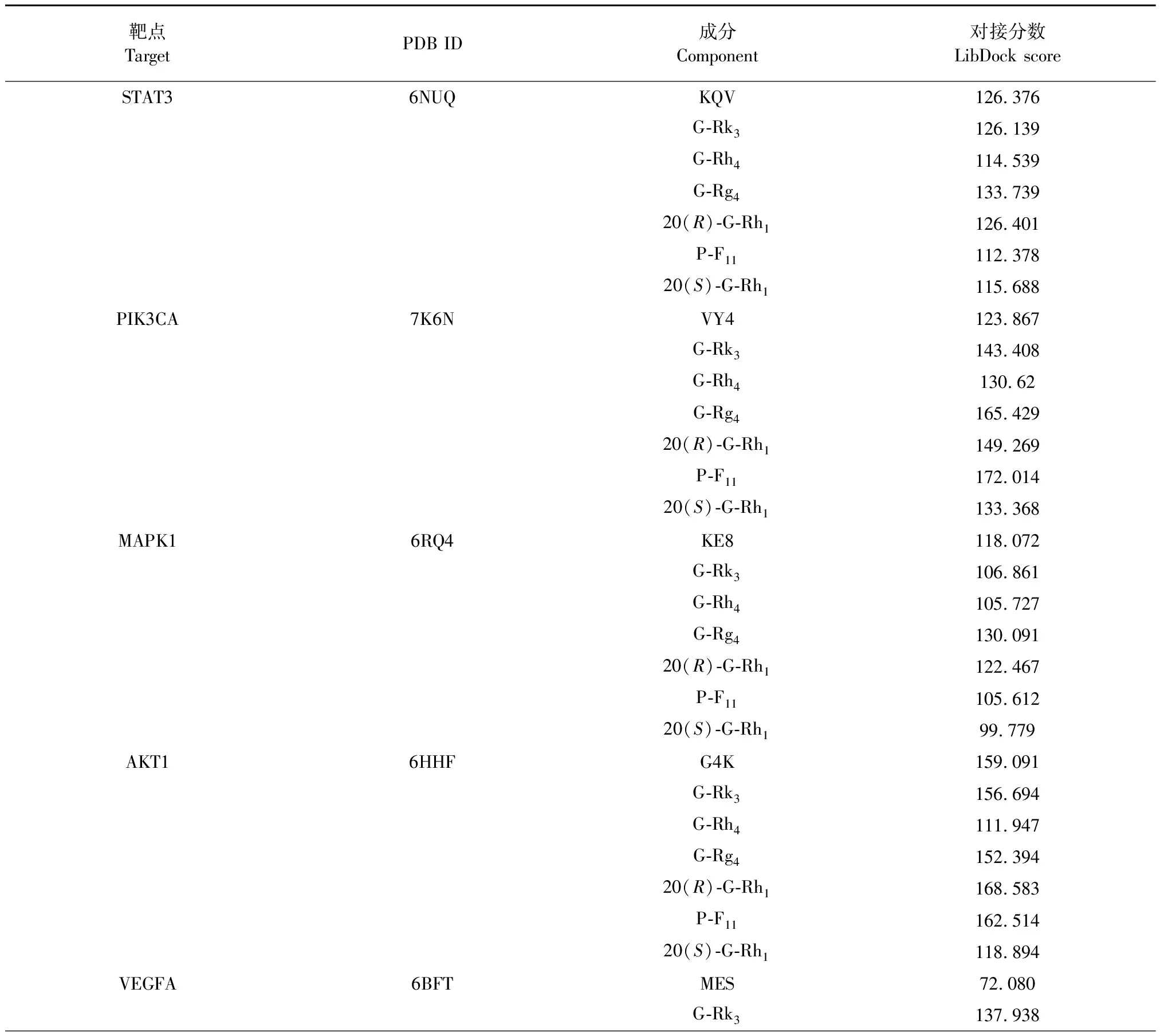
表6 活性成分和關鍵靶點分子對接結果
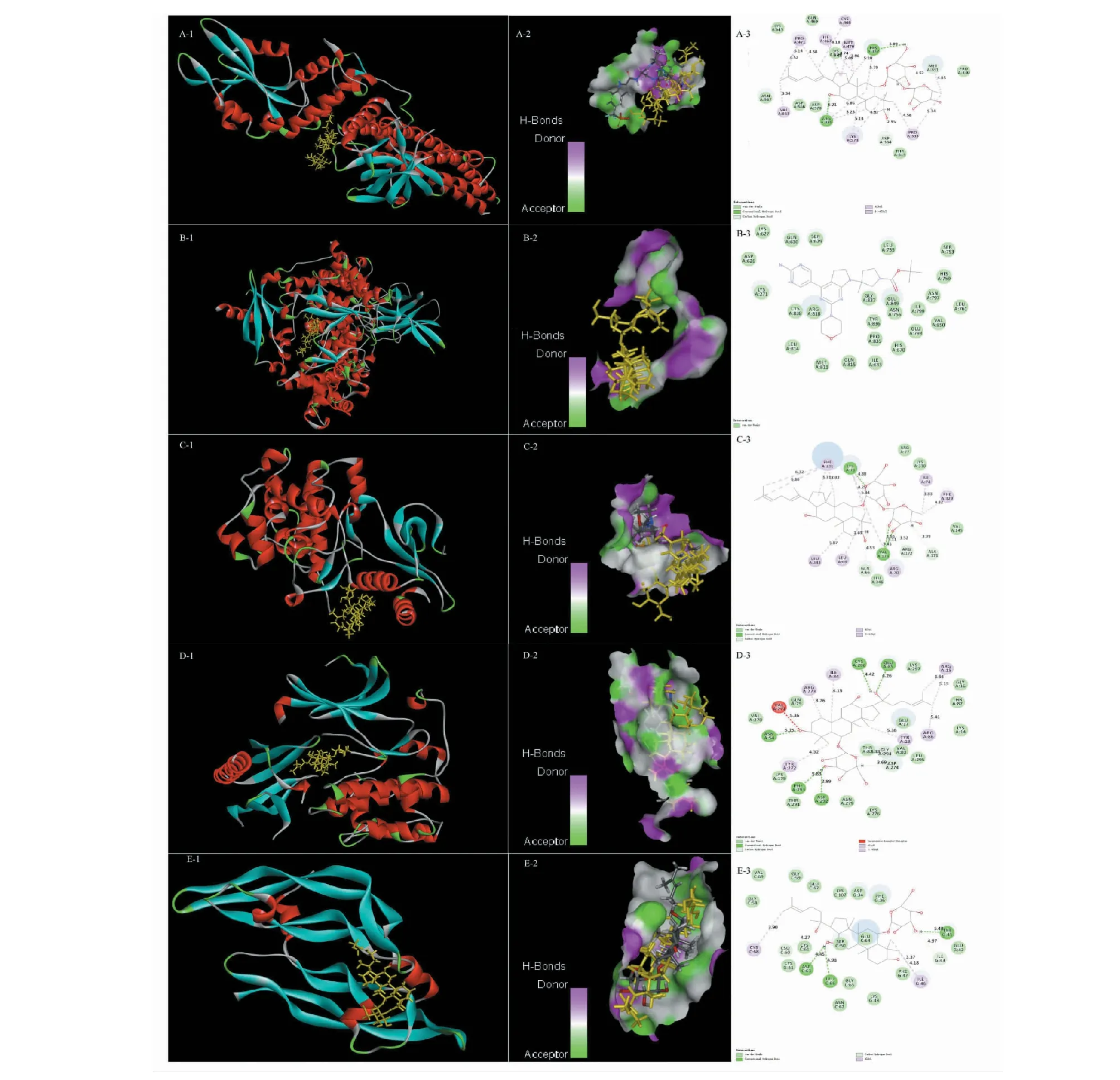
圖7 6個活性化合物與5個靶點蛋白的分子對接作用模式
2.6 細胞實驗驗證結果
2.6.1 FDPQ對H2O2處理的PC12細胞具有保護作用
如圖8A所示,F(xiàn)DPQ提取物的濃度在5、10、20、40、60、80、100、120 μg/mL時,對PC12細胞無明顯的抑制作用,各組的細胞活力是近似的,說明提取物在該濃度范圍內(nèi)對PC12細胞基本無毒性。因此,我們選擇40 μg/mL(低劑量組)、60 μg/mL(中劑量組)、80 μg/mL(高劑量組)作為本研究的干預濃度。圖8B顯示了不同濃度的H2O2在不同處理時間對PC12細胞活力的影響。40 μmol/L H2O2刺激24 h后,PC12細胞活性下降約40%,因此確定本研究的最佳干預濃度為40 μmol/L,最佳干預時間為24 h。如圖8C所示,與模型組相比,F(xiàn)DPQ提取物能增加H2O2處理的PC12細胞的細胞活力,且呈劑量依賴性。表明FDPQ對H2O2誘導的PC12細胞損傷具有改善作用。
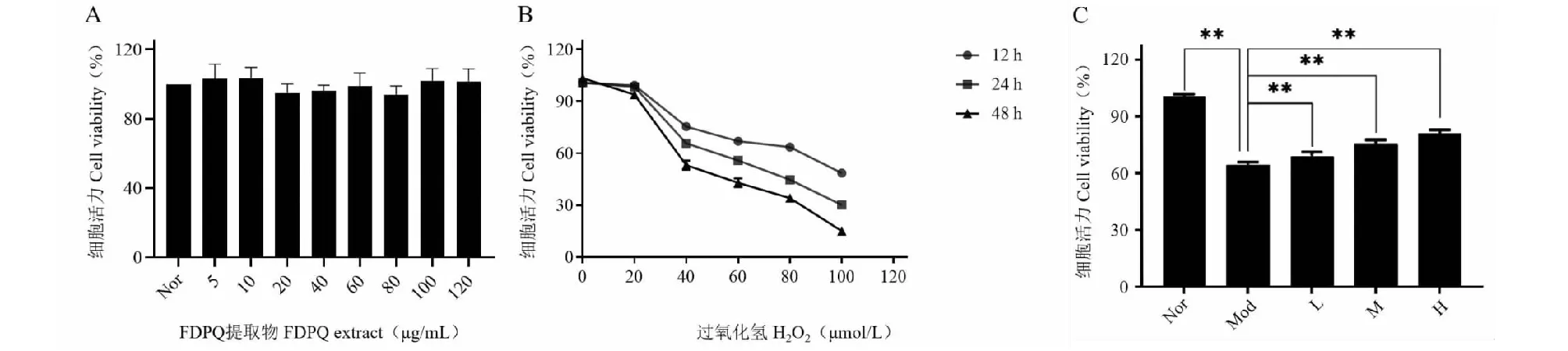
圖8 FDPQ對H2O2誘導的PC12細胞的保護作用
2.6.2 FDPQ可升高PC12細胞線粒體膜電位
線粒體膜電位(MMP,ΔΨm)下降被認為是細胞凋亡的早期特征。同時,MMP在維持線粒體正常生理功能方面亦具有重要意義,MMP的降低常被作為線粒體功能障礙的重要指標[13]。JC-1探針是一種理想的熒光探針,廣泛用于檢測細胞MMP的變化。在正常的生理條件下,JC-1聚集在細胞線粒體的基質中,形成一種能發(fā)出紅色熒光的聚合物。當MMP被還原時,JC-1不能聚集到線粒體基質上,以單體形式存在,發(fā)出綠色熒光。通過比較熒光強度的變化可以檢測MMP的變化(見圖9)。在H2O2作用24 h后,PC12細胞的紅色熒光顯著減弱,對應的綠色熒光顯著增強,表明細胞發(fā)生了MMP損失。但與模型組相比,不同濃度的FDPQ提取物(40、60、80 μg/mL)預處理后,細胞的紅色熒光逐漸增強,提示FDPQ可以降低H2O2誘導的MMP損失。
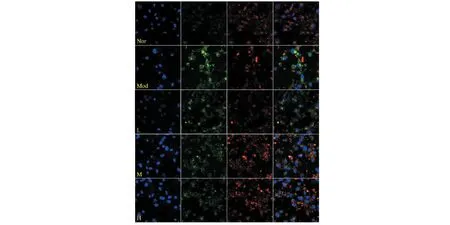
圖9 FDPQ對PC12細胞的膜電位的影響
2.6.3 FDPQ可降低H2O2誘導的PC12細胞氧化應激
當細胞出現(xiàn)氧化應激時,細胞內(nèi)的抗氧化酶系統(tǒng)會被激活,抑制活性氧(ROS)的過度產(chǎn)生,SOD、CAT是重要的活性氧清除酶。MDA是氧化應激引起的脂質過氧化形成的脂質過氧化物,具有細胞毒性,會攻擊并破壞細胞膜[14]。MDA水平檢測亦可評估細胞內(nèi)氧化應激水平[13]。因此,為了評價FDPQ對H2O2誘導的氧化應激的影響,我們檢測了FDPQ提取物(40、60、80 μg/mL)干預后H2O2誘導的PC12細胞中的MDA的生成以及SOD、CAT的活性。如圖10所示,與正常組比較,PC12細胞在H2O2刺激24 h后,細胞內(nèi)MDA水平顯著升高,F(xiàn)DPQ預處理可抑制MDA的產(chǎn)生,并具有濃度依賴性(見圖10A)。此外,H2O2刺激可降低細胞中抗氧化酶CAT、SOD的活性,F(xiàn)DPQ預處理可以提高這些酶的活性(見圖10B、10C)。上述結果表明,F(xiàn)DPQ可通過提高活性氧清除酶的活性來降低H2O2誘導的PC12細胞氧化應激。
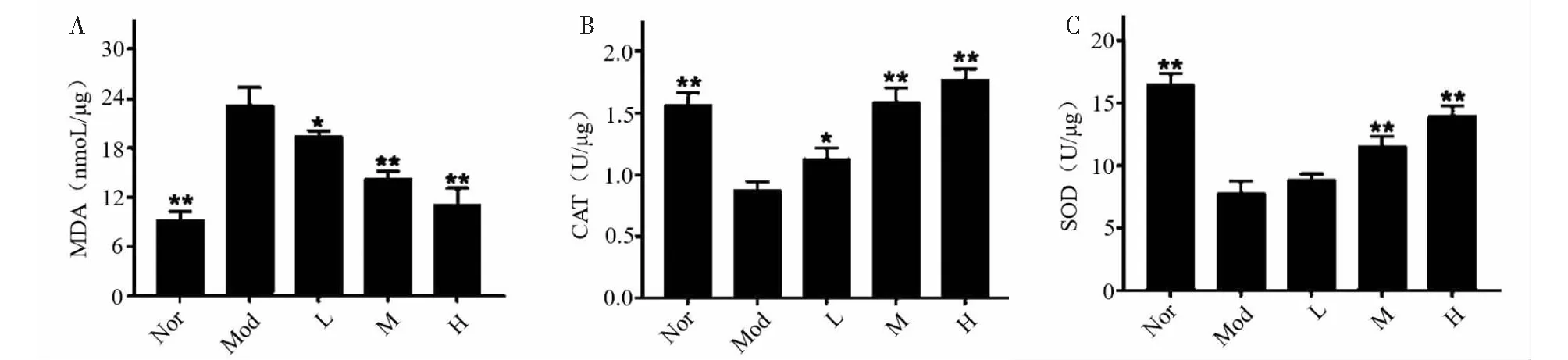
圖10 FDPQ對H2O2誘導的PC12細胞的MDA水平(A)、抗氧化酶CAT(B)、SOD(C)的活性的影響
2.6.4 FDPQ可上調相關基因的mRNA表達
為了闡明FDPQ對H2O2誘導的PC12細胞氧化損傷的保護作用的分子機制,采用qRT-PCR檢測相關基因的mRNA表達。如圖11所示,與正常組相比,H2O2誘導后,PI3K、Akt的mRNA表達顯著下調。不同濃度的FDPQ提取物(40、60、80 μg/mL)預處理PC12細胞后,這些基因的mRNA表達較模型組上調,且具有濃度依賴性。提示FDPQ可能通過調控PI3K/Akt的表達來改善H2O2誘導的PC12細胞的氧化損傷。

圖11 FDPQ對H2O2誘導的PC12細胞中PI3K(A)和Akt(B)的mRNA表達的影響
3 討論與結論
目前,每年死于缺血性心腦血管疾病的人數(shù)居全球首位,以AS引起的心肌梗塞和腦梗塞是死亡率最高的血管類疾病[15]。課題組前期研究發(fā)現(xiàn),F(xiàn)DPQ或具有干預或治療動脈粥樣硬化的作用。FDPQ相較于傳統(tǒng)烘干西洋參,部分皂苷類成分含量有所提高,但由于干燥方式機理的不同,尚不確定皂苷類成分種類是否改變;同時,中藥數(shù)據(jù)庫中有效成分的信息來源單一,甚至陳舊,不能全面、及時地反映FDPQ中所含成分[16]。因此,本文先通過UPLC-QE-Orbitrap-MS/MS鑒定出FDPQ中的皂苷類成分,再以網(wǎng)絡藥理學結合分子對接探索其治療AS的藥效物質和作用機制,并輔以細胞實驗進行初步驗證。
UPLC-Q Exactive Orbitrap-MS/MS分析鑒定出了28種人參皂苷,包括人參皂苷Rb1、Rc、Rd等原人參二醇型,人參皂苷Re、Rh1、Rg4等原人參三醇型以及奧克梯隆型的擬人參皂苷F11。基于數(shù)據(jù)庫的篩選,獲得FDPQ治療AS的候選靶點117個,包括STAT3、EGFR、MAPK1、AKT1、PIK3CA、VEGFA等21個核心靶點。表明FDPQ治療AS具有多成分、多靶點的特點。藥物-成分-靶點-疾病-通路網(wǎng)絡分析顯示,人參皂苷Rk3、人參皂苷Rh4、人參皂苷Rg4、擬人參皂苷F11、20(R/S)-人參皂苷Rh1等成分關聯(lián)的靶點較多,可能是FDPQ治療AS的重要成分。現(xiàn)有研究表明人參皂苷Rk3具有抗氧化、抗凋亡和抗炎作用,可顯著降低NF-κB、TNF-α、IL-6和IL-1β等炎癥因子的表達,顯著降低血清中AST和ALT水平,減少氧化應激發(fā)生[17]。人參皂苷Rg4可顯著清除ROS,抑制ROS誘導的p38絲裂原活化蛋白激酶(MAPK)的激活,有助于維持內(nèi)皮細胞的完整性[18]。擬人參皂苷F11是西洋參的特有成分,研究表明其可通過減輕自噬/溶酶體缺陷和抑制鈣超載,對中風起到神經(jīng)保護作用,亦可通過激活BDNF/TrkB通路,改善腦卒中后長期神經(jīng)功能損傷,促進腦卒中后神經(jīng)發(fā)生,尤其是在缺血性腦卒中的慢性康復中有著巨大的潛在作用[19]。GO和KEGG富集結果提示FDPQ治療AS的機制主要與PI3K-Akt信號通路、內(nèi)分泌抵抗(endocrine resistance)、脂質和動脈粥樣硬化相關通路(lipid and atherosclerosis)、MAPK信號通路、VEGF信號通路等相關,顯示出FDPQ治療AS具有多靶點、多途徑的特點。分子對接結果表明活性成分與潛在靶點具有較好的結合活性,網(wǎng)絡藥理學的分析結果具有一定的可靠性。
越來越多的研究支持AS是一種始于血管內(nèi)皮損傷的慢性炎癥疾病[20],相關炎癥是由促炎細胞因子、炎癥信號通路、生物活性脂質和黏附分子介導的。近年來的研究證實,PI3K/Akt信號通路在炎癥反應中起著重要作用。PI3K是一類特異性催化磷脂酰肌醇脂類物質的蛋白激酶,Akt是一種絲氨酸/蘇氨酸蛋白激酶,又稱蛋白激酶B。PI3K特異性催化PI產(chǎn)生的PIP3可使Akt完全活化,從而引起PI3K/Akt信號傳導通路的級聯(lián)反應,如調節(jié)NF-κB、TNF-α、IL-6和IL-1β等炎癥因子的釋放[21]。調控這些信號通路可以達到抑制炎癥反應,改善氧化應激損傷,減輕脂質沉積和內(nèi)皮損傷的作用[22]。NF-κB通路的激活在炎癥反應中起著重要作用[23]。蛋白激酶MAPK是轉導信號引起細胞反應的重要物質。MAPK家族亞系p38MAPK應激敏感性激酶被激活后,可通過磷酸化或促炎細胞因子(如TNF-α)來活化NF-κB,NF-κB被激活后亦通過其產(chǎn)生的促炎細胞因子反向激活p38MAPK,二者間的雙向作用加速了AS的發(fā)展[24]。血管內(nèi)皮生長因子(VEGF)由多種細胞分泌,并與內(nèi)皮細胞中的同源酪氨酸激酶VEGF受體(VEGFR-1、VEGFR-2、VEGFR-3)結合,產(chǎn)生各種下游效應,促進新生血管的形成及血管內(nèi)皮細胞的生長,進而促進心臟或腦組織缺血再灌注后的功能恢復[25]。VEGF-Akt是經(jīng)典的促進內(nèi)皮細胞增殖、抑制細胞凋亡和促進血管新生的信號通路。研究顯示,VEGF通過下游的PI3K-Akt信號級聯(lián),以BAD途徑抑制細胞凋亡,以mTORC2和FOXO1促進內(nèi)皮細胞增殖和血管新生[26]。在本研究中,對篩選出的可能機制展開了體外細胞實驗驗證,結果表明FDPQ可升高H2O2誘導的PC12細胞的線粒體膜電位,提高SOD、CAT等抗氧化酶的活性,降低細胞內(nèi)MDA水平,同時上調PI3K/Akt的表達,提示FDPQ治療動脈粥樣硬化可能與其改善氧化損傷、抑制凋亡和炎癥有關。
本研究初步闡釋了FDPQ治療AS多成分、多靶點、多途徑的作用機制,但仍需進一步的實驗驗證。同時,本研究的另一個局限性是未包括多糖、蛋白質等大分子化合物,亦需要進一步的研究。

