大鼠脊髓內嗎啡肽2的表達與腰椎間盤突出癥坐骨神經痛的相關性分析*
牛 樂,王延軍,岳江濤,梅江濤,賈曉康,戴先文
(1.西安市大興醫院骨科 710016;2.西安市長安醫院骨科 710016)
腰椎間盤突出癥坐骨神經痛(lumbar disc herniation sciatica,LDHS)是腰椎間盤突出癥最常見的并發癥,LDHS表現為單側或雙側下肢放射痛,逐漸加重的放射痛長期折磨患者,部分患者甚至合并有焦慮和抑郁等精神、心理障礙。傳統的外科治療手段存在創傷大、費用高及風險高等缺點[1-2]。LDHS患者的生活質量受到了極大影響,因此進一步揭示其發病機制,研制新型鎮痛藥物及探尋更有效的治療方法刻不容緩[3]。內嗎啡肽(endomorphin,EM)包括內嗎啡肽2 (endomorphin-2,EM2)和內嗎啡肽1 (endomorphin-1,EM1)是嗎啡的內源性相似物,其主要作用于μ型阿片受體(mu-opioid receptor,MOR)產生鎮痛作用,與相同量的嗎啡比能產生更強的止痛效果,而極少產生不良反應[4-5]。以往有學者建立坐骨神經分支選擇性損傷(spared nerve injury,SNI)神經病理性痛小鼠模型,經中樞側腦室或外周腳趾給藥后發現EM2和EM1能產生比嗎啡更強的鎮痛作用[6]。脊髓背角是痛覺信號傳遞的初級中樞和第一道閘門,脊髓背角富含EM2,其來源于背根節神經元的初級傳入纖維。脊髓背角EM2在神經病理性痛狀態下痛覺信號傳遞的調控中扮演著極為重要的角色[7-8]。LDHS本身就是神經病理性痛,但既往并無文獻報道脊髓EM2與LDHS的相關性。本研究以LDHS大鼠為實驗動物模型,綜合利用痛覺行為學、藥理行為學、生物化學及形態學等實驗方法探尋脊髓背角EM2表達量的變化及其與LDHS痛覺閾值的關聯性,從一個嶄新的角度解釋LDHS的發病機制。
1 材料與方法
1.1實驗動物
本研究所有實驗操作均嚴格遵循善待動物的國際倫理準則[9]。成年雄性SD大鼠(體重200 g左右),來源于西安交通大學實驗動物中心(動物使用合格證號:SYXK陜2021-008,動物生產許可證號:SCXK陜2021-006)。
1.2方法
1.2.1動物分組
大鼠隨機分為LDHS組、假處理組和對照組,LDHS組采用自體髓核移植法造模,假處理組采用相同的手術過程而未移植髓核,對照組為空白對照,未經任何處理。
1.2.2實驗設計
大鼠共計220只用于本實驗。首先,對照組、假處理組和LDHS組每組各10只,共計30只用于痛覺行為學實驗;然后LDHS組大鼠共計10只,在造模后15 d進行行為藥理學實驗,即經脊柱鞘內置管后注射不等劑量MOR拮抗劑——β-富納曲胺(β-funaltrexamine,β-FNA)、EM2、EM1或嗎啡,然后記錄痛覺閾值的變化;最后,180只用于生化實驗和形態學實驗,LDHS組、假處理組和對照組在造模前和造模后5、10、15、20、25 d共6個時間點(每組各10只/時間點),大鼠被處死后取出脊髓組織,利用免疫熒光組織化學染色和高效液相色譜法(high performance liquid chromatography,HPLC)檢測脊髓EM2表達水平的變化。
1.2.3建立動物模型
LDHS模型的建立遵照既往造模方法[10-11],即經腹腔注射2%戊巴比妥(50 mg/kg)淺麻醉大鼠,取俯臥位,以L4~L6為中心用聚維酮碘消毒皮膚3遍,取后正中縱行1.5 cm切口,逐層分離筋膜層和椎旁肌,顯露L5~L6關節突關節,咬除部分關節突關節及部分L5椎板,顯露L5背根神經節及神經根。距肛門1 cm處斷尾并縫合傷口。依次切開尾椎髓核環,取出直徑3 mm髓核3個,將取出的髓核壓迫于L5神經根側方,用無菌生理鹽水及稀釋聚維酮碘液反復沖洗傷口3遍,逐層縫合切口,最后外用紅霉素軟膏預防感染。
1.2.4行為藥理學
行為藥理學實驗只在LDHS組進行,不在對照組和假處理組進行。鞘內置管:將2%戊巴比妥鈉(50 mg/kg)注射入腹腔淺麻醉大鼠,用聚維酮碘消毒局部皮膚3遍,于L4棘突取后正中縱形切口0.5 cm,鈍性分離淺筋膜及椎旁肌,顯露椎骨,用咬骨鉗咬除小部分黃韌帶及椎板,剪開硬脊膜,將PE-10細導管置入蛛網膜下腔,導管遠端直達腰膨大處,見有腦脊液不斷流出即封閉導管外口,用無菌生理鹽水及稀釋聚維酮碘液反復沖洗傷口3遍,逐層縫合,最后外用紅霉素軟膏預防感染。若大鼠麻醉清醒后雙下肢無運動障礙,且鞘內注入2%利多卡因后雙下肢5 s內癱軟,即為鞘內置管成功[12-13]。鞘內給藥:LDHS組,鞘內給予嗎啡(0.3、1.0、3.0 μg)、EM1(0.3、1.0、3.0 μg)、EM2 (0.3、1.0、3.0 μg)或β-FNA(3.0、10.0 μg);溶劑對照組給予等量無菌生理鹽水,然后檢測痛覺閾值變化,同時計算不同劑量嗎啡、EM1或EM2的最大鎮痛百分比(%) =(給藥后最高閾值-給藥前閾值)/(造模前閾值-造模后最低閾值)×100%。
1.2.5痛覺閾值檢測
von Frey纖維絲是國際公認的檢測痛覺閾值的經典實驗儀器,本研究所使用von Frey纖維絲購自美國Stoelting公司,將大鼠放置于鐵絲網上,用有機玻璃透明罩約束其活動范圍。大鼠先適應15 min,然后用von Frey纖維絲刺戳足底,刺激的力量強度由小至大,以“g”表示。若出現縮足反射,則該強度被及時記錄,該強度重復測量10次,若出現5次以上縮足反射即認為陽性反應,出現陽性反應的最小強度即為痛覺閾值[14-15]。痛覺閾值單位為“g”。
1.2.6免疫熒光染色
將2%戊巴比妥鈉(100 mg/kg) 注射入腹腔深麻醉大鼠,開胸顯露心臟,剪破右心耳徹底放血,經左心室插管至升主動脈,先用PBS快速沖洗掉機體內殘存的血液,再用4%多聚甲醛緩慢灌注固定,時長30 min。隨后取出脊髓腰膨大,將組織塊浸入含30%蔗糖的PBS,時長12 h。恒冷箱切片機切取25 μm厚的脊髓組織片,組織片被PBS漂洗3次后,用兔抗EM2 IgG(美國Chemicon公司,貨號AB5104,濃度為1∶200)室溫下孵育組織片12 h;組織片被PBS徹底漂洗后,紅色熒光素Cy5標記的二抗室溫孵育組織片6 h;再次被PBS徹底漂洗后利用熒光顯微鏡攝片觀察。
1.2.7HPLC定量分析EM2表達水平
將2%戊巴比妥鈉(100 mg/kg) 注射入腹腔深麻醉大鼠,迅速取出脊髓腰膨大,液氮凍存;將組織塊與裂解液混合,超聲裂解后超高速離心取上清液;Hypersil ODS 填料色譜柱(4.6 mm×250 mm,5 μm,美國Termo Electron公司);柱溫為40 ℃;進樣量為10 μL;流動相∶甲醇-0.1%三乙胺溶液(65∶35);流速為1.0 mL/min;檢測波長為570 nm[16]。
1.3統計學處理
2 結 果
2.1LDHS大鼠痛覺閾值顯著降低,形成了機械性異常疼痛
與對照組[(27.0±2.6)g]和假處理組[(27.1±1.5)g]比較,LDHS組在大鼠自體髓核移植后5 d痛覺閾值顯著降低[(11.2±2.5)g],15 d時達到最低值[(5.0±1.8)g],即機械性異常疼痛已顯著形成,并且15 d后機械性異常疼痛穩固維持(n=10,P<0.05);在造模前3組之間痛覺閾值無差異;對照組和假處理組痛覺閾值在造模后也無差異,見圖1、表1。
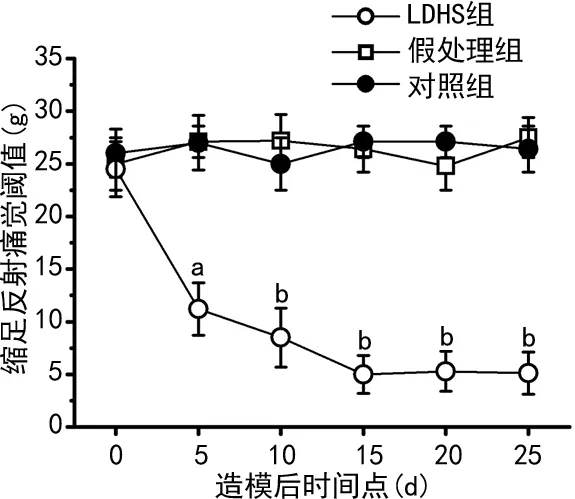
a:P<0.05,b:P<0.01,與對照組比較。
表1 各組造模前及造模后痛覺閾值比較
續表1 各組造模前及造模后痛覺閾值比較
2.2LDHS大鼠拮抗內源性EM2加深疼痛,給予外源性EM2鎮痛作用明顯
在LDHS組痛覺閾值的最低點,即造模后15 d經鞘內給予β-FNA能夠明顯加深疼痛(圖2A);而鞘內給予EM2能劑量依賴地產生鎮痛作用(圖2B);EM1或嗎啡經鞘內給藥后均能劑量依賴性地鎮痛(圖2C、D);但在相同劑量情況下,EM2鎮痛作用比EM1和嗎啡強(圖2E)。
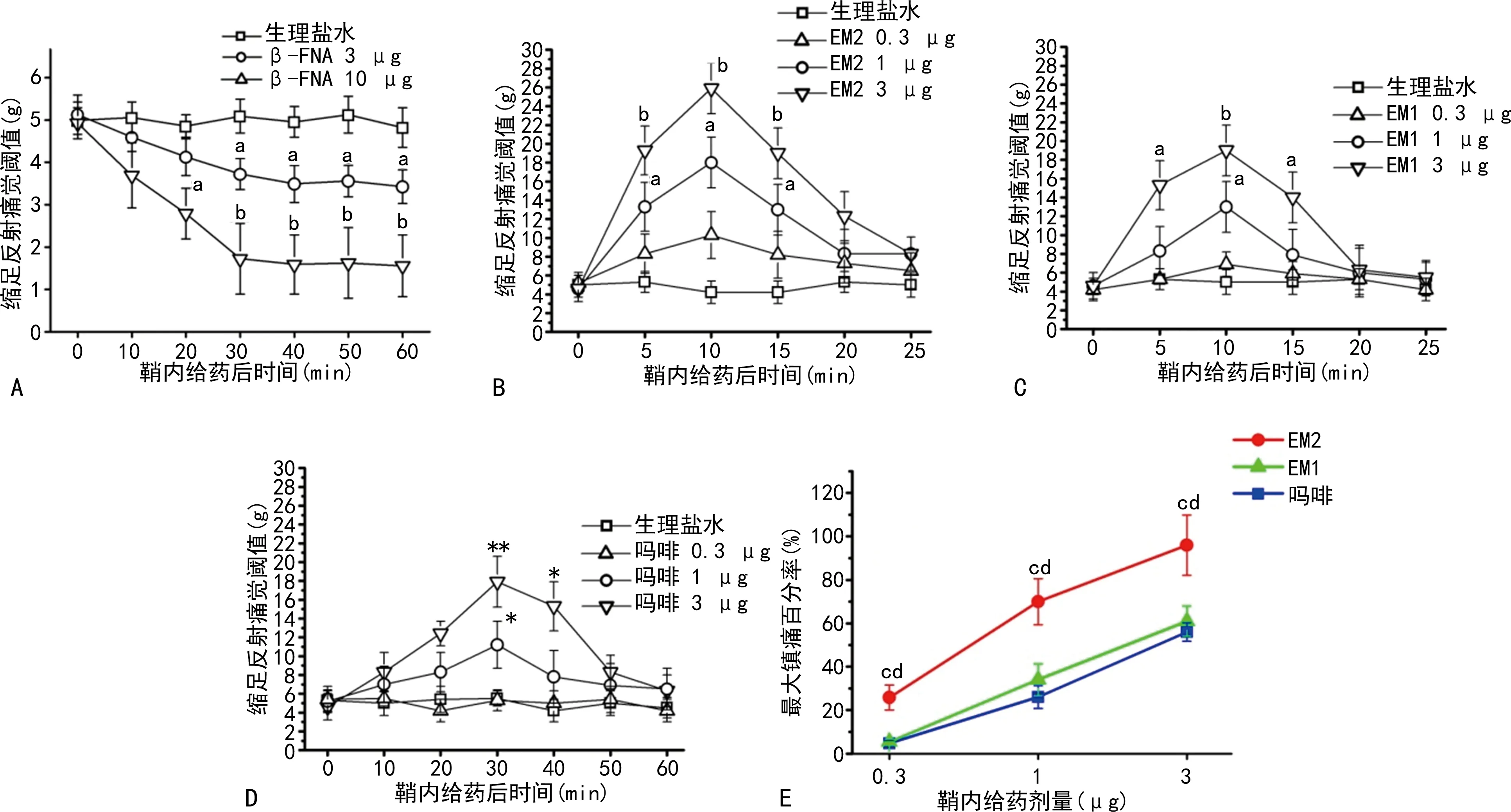
A:鞘內給予β-FNA;B:鞘內給予EM2;C:鞘內給予EM1;D:鞘內給予嗎啡;E:EM2、EM1、嗎啡鎮痛作用比較;a:P<0.05,b:P<0.01,與生理鹽水比較;c:P<0.05,與嗎啡比較;d:P<0.05,與EM1比較(E)。
2.3LDHS大鼠脊髓EM2顯著減少,與痛覺閾值的降低呈正相關
與假處理組[(77.6 ± 3.8)ng/mg]和對照組[(78.8 ± 4.6)ng/mg]比較,LDHS組脊髓EM2的表達在造模后5 d顯著減少[(47.8±5.3) ng/mg],15 d時減少至最低水平[(18.9±3.6) ng/mg],并在15 d一直維持此水平(n=10,P<0.05,圖3A)。LDHS組EM2的表達與痛覺閾值呈顯著正相關 (r=0.966,P<0.001,圖3B)。與假處理組和對照組比較,LDHS組脊髓背角EM2染色密度顯著減低,EM2免疫熒光陽性結構集中在脊髓背角淺層(圖3C)。
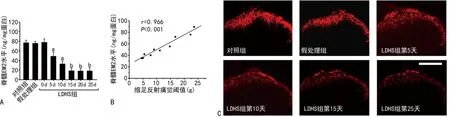
A:脊髓組織EM2表達量;B:LDHS組痛覺閾值與脊髓EM2表達水平的相關性;C:脊髓背角EM2免疫熒光染色標尺=200 μm(×200);a:P<0.05,b:P<0.01,與對照組比較。
3 討 論
隨著現代社會久坐及彎腰負重工作方式的增多,腰椎間盤突出癥呈年輕化態勢且發病率逐年攀升。LDHS是腰椎間盤突出癥最常見和棘手的并發癥,其表現為單側或雙側下肢放射痛,逐漸加重的放射痛長期折磨患者,部分患者甚至伴隨有下肢肌力減退及大小便障礙[1-3]。盡管外科治療手段日益成熟,但相當多的患者考慮到風險高及費用昂貴,仍要求保守治療。針對LDHS的內科鎮痛藥為弱阿片類或非甾體類藥物,這些藥物長期使用極易產生成癮性和耐受性,并且造成各種不良反應[17-18]。LDHS患者的生活質量受到了極大影響,因此進一步揭示其發病機制,研制新型鎮痛藥物及探尋更有效的治療方法刻不容緩[19]。既往腰部脊髓神經根的病變是LDHS研究的焦點,而本研究從新的角度提出脊髓EM2的低表達導致了LDHS的產生,為LDHS的預防和治療提供了新的理論意義。
既往研究表明,腰部神經根的機械性受壓和炎性變是LDHS發病的根本原因,然而近期諸多學者堅信脊髓和大腦的功能異常或病理改變在LDHS的發病過程中扮演著至關重要的角色[20]。脊髓背角是痛覺信號傳遞的第一道閘門和初級中樞,大腦中的前扣帶回皮質和島葉也與痛覺調控密切相關。有研究在功能性核磁共振檢查中發現LDHS患者脊髓背角、前扣帶回皮質及島葉處于過度激活和代謝活躍狀態[21]。另有學者發現LDHS大鼠脊髓背角神經元的自發放電頻率顯著增加[22],表明LDHS狀況下痛覺信號在脊髓背角的傳遞出現了強化和擴大。EM是最新發現的內源性阿片肽,包括EM2和EM1。EM作為內源性物質,與相同量的嗎啡比較能產生更強的止痛效果,而極少產生不良反應[4-8]。脊髓背角富含EM2,其在神經病理性痛的誘發和維持中扮演著極為重要的角色,外周神經結扎或切斷可導致脊髓EM2的表達顯著下調[23],全身或脊柱鞘內注射EM2可對神經病理性痛起到顯著的鎮痛作用[24]。鑒于既往無LDHS與脊髓EM2關聯性的文獻報道,本研究從新的切入點,即脊髓水平探索LDHS的發病機制。本研究建立的LDHS大鼠模型其下肢機械性異常疼痛穩定存在,本研究發現LDHS大鼠脊髓背角EM2的免疫熒光染色強度和脊髓EM2的表達水平均顯著減低。既往研究表明,在外周神經損傷性痛[23]、糖尿病性痛[16]及化療性痛[25]等動物模型脊髓背角EM2的表達水平顯著減少,本研究結果與既往研究結果具有一致性。本研究進一步分析發現LDHS大鼠脊髓EM2的表達水平與痛覺閾值呈顯著正相關,而鞘內給予β-FNA可使疼痛進一步加深,這就完全印證了本研究的結論,即LDHS大鼠脊髓背角EM2的表達水平下調導致內源性鎮痛作用的減小,最終強化痛覺信號的傳遞,導致LDHS大鼠痛覺閾值的減低。
楊代軍[6]研究表明,在坐骨神經分支選擇性損傷(SNI)神經病理性痛小鼠模型,經中樞側腦室或外周腳趾給藥后EM2和EM1能產生比嗎啡更強的鎮痛作用,但EM2和EM1的鎮痛持續時間比嗎啡短。本研究在LDHS大鼠經脊髓鞘內注射EM2能產生比EM1或嗎啡更強的鎮痛作用,同樣EM2和EM1的鎮痛持續時間比嗎啡短。楊代軍[6]研究與本研究的相似之處:均為建立動物疼痛模型,給藥EM2、EM1或嗎啡進行鎮痛研究,并且在鎮痛效能和鎮痛持續時間方面分析了EM2、EM1與嗎啡之間的區別。楊代軍[6]研究與本研究的區別之處:(1)楊代軍[6]在實驗中使用各種阿片受體拮抗劑進一步分析了EM鎮痛的阿片機制,其研究更加深入;而本研究未探索EM鎮痛的阿片機制。(2)兩種動物模型所代表的臨床實際意義不同。楊代軍[6]在實驗中建立SNI神經病理性痛模型,該模型主要模擬急性創傷患者,這些患者由于車禍、高處墜落、戰爭中槍擊或爆炸等原因導致下肢神經出現挫傷或離斷,引起下肢劇烈疼痛,疼痛程度較重;而本研究建立了LDHS模型,該模型主要模擬中老年腰椎間盤突出癥患者,這些患者由于久坐或長期彎腰負重導致腰部勞損和退變,突出之腰椎間盤壓迫坐骨神經,引起下肢疼痛,疼痛程度屬中等。
綜上所述,本研究結果不僅對闡明LDHS的中樞機制、了解EM在病理狀態下的作用具有重要的理論意義,而且對開發新一代鎮痛藥、造福LDHS患者均具有重要的理論意義。本研究的局限性:(1)在LDHS大鼠模型未觀察EM2所起鎮痛作用的具體阿片機制,需進一步利用各種阿片受體拮抗劑分析EM2作用于哪種阿片受體起到鎮痛機制;(2)未探索EM2所起鎮痛作用的具體胞內分子機制,需進一步利用分子生物學及神經電生理膜片鉗技術分析EM2作用于阿片類受體后產生的細胞內分子機制。

