微生物-活性氧化鎂固化紅黏土試驗研究
吳 尚 彬,賈 蒼 琴,王 貴 和
(1.中國地質大學(北京) 工程技術學院,北京 100083; 2.中國地質大學(北京) 自然資源部深部地質鉆探技術重點實驗室,北京 100083)
0 引 言
紅黏土是一種由石灰巖、白云巖等碳酸鹽類巖石在濕熱氣候條件下風化而成的高塑性黏性土,通常呈褐色或棕紅色。紅黏土具有高含水量、高液塑限、高孔隙比等不良物理性質與脹縮性,導致其通常不能直接滿足工程建設的需要,因此許多學者致力于研究紅黏土的改良方法。為提高紅黏土強度,控制紅黏土的脹縮性,研究人員使用了水泥[1]、石灰[2]、粉煤灰[3]等傳統材料固化土體。大量試驗證明,這些添加劑可以提高紅黏土的無側限抗壓強度以及抗剪強度。但這類傳統添加劑大多生產能耗高,CO2排放量大,有些還具有生物毒性,環境污染大,因此探索新型土體加固方法勢在必行。
微生物固化技術作為一種新型土體加固技術,近年來其研究成果頗豐。該技術的原理是:微生物通過新陳代謝作用,誘導生成新物質,新物質膠連土體顆粒,封堵土體孔隙,土體力學性能因此而改變。微生物固化技術在土體加固[4-7]、防滲封堵[8-10]、控制砂土液化[11-12]等方面都已得到成功應用。可以看出,微生物固化技術在砂土中應用較多,在黏性土中也有少量應用。例如,談葉飛等[13]將微生物固化技術應用于黏性土堤壩的防滲工程中,成功將滲透系數降低兩個數量級,下降幅度為99.3%。
活性氧化鎂固化技術是一種新型土體加固技術。趙涵洋等[14]證明了活性氧化鎂可以有效提高紅黏土抗剪強度;劉松玉等[15]使用活性氧化鎂成功實現了粉土以及粉質黏土的固化,但他們發現,固化過程中需要通入一定濃度和壓力的CO2,這在實際工程中難以控制,對固化效果會產生影響。
微生物通過分解尿素所產生的碳酸根離子,可以代替活性氧化鎂固化過程中所需的CO2,并且反應過程容易控制。但是,當前尚未有研究將微生物固化技術與活性氧化鎂固化技術相結合來處理紅黏土,鑒于此,本文結合微生物固化技術與活性氧化鎂固化技術,重點探究氧化鎂含量、菌液濃度、初始含水率對紅黏土無側限抗壓強度的影響,以及該技術對紅黏土收縮性的控制作用。并通過掃描電鏡試驗(SEM)和X射線衍射分析(XRD),對試驗結果進行了分析。
1 試驗方法
1.1 試樣材料
試驗所用紅黏土取自福建省南平市,呈磚紅色。將足量紅黏土碾碎后過2 mm篩,并置于105 ℃烘干箱中烘干至恒重,取出后冷卻至室溫備用。土樣基本物理性質指標如表1所列。試驗采用日本協和150活性氧化鎂,其碘吸附值為120 mg/g,置于干燥環境中密封保存,其主要化學成分及主要參數如表2所列。試驗所用尿素購于國藥集團化學試劑有限公司。

表1 紅黏土基本物理性質指標Tab.1 Basic physical properties of red clay

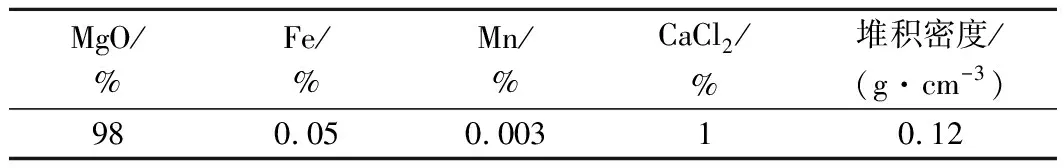
表2 活性MgO主要化學成分及堆積密度Tab.2 The main chemical components and packing density of active MgO
1.2 試驗方案
本次試驗采用控制變量法,設置素紅黏土為對照組,探究氧化鎂含量、菌液濃度、初始含水率對微生物-活性氧化鎂固化紅黏土試樣無側限抗壓強度的影響,以及微生物-活性氧化鎂固化技術對紅黏土收縮性的控制作用。
紅黏土無側限抗壓試驗的試驗方案如表3所列,紅黏土收縮性試驗試樣制備時,取氧化鎂含量20 %,菌液濃度OD600=2.0,含水量40 %,尿素含量6 mol/L。
1.3 試樣制備
根據試驗方案稱取所需材料,將氧化鎂、紅黏土及尿素倒入攪拌器充分攪拌后,再將菌液倒入攪拌器,充分攪拌120 s。
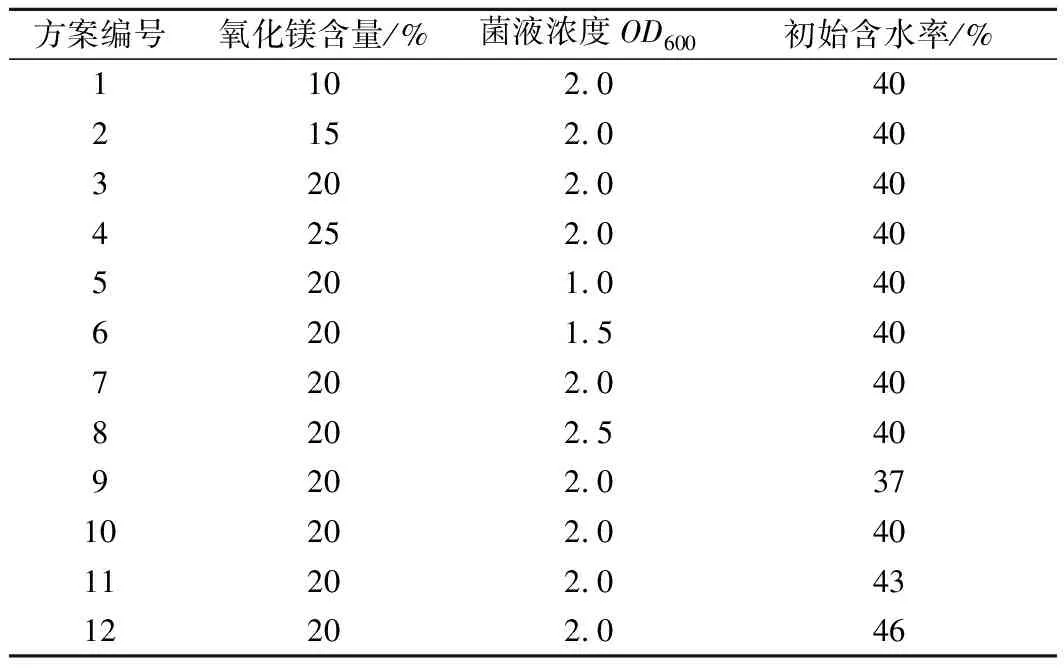
表3 試驗方案Tab.3 Test schemes
制備無側限抗壓試驗試樣時,需采用振動密實法制備3個平行試樣。振動密實法制樣采用邊長為5 cm的正方體模具,將攪拌均勻后的土樣分3層倒入模具中。裝下一層土前,將模具置于振動臺中振動30 s,頂層使用刮土刀刮平。試樣制備完成后置于溫度為(25±2)℃、濕度為30 %的環境里養護1 d。脫模后,再置于相同環境中養護至特定齡期。
制備收縮變形試驗試樣時,準備一塊攪拌均勻的土樣,用環刀切取土樣后,備用。
1.4 測試方法
無側限抗壓強度采用全數字化萬能材料實驗機測試,以1 mm/min的加荷速率給試樣施加軸向壓力,直至軸向壓力達到峰值,記錄無側限抗壓強度。根據無側限抗壓強度試驗結果,選取代表性土樣進行X 射線衍射分析(XRD)和掃描電鏡試驗(SEM)。收縮變形試驗中,用環刀切取土樣后,將試樣放置于多孔板上,于試樣上放置百分表,記錄下百分表初讀數,2 d內每4 h量測一次數據,2 d后每12 h量測一次數據,至兩次百分表讀數基本穩定為止。X射線衍射分析采用日本理學Rigaku Ultima IV型衍射儀對碾碎過篩后小于0.075 mm的固化土進行測試,掃描范圍為10°~90°,步寬為0.02°。掃描電鏡試驗采用日本日立公司生產的Hitachi SU8010掃描電鏡對土樣的新鮮斷面進行掃描測試。
2 試驗原理與結果分析
2.1 試驗原理
將活性氧化鎂、尿素、菌液以及紅黏土充分拌和后,紅黏土中會發生如下反應:首先,活性氧化鎂與水反應,生成水鎂石(Mg(OH)2);同時,細菌分泌高活性脲酶,將尿素分解為銨根離子和碳酸根離子;最后產生的碳酸根離子與活性氧化鎂水化后產生的鎂離子反應生成多種形式的水合碳酸鎂,反應方程式如下[16]:
MgO+H2O→Mg2++OH-
(1)
(2)
(3)
(4)
(5)
(6)
(7)
第一步反應生成的Mg(OH)2膠結性能較差,對紅黏土的固化效果不理想[17]。隨著反應的進行,生成的水合碳酸鎂具有良好的膠結性,可以將紅黏土顆粒膠結,通過土顆粒-膠結物-土顆粒間的鍵合作用連接成固化整體[18]。水合碳酸鎂還具有封堵紅黏土孔隙的作用,土體的微觀結構會因此變得更加致密,土的整體性和結構性也會得到增強[15]。水合碳酸鎂對紅黏土顆粒的膠結作用以及充填作用有效促進了紅黏土試樣無側限抗壓強度的提升。
2.2 氧化鎂含量的影響
由圖1可知:當氧化鎂含量c在10%~25%之間變化時,紅黏土試樣無側限抗壓強度與氧化鎂含量呈正相關;并且當氧化鎂含量低于10%時,強度變化不明顯,而當含量超過10%后,紅黏土強度增強顯著。
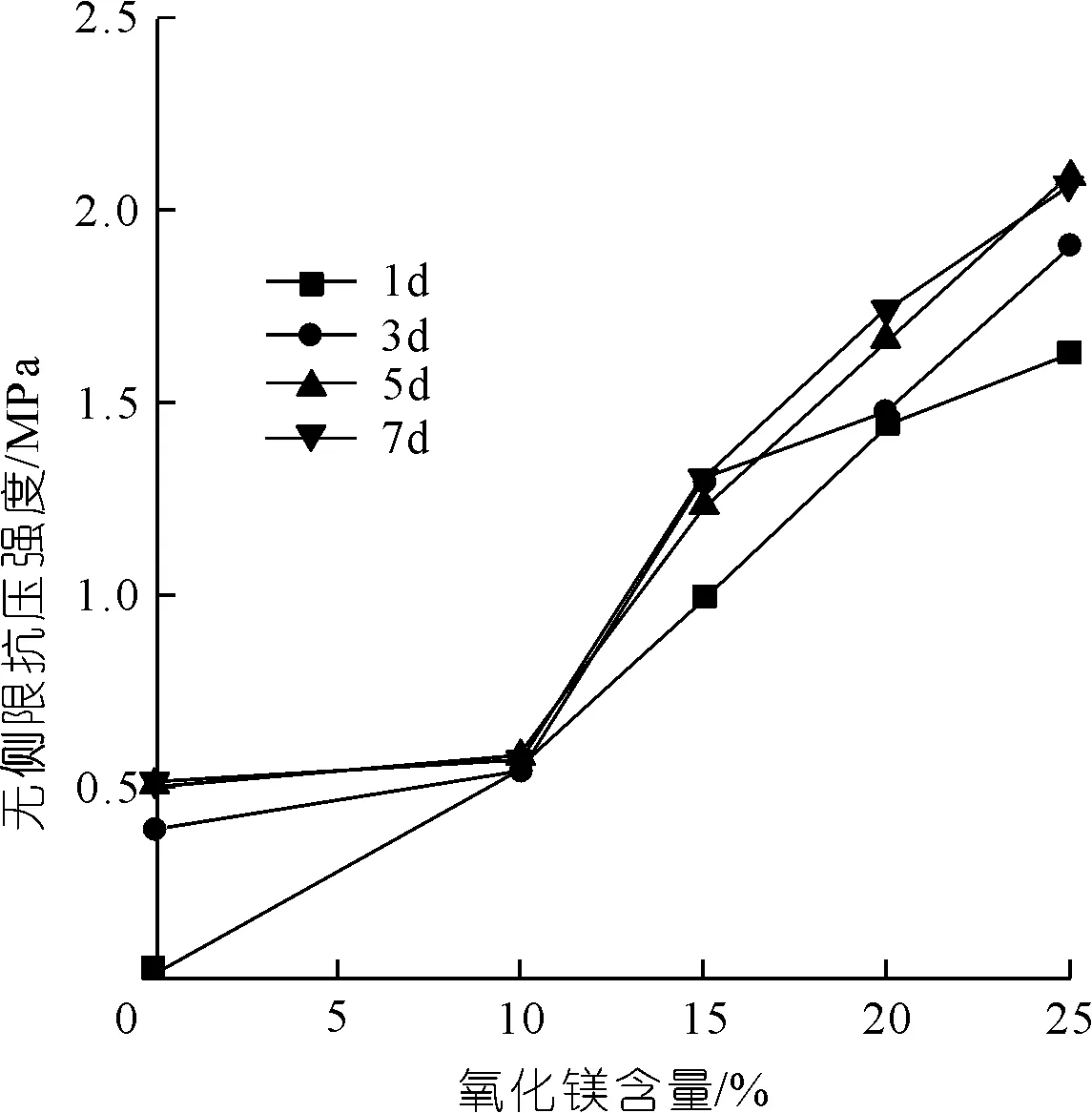
圖1 氧化鎂含量與無側限抗壓強度關系Fig.1 Relationship between magnesium oxide content and unconfined compressive strength
從圖2中可以看到:與素土試樣相比,微生物-活性氧化鎂固化技術的運用使得土顆粒間產生了膠結物質,膠結物質將紅黏土顆粒膠連,形成更大的土顆粒,同時可以觀察到膠結物質充填在紅黏土孔隙中,這是試樣無側限抗壓強度提高的原因。從圖2中也可以看出:氧化鎂含量為10 %時,膠結物產量較低;當氧化鎂含量為25 %時,膠結物產量較高,即隨著氧化鎂含量的升高,膠結物產量明顯提升。氧化鎂含量也影響著膠結物質的結構形貌;當氧化鎂含量為10 %時,膠結物呈絮流狀,而當氧化鎂含量為25 %時,膠結物呈花瓣狀。
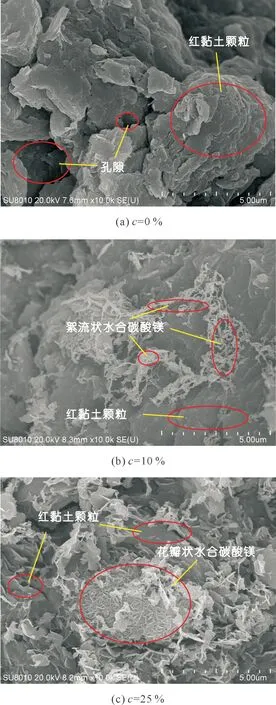
圖2 不同氧化鎂含量固化試樣SEM圖像Fig.2 SEM images of cured samples with different magnesia content
拌入不同氧化鎂含量的紅黏土試樣養護120 h后,取少量樣品進行XRD分析,結果如圖3所示。從圖3中可以看出:不同含量氧化鎂固化的紅黏土試樣中均有水合碳酸鎂生成,同時在固化試樣中還檢測到未水化的氧化鎂以及水化后未進一步反應的水鎂石。這說明初始含水率為40%時,氧化鎂并沒有全部水化,水化的氧化鎂與微生物分解尿素產生的碳酸根離子發生化學反應,生成多種水合碳酸鎂。不同氧化鎂含量的固化紅黏土試樣中,固化產物的種類大體相同,包括三水菱鎂石、水纖菱鎂石、球碳鎂石等。
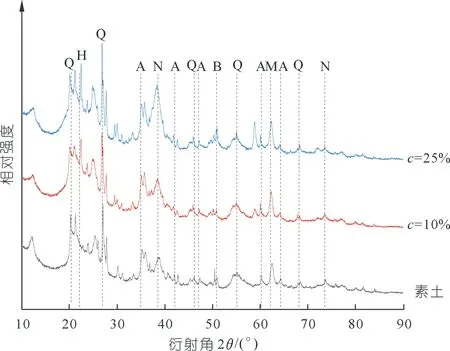
注:Q為石英 SiO2;B為水鎂石 Mg(OH)2;M為氧化鎂MgO;A為水纖菱鎂石Mg2(CO3)(OH)2·3H2O;N為三水菱鎂石MgCO3·3H2O;H為球碳鎂石Mg5(CO3)4(OH)2·4H2O。圖3 不同氧化鎂含量固化試樣XRD結果Fig.3 XRD results of cured samples with different magnesia content
2.3 菌液濃度的影響
由圖4可知:當OD600在0~2.5的范圍內變化時,菌液濃度越高,紅黏土試樣無側限抗壓強度越大。試塊養護7 d后,OD600=2.5的固化試樣其無側限抗壓強度為1.916 MPa,分別為OD600=2.0,1.5,1.0,0菌液固化試樣的1.12,1.45,1.68,3.76倍。試驗結果表明,可以通過提升菌液濃度顯著提高紅黏土試樣無側限抗壓強度。
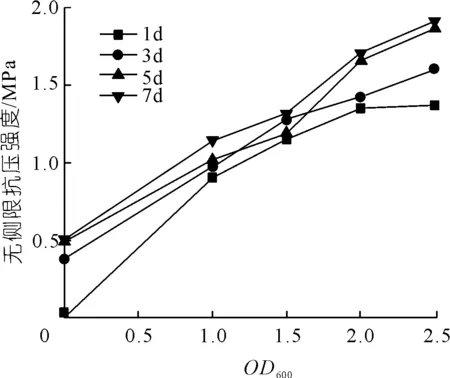
圖4 菌液濃度與無側限抗壓強度關系Fig.4 Relationship between the concentration of bacterial solution and unconfined compressive strength
圖5(b)中水合碳酸鎂含量高于圖5(a),說明菌液濃度還影響著水合碳酸鎂的結構形貌,當OD600=1.0時,水合碳酸鎂呈針柱狀,而當OD600=2.5時,水合碳酸鎂為針柱狀與花簇狀并存。在菌液含量相同的情況下,菌液濃度越高,脲酶產量越高。脲酶具有催化水解尿素的功能,因此脲酶產量越高,分解產生的碳酸根離子含量隨之增加,進而能夠提高水合碳酸鎂產量。水合碳酸鎂具有膠連土體顆粒和填充土體孔隙的功能,因此菌液濃度越高的紅黏土固化試樣具有更高的無側限抗壓強度。此外,細菌還具有充當成核位點的功能,水合碳酸鎂會圍繞細菌生成。菌液濃度越高,成核位點數越多,水合碳酸鎂分布密度越大,試樣無側限抗壓強度越高。

圖5 不同菌液濃度固化試樣SEM圖像Fig.5 SEM images of solidified samples with different bacterial concentration
2.4 初始含水率的影響
從圖6中可以看出:微生物-活性氧化鎂固化紅黏土試樣的無側限抗壓強度隨初始含水率(37%~46%)的上升而降低。
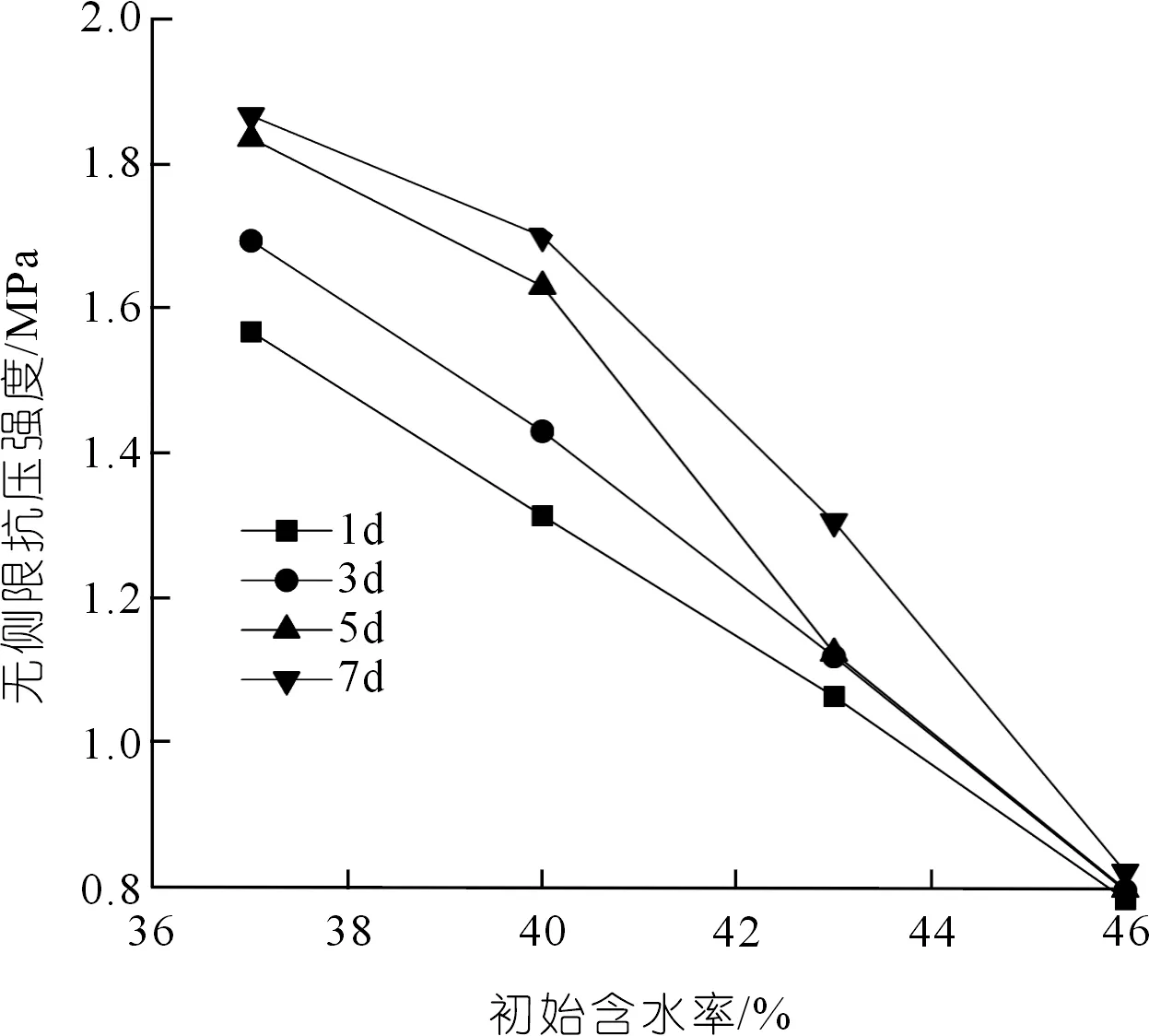
圖6 初始含水率與無側限抗壓強度關系Fig.6 Relationship between initial water content and unconfined compressive strength
黏土顆粒相互聯結的原因是顆粒之間存在分子引力及靜電力,靜電力的存在使得顆粒之間常常通過結合水膜相聯結,這導致了黏土具有可塑性[19]。初始含水率的增加會導致紅黏土顆粒周圍的水膜加厚,從而導致土體可塑性增強,進而導致土樣無側限抗壓強度降低。
當初始含水率低于塑限,則難以通過振動密實法制樣。因此,在本次試驗中,固化紅黏土試樣的初始含水率均高于塑限。若初始含水率低于塑限,將導致活性氧化鎂無法完全水化,Mg2+的減少將影響后續水合碳酸鎂的生成,進而引起紅黏土試塊無側限抗壓強度的降低。
2.5 對收縮性的影響
在工程中,由紅黏土的脹縮性導致的土體開裂問題層出不窮。紅黏土以收縮變形為主[20],因此本節重點討論微生物-活性氧化鎂固化技術對紅黏土收縮性的影響。
本文以線縮率為指標反映紅黏土收縮性,線縮率的定義為
(8)
式中:zt為某時刻百分表讀數,z0為初始時刻百分表讀數,h0為試樣原始高度,δSi為某時刻線縮率。
土樣線縮率隨時間變化曲線如圖7所示,在144 h的測試時間內,微生物-活性氧化鎂固化試樣的線縮率僅為素土樣品的1/7左右。此外,微生物-活性氧化鎂固化試樣固化速度快,20 h即停止收縮變形,而素土的收縮變形停止時間為120 h。
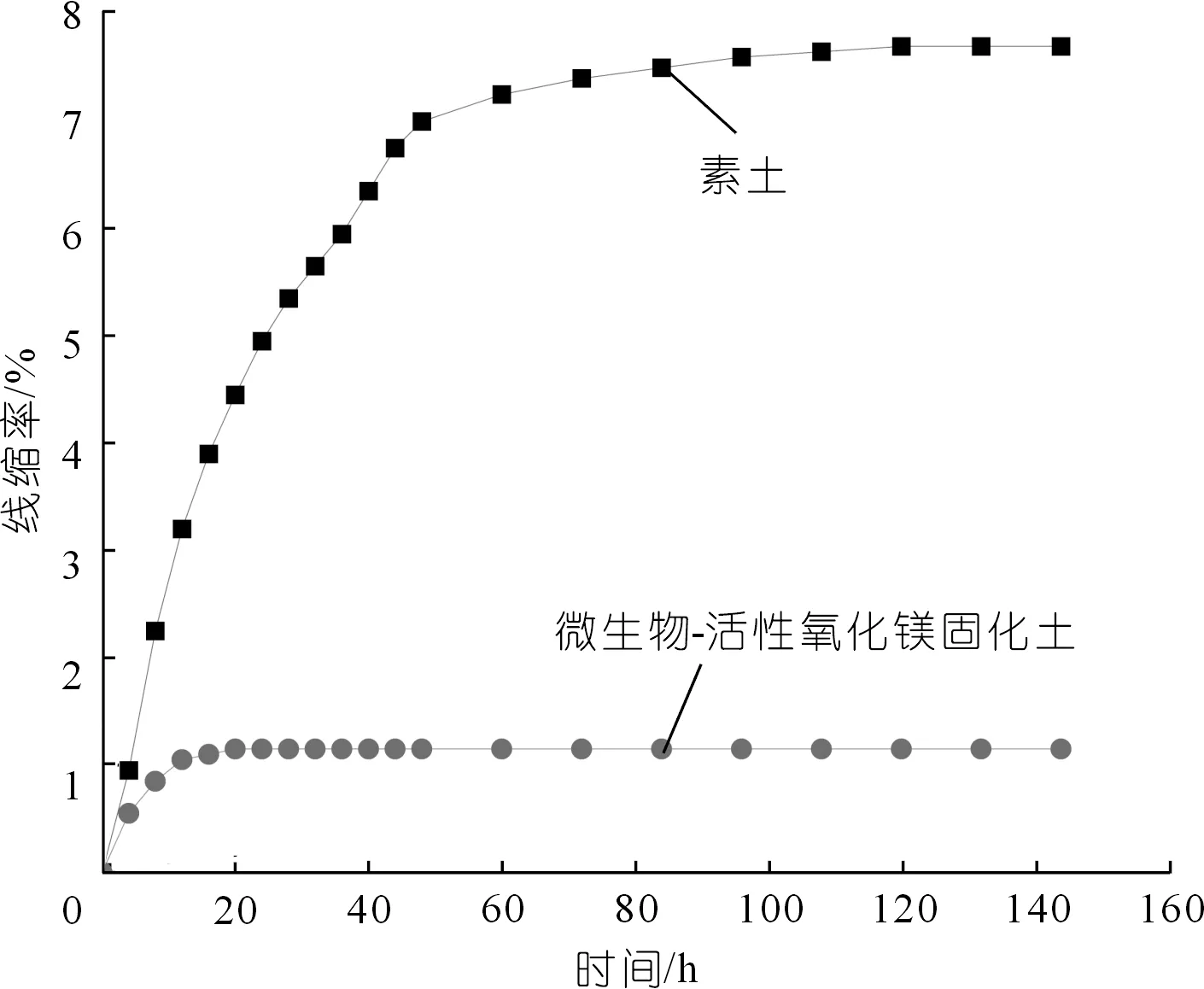
圖7 土樣線縮率與時間關系Fig.7 Relationship between line shrinkage rate of soil sample and time
3 結 論
本文采用微生物-活性氧化鎂固化技術處理紅黏土試樣,探究氧化鎂含量、菌液濃度、初始含水率對紅黏土無側限抗壓強度的影響,并通過掃描電鏡試驗及X射線衍射分析對試驗結果做出合理的解釋,同時也探究了該技術對紅黏土收縮性的影響,得出以下結論。
(1) 當氧化鎂含量在10%~25%之間變化時,紅黏土試樣無側限抗壓強度與氧化鎂含量正相關。水合碳酸鎂的形成是無側限抗壓強度提高的原因,水合碳酸鎂可以膠連紅黏土顆粒,提升其整體性,同時也可以充填紅黏土孔隙,增加紅黏土試樣的密實度。氧化鎂含量的變化影響著水合碳酸鎂的結構形貌,當氧化鎂含量為10 %時,水合碳酸鎂呈絮流狀;當氧化鎂含量為25 %時,水合碳酸鎂呈花瓣狀。
(2) 紅黏土試樣的無側限抗壓強度隨菌液濃度的升高而升高,菌液濃度影響著水合碳酸鎂的結構形貌,當OD600=1.0時,水合碳酸鎂呈針柱狀,而當OD600=2.5時,水合碳酸鎂為針柱狀與花簇狀并存。
(3) 當初始含水率在37%~46%之間變化時,初始含水率越高,紅黏土試樣的無側限抗壓強度越低。
(4) 微生物-活性氧化鎂固化技術可以有效控制紅黏土收縮性,在144 h的測試時間內,微生物-活性氧化鎂固化土的線縮率僅為素土樣品的1/7左右,并且微生物-活性氧化鎂固化技術具有很快的固化速度。

