雷帕霉素聯合2-DG對多發性骨髓瘤細胞增殖和凋亡的影響
謝 琨,申紅遠,鄭焱華,李婷婷,魏香蘭 西安市胸科醫院 藥物臨床試驗機構,陜西西安 7000; 空軍軍醫大學西京醫院 血液科,陜西西安7003
多發性骨髓瘤 (multiple myeloma,MM)是骨髓中漿細胞克隆性增殖所致的血液系統惡性腫瘤,是血液系統中僅次于非霍奇金淋巴瘤的第二常見的惡性腫瘤[1]。隨著免疫調節劑(來那度胺、泊馬度胺等)、蛋白酶體抑制劑(硼替佐米、卡非佐米、伊沙佐米等)、抗CD38單克隆抗體、自體造血干細胞移植和嵌合抗原受體T細胞等在內的新治療手段的應用,MM患者的治療效果已經得到極大的改善。迄今為止,MM仍然是無法治愈的疾病,幾乎所有MM患者最終都將演變為復發難治疾病狀態[2],這表明迫切需要新的治療策略改善患者預后[3]。葡萄糖代謝異常是癌細胞的標志[4-5]。即使在氧氣充足的條件下,癌癥細胞仍主要通過糖酵解,而不是通過更有效率的線粒體氧化磷酸化利用葡萄糖,這種現象被稱為Warburg效應[6]。因此癌細胞對糖酵解的偏好使靶向腫瘤細胞糖酵解途徑的干預手段有希望成為抗腫瘤的方向[7-8]。
哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)由兩種功能不同的多蛋白復合物組成——mTOR復合物1(mTORC1)和mTOR復合物2(mTORC2)。mTORC1是磷脂酰肌醇3激酶(PI3K)-Akt信號通路的關鍵下游效應子,可調節和促進MM細胞生長增殖,應對化療毒性使腫瘤細胞產生耐藥。mTOR也可通過調節細胞葡萄糖代謝來影響細胞的生理活動[9],這提示我們mTORC1抑制劑(如雷帕霉素)具有潛在抗MM作用[10]。單用mTORC1抑制劑的抗腫瘤作用有限,因為PI3K/AKT/mTOR通路中存在反饋激活機制,即mTORC1受到抑制時,ATK會活化,重新激活mTORC1信號,導致靶向mTORC1的藥物療效降低甚至出現耐藥[11]。2-脫氧-D-葡萄糖(2-DG)是葡萄糖的類似物,是使用最廣泛的糖酵解抑制劑之一。單獨應用2-DG阻斷糖酵解對包括MM在內多種惡性腫瘤并沒有產生明顯的抗腫瘤效應,原因是腫瘤細胞可通過磷酸戊糖途徑繞過2-DG的阻斷作用繼續為無氧糖酵解提供底物。這一過程中mTORC1發揮了重要作用,也反映了腫瘤細胞的代謝可塑性[12]。我們提出假設,mTOR在調節腫瘤細胞糖代謝過程中可能起作用,當mTORC1和糖酵解均被抑制時,兩者在作用機制上存在互補,可能會產生協同的抗骨髓瘤作用。我們研究發現mTORC1抑制劑雷帕霉素和糖酵解抑制劑2-DG聯用具有協同的抗腫瘤作用,使細胞周期阻滯、凋亡率增加。
材料與方法
1 細胞株 人多發性骨髓瘤細胞株 RPMI8226購自武漢普諾賽公司,RPMI8226腫瘤細胞采用RPMI1640 培養液,10%(V/V)FBS,100 U/mL 青霉素,100 mg/L鏈霉素,37℃、5% CO2飽和濕度下培養。
2 主要試劑和儀器 Rapa 購于 Sigma 公司 (編號V900930,分子量914.17,純度≥95%),2-DG(編號I0697,分子量639.71,純度>99.0%)購于中國上海TCI公司,CCK-8購于中國上海尚寶公司(貨號ST1008),PI/RNase染色緩沖液(貨號550825)和 Annexin V/碘化丙啶 (PI)檢測試劑盒(貨號556547)購于美國BD-PharminginTM公司(貨號 ST1008),抗 Bcl-2(貨號 ab32124)、抗 P53(貨號 ab26)、抗 Bax(貨號 ab32503)、抗 CyclinD1(貨號ab16663)、抗GAPDH(貨號ab8245)抗體購于Abcam公司,CO2恒溫培養箱(美國Thermo Scientific),超凈工作臺(天津泰斯特公司),酶標儀(南京德鐵設備儀器公司),倒置相差顯微鏡(德國Zeiss公司),蛋白電泳儀(美國Bio-Rad公司),Omega Lum化學發光凝膠成像系統(美國Aplegen公司),四色流式細胞儀(美國Beckman公司)。
3 細胞毒性試驗 將 RPMI8226 細胞按 2 × 104/孔的密度接種于96孔板,每孔200 μL,分為單藥 Rapa 組 (10 nmol/L、 20 nmol/L、 50 nmol/L、80 nmol/L、100 nmol/L、150 nmol/L、200 nmol/L)、2-DG 組 (0.2 mmol/L、0.5 mmol/L、0.8 mmol/L、1 mmol/L、2 mmol/L、5 mmol/L)及兩藥聯合作用組,合用組中Rapa(nmol/L)和2-DG(mmol/L)的工作濃度組合為20+0.2、50+0.5、80+0.8、100+1,固定Rapa和2-DG濃度比例為100∶1。對照組加入用RPMI1640培養液稀釋的DMSO,DMSO終濃度與單藥處理組相同。空白組只加入200 μL RPMI1640培養液。每組設置3個復孔,置于細胞孵箱中孵育。48 h后各個處理組每孔均加入20 μL CCK-8工作液,37℃細胞孵箱孵育2 h,酶標儀450 nm測定每孔吸光度值,并計算單藥及聯用組的抑制率,抑制率=[(對照孔-實驗孔)/(對照孔-空白孔)] × 100%。
4 細胞周期分析 根據兩藥合用的最低合用指數 (combination index,CI)(協同作用最佳),我們選取單藥 Rapa(50 nmol/L)、2-DG(0.5 mmol/L)及兩藥聯用 (0.5 mmol/L 2-DG + 50 nmol/L Rapa)作為后續實驗的作用濃度。處理48 h后,離心(1 000 r/min)去上清,1.5 mL PBS 重懸并洗滌細胞兩遍,逐滴加入1 mL預冷的75%乙醇,4℃固定過夜,離心 (1 000 r/min)棄乙醇,1 mL PBS 洗滌一遍,加入 500 μL PI/RNase 染色緩沖液,混勻后避光孵育20 min,上機檢測。
5 細胞凋亡檢測 MM 細胞經 Rapa(50 nmol/L)、2-DG (0.5 mmol/L)或聯合處理 48 h 后,收集各組細胞,細胞離心 (1 000 r/min)去上清,1.5 mL PBS 重懸并洗滌細胞兩遍,加入 500 μL 的 1 × 結合緩沖液重懸細胞,加入 Annexin V/FITC 5 μL,再加入 PI 15 μL,室溫黑暗中孵育 15 min,使用流式細胞儀進行檢測。Annexin V/FITC1陽性和PI陰性的細胞被認為是早期凋亡細胞,Annexin V/FITC1和PI陽性則被認為與晚期凋亡或壞死有關。6 Western blot檢測蛋白表達 各組細胞用 RIPA裂解液在冰上裂解30 min,提取細胞總蛋白,BCA蛋白定量法測各組蛋白濃度,用裂解液稀釋各組蛋白至相同濃度,與2×上樣緩沖液1∶1混合,每組取30 μg 蛋白,經12% SDS-PAGE電泳(壓縮膠 80 V,分離膠 120 V),轉移到PVDF膜上 (濕轉法,恒流 220 mA,35 min)。5% 的脫脂奶粉室溫封閉 1 h后,加入P53、Bcl-2、Bax、CyclinD1、GAPDH一抗(除GAPDH稀釋比例為1∶10 000,其他一抗稀釋比例均為 1∶1 000),4℃孵育過夜,洗膜后加入對應種屬辣根過氧化物酶結合的二抗(稀釋比例1∶4 000),室溫孵育1 h,增強型化學發光法(Millipore)檢測目的蛋白條帶。
7 計算藥物合用指數 使用 CompuSyn 軟件,按照Chou-Talalay方法計算合用指數。兩種藥物的聯合作用可以總結為CI<1、CI=1、CI>1分別表示協同作用、相加作用、拮抗作用[13]。
8 統計分析方法 GraphPad Prism 8.0 軟件 (San Diego,CA)用于數據處理、分析。使用SPSS22.0統計分析軟件進行單因素方差分析。本研究的每個實驗均進行3次重復,計量資料以±s表示。P<0.05為差異有統計學意義。
結 果
1 2-DG 增強了 Rapa 對 RPMI8226 細胞的毒性單 藥 Rapa(10 nmol/L、 20 nmol/L、 50 nmol/L、80 nmol/L、100 nmol/L、150 nmol/L、200 nmol/L)、單藥 2-DG(0.2 mmol/L、0.5 mmol/L、0.8 mmol/L、1 mmol/L、2 mmol/L、5 mmol/L)以及 Rapa(nmol/L)與2-DG(mmol/L)固定比例合用(20+0.2、50+0.5、80+0.8、100+1)處理48 h后,如圖1A和圖1B所示,與對照組相比,Rapa或2-DG單獨作用均顯著抑制RPMI8226細胞的活力,且呈濃度依賴性。如圖1C所示,當RPMI8226細胞經Rapa(nmol/L)和2-DG(mmol/L)以恒定比例(100∶1)共同作用時,與Rapa或2-DG單獨作用相比,Rapa和2-DG聯合作用對多發性骨髓瘤細胞株的生長有更強的抑制作用(P<0.05)。
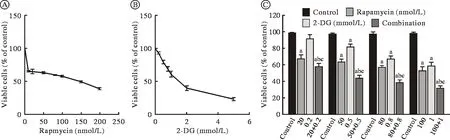
圖1 Rapa和2-DG處理48 h對人多發性骨髓瘤細胞RPMI8226增殖的影響(aP<0.05, vs對照組;bP<0.05, vs雷帕霉素單藥組;cP<0.05, vs 2-DG單藥組)Fig.1 Effect of rapamycin and 2-DG on the growth in RPMI8226 cells after 48 h treatment (aP<0.05, vs control group; bP<0.05, vs Rapamycin alone group; cP<0.05, vs 2-DG alone group)
2 CompuSyn 軟件分析計算不同濃度 Rapa與 2-DG合用對RPMI8226細胞的CI值 利用CompuSyn軟件分析計算Rapa與2-DG合用的CI值及相關合用指標,繪制不同濃度Rapa和2-DG作用于RPMI8226細胞的Fa-CI圖,圖2和表1顯示了本研究中所用兩藥組合的協同效應結果,四個組合中 50 nmol/L Rapa + 0.5 mmol/L 2-DG 的 CI 值最小,協同效應最強。
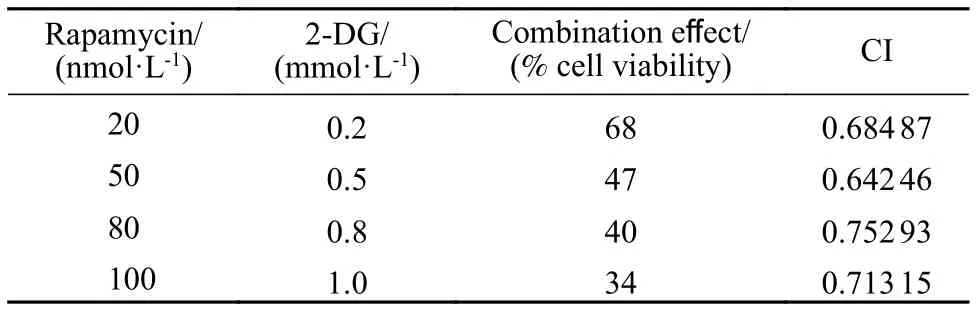
表1 雷帕霉素和2-DG的合用指數Tab.1 Combination index for combination of Rapamycin and 2-DG
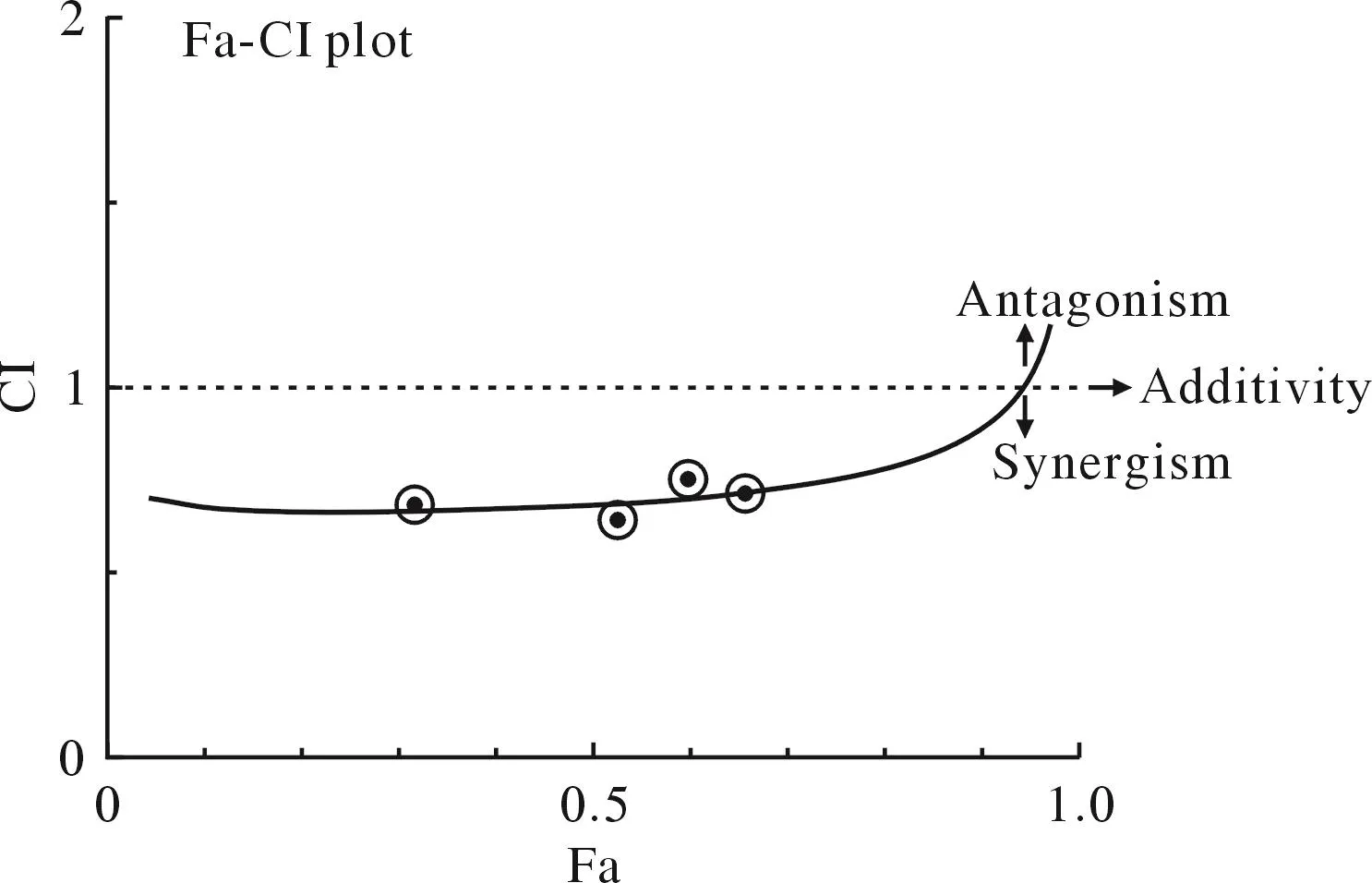
圖2 CompuSyn軟件合成雷帕霉素和2-DG合用的Fa-CI圖,每一個圓形的點表示一個藥物組合具體的合用指數值Fig.2 Fa–CI plots were calculated based on the Chou –Talalay equation using CompuSyn software version 1.0.Each round symbol designated the CI (combination index) values for each Fa (fraction affected) at four different dose points lines
3 Rapa 聯合 2-DG 對 RPMI8226 細胞周期的影響圖3A和圖3B所示,Rapa(50 nmol/L)或2-DG(0.5 mmol/L)單藥作用 48 h 降低了 RPMI8226 細胞S期的比例,細胞周期阻滯在G0/G1期,與Rapa單獨作用相比,Rapa(50 nmol/L)聯合2-DG(0.5 mmol/L)作用48 h明顯增強了這一趨勢。Rapa與2-DG合用進一步降低了RPMI8226細胞DNA合成期(S期)的比例,使細胞周期明顯阻滯在G0/G1 期 (P<0.05)。
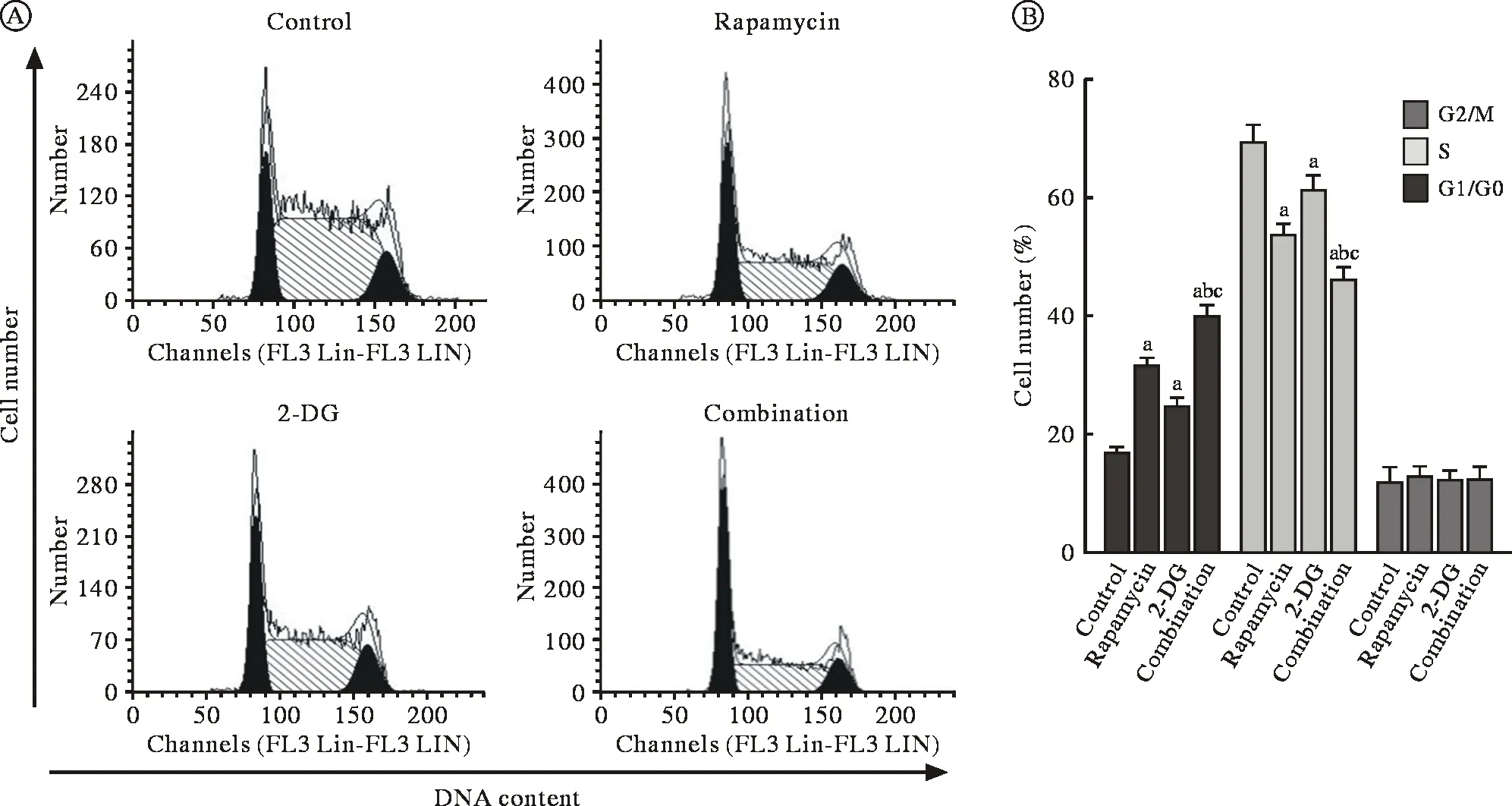
圖3 Rapa和2-DG對人多發性骨髓瘤細胞RPMI8226周期的影響(aP<0.05, vs對照組;bP<0.05, vs雷帕霉素單藥組;cP<0.05, vs 2-DG單藥組)Fig.3 Effect of rapamycin and 2-DG on cell distribution in RPMI8226 cells (aP<0.05, vs control group; bP<0.05, vs Rapamycin alone group;cP<0.05, vs 2-DG alone group)
4 Rapa 聯合 2-DG 對 RPMI8226 細胞凋亡的影響圖4A和圖4B所示,單藥Rapa(50 nmol/L)作用于RPMI8226 48 h后,引起細胞輕度凋亡(約10%凋亡率),而 2-DG (0.5 mmol/L)在 48 h 后未能誘導MM 細胞凋亡。Rapa(50 nmol/L)聯合2-DG(0.5 mmol/L)作用 48 h 后,RPMI8226 的細胞凋亡率(約20%)顯著高于Rapa單藥組(P<0.05)。
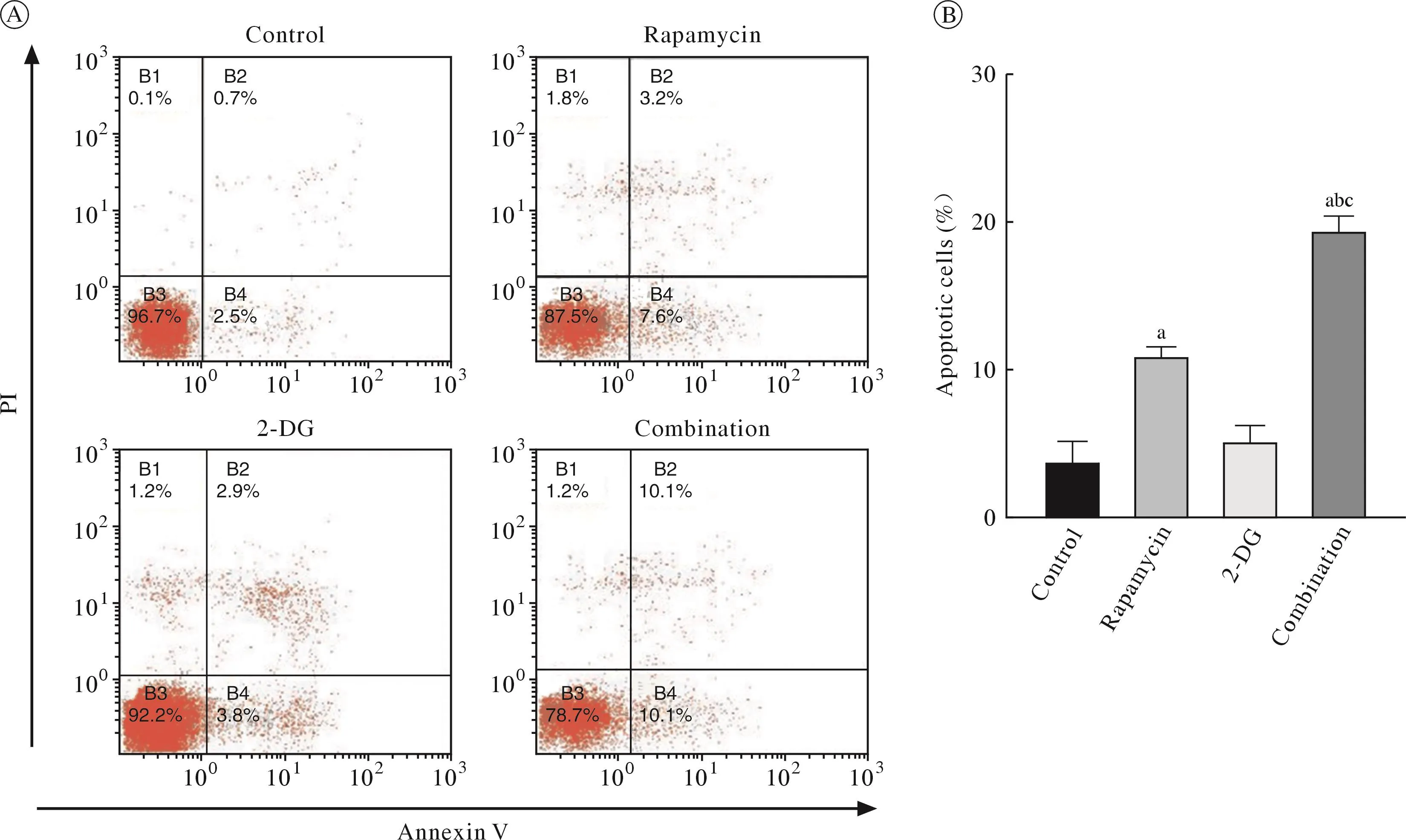
圖4 Rapa和2-DG對人多發性骨髓瘤細胞RPMI8226凋亡的影響(aP<0.05, vs對照組;bP<0.05, vs雷帕霉素單藥組;cP<0.05, vs 2-DG單藥組)Fig.4 Effect of rapamycin and 2-DG on apoptosis in RPMI8226 cells (aP<0.05, vs control group; bP<0.05, vs Rapamycin alone group;cP<0.05, vs 2-DG alone group)
5 Rapa 聯合 2-DG 使 RPMI8226 細胞周期調控蛋白CyclinD1表達降低,促凋亡蛋白Bax和P53表達增加,凋亡抑制蛋白Bcl-2表達降低 Westernblot結果顯示 Rapa(50 nmol/L)和 2-DG(0.5 mmol/L)單藥作用48 h,細胞周期調控蛋白CyclinD1表達水平較對照組降低,Rapa(50 nmol/L)和2-DG(0.5 mmol/L)合用 48 h,CyclinD1 的表達水平進一步降低。Rapa(50 nmol/L)和 2-DG(0.5 mmol/L)單藥作用48 h增加Bax和P53的表達,降低Bcl-2的表達,與對照組和單藥組比較,合用組進一步增加Bax和P53的表達,Bcl-2的表達更低(P<0.05),見圖5。在蛋白水平顯示出合用Rapa和2-DG對RPMI8226細胞具有明確的周期阻滯和增強凋亡的藥理學作用。
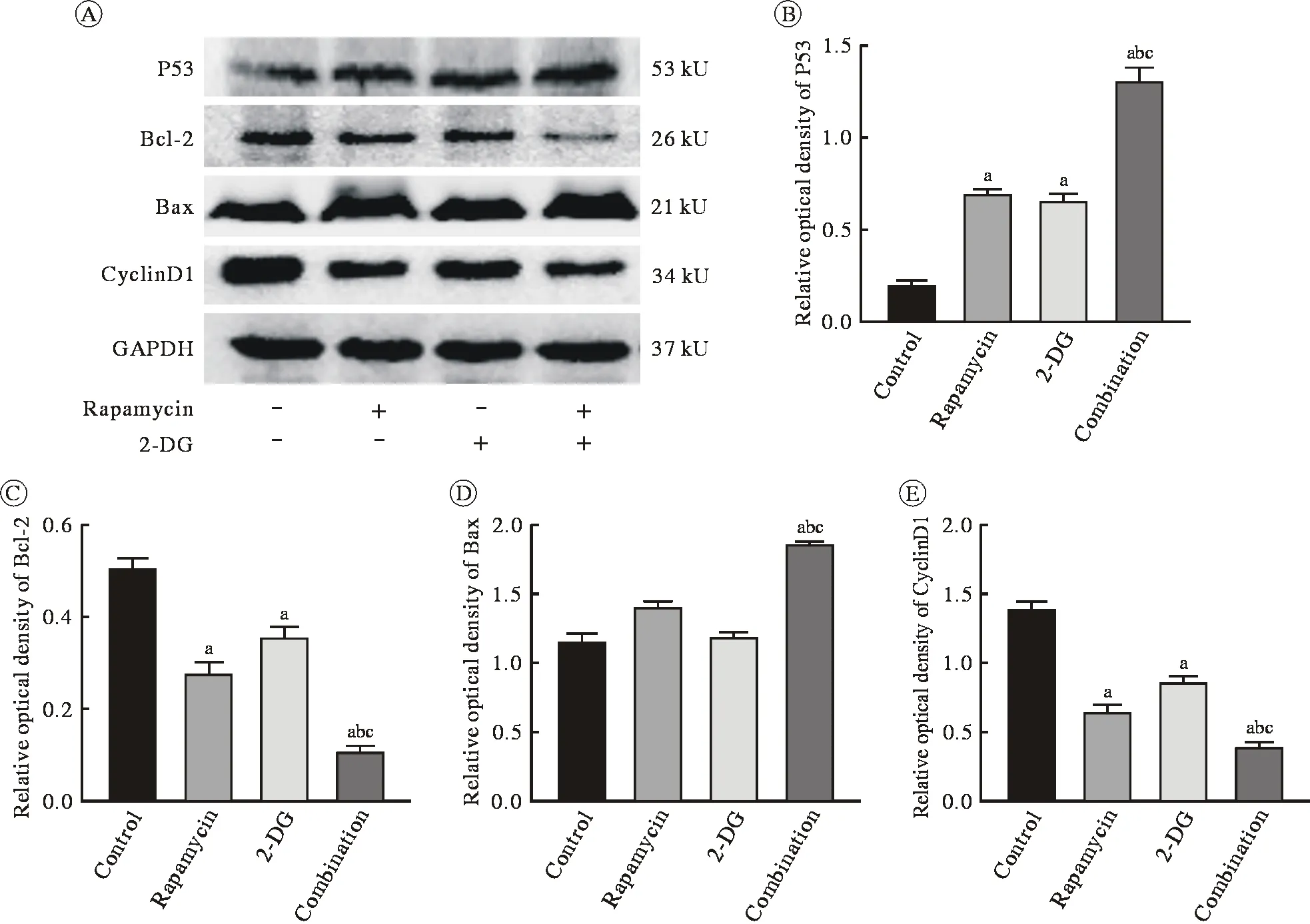
圖5 Rapa和2-DG對人多發性骨髓瘤細胞RPMI8226周期和凋亡相關蛋白表達的影響(aP<0.05, vs對照組;bP<0.05, vs雷帕霉素單藥組;cP<0.05, vs 2-DG單藥組)Fig.5 Effect of rapamycin and 2-DG on cell cycle and apoptosis related protein in RPMI8226 cells (aP<0.05, vs control group; bP<0.05, vs Rapamycin alone group; cP<0.05, vs 2-DG alone group)
討 論
代謝重編程是癌細胞的特征,表現出對有氧糖酵解的依賴。癌細胞有氧糖酵解的特征是葡萄糖消耗的增加和乳酸生成速率的提高,這一現象最早由Warburg在20世紀20年代描述,此后被稱為Warburg效應[4]。在腫瘤研究中,葡萄糖代謝是腫瘤代謝研究最多的一個分支。mTOR是一種絲氨酸/蘇氨酸蛋白激酶,用于調節蛋白質合成和細胞生長[14-15]。PI3K/AKT/mTOR通路參與腫瘤細胞代謝的調節,其中mTOR是Warburg效應的中心調控因子,也可以作為癌基因和腫瘤抑制基因的下游效應分子[7]。靶向mTOR通路的化合物在癌癥治療方面具有一定的應用潛力[16]。然而單用mTORC1抑制劑時,腫瘤細胞中PI3K/AKT/mTOR信號通路中從mTOR到AKT存在一個反饋機制,mTORC1被抑制能導致ATK活化,AKT活化導致該信號通路對mTOR抑制劑的抵抗和耐藥。在骨髓瘤細胞中,mTORC1抑制劑Rapamycin抑制mTOR信號通路,會導致AKT的磷酸化水平升高并激活,同時抑制AKT和mTORC1才能產生協同的抗骨髓瘤作用[11]。抑制糖酵解活性在癌癥治療中一直是有吸引力的研究方向[17],但至今使用糖酵解抑制劑的臨床試驗并沒有取得成功。2-DG單藥治療在人異種移植動物腫瘤模型中無效,與化療方法聯合僅能輕度減慢腫瘤的生長。這是因為2-DG抑制糖酵解的關鍵酶-己糖激酶2(hexokinase 2,HK2)后,腫瘤細胞通過磷酸戊糖旁路途徑繞過HK2催化的下游糖酵解步驟繼續為糖酵解提供代謝底物,而該旁路代謝過程依賴mTORC1[12]。這提示我們mTORC1抑制劑可以協同2-DG,發揮更強的抗腫瘤活性。Zhao等[18]發現mTORC1抑制劑Rapa與糖酵解抑制劑2-DG聯合主要通過糖酵解途徑對肝癌細胞具有協同抗腫瘤作用。Jiang等[19]報道mTOR復合物1/2抑制劑與糖酵解抑制劑對非小細胞肺癌細胞具有協同抑制作用,表現為細胞凋亡增加、葡萄糖攝取降低。張雪燕等[20]證實2-DG通過抑制己糖激酶的活性、抵抗阿霉素誘發的mTOR活化,降低糖酵解活性,增強白血病多藥耐藥細胞K562/ADM對化療藥的敏感性。高琪等[21]研究發現2-DG抑制糖酵解,同時下調缺氧誘導因子1α的表達,從而下調相關基因的表達改善腫瘤微環境,可增強抗血管生成藥的抗腫瘤作用。
Rapa對不同類型的腫瘤細胞均有細胞周期阻滯作用。在我們的實驗中,CCK-8結果提示Rapa和2-DG均能抑制多發性骨髓瘤細胞的增殖,呈濃度依賴性,當兩藥合用時顯示出比單藥更強的抑制作用,CI值均<1,說明具有協同作用。細胞周期分析顯示Rapa和2-DG合用組使MM細胞更多地阻滯在G0/G1期,S期比例顯著下降,說明兩藥合用能發揮更大的細胞周期阻滯作用。當Rapa(50 nmol/L)單獨作用MM細胞48 h時,發生了少量的凋亡,與2-DG(0.5 mmol/L)聯合作用時,細胞凋亡率顯著增加,表明促進骨髓瘤細胞凋亡也是合用組發揮協同作用的重要途徑。Western blot也從蛋白水平揭示了合用組細胞周期調控蛋白CyclinD1的表達較單藥組和空白對照組顯著下調,合用組促凋亡蛋白P53、Bax的表達較單藥組顯著升高,而合用組凋亡抑制蛋白Bcl-2的表達較單藥組顯著下降,我們猜想這些蛋白表達水平的變化與MM細胞糖酵解受到抑制有關。Vijay等[10]解釋了Rapa對MM細胞的細胞毒性作用主要是通過自噬而不是凋亡來介導的。在本實驗中,我們推測Rapa聯合2-DG對MM細胞的細胞毒性作用部分是通過細胞自噬介導的,這一機制需要后續的實驗進一步研究。
總之,我們證明了mTOR和糖酵解的雙重抑制降低了多發性骨髓瘤細胞的增殖率和存活率,兩藥合用具有協同作用。我們從細胞周期阻滯、凋亡增加等機制解釋了這一現象。這種組合將是治療MM的一種有前景的方法,并為后續進一步研究其機制,尤其是致癌信號與腫瘤細胞代謝之間的相互作用提供了初步的基礎。這些觀察結果需要在臨床前試驗中進一步確認。

