一種提高磁微粒化學發光試劑穩定性的方法
馬明,王玉堂,渠海
(鄭州安圖生物工程股份有限公司,河南 鄭州 450016)
在體外診斷(in vitro diagnosis,IVD)行業中免疫診斷是極其重要的一部分,其主要基于抗原與抗體的特異性結合,用于檢測腫瘤、肝炎、病毒、激素等[1-2]。目前我國的免疫診斷技術的主流是酶聯免疫和化學發光兩種。化學發光技術較酶聯免疫技術具有靈敏性高、測試速度快、特異性強等優點,這些優點使得化學發光正在取代酶聯免疫成為更主要的檢測方法[3-4]。
國內IVD 企業想要在市場上立足,并逐步替代外國廠商產品,產品質量是這一切的重中之重。在關于質量的一系列指標中,如何保證產品能夠在運輸、存放、使用過程的狀態一致一直是一個很難解決的問題。在磁微粒化學發光試劑盒中,磁微粒混懸液組分是重要的組分,也是最不容易保持穩定性的成分。這是因為其不僅要保證磁微粒混懸液在存放過程中的不發生嚴重凝集和板結,也需要防止結合的抗體或抗原在會隨著時間的延長發生變化[5]。
磁微粒是由是一種聚苯乙烯包裹的γ-Fe2O3的復合物,雖然表面進行改性帶有羧基和氨基基團,但其含量比較少,聚苯乙烯具有很強的疏水作用力,因此磁珠在整個包被過程中會對蛋白具有很強的吸附性,磁珠與蛋白之間除了化學連接外還存在弱吸附和多重吸附[6]。這部分吸附雖然可能會提高信號值,但在包被后會對穩定性起到負面效果,在包被后進行實時放置和熱加速處理過程中,弱吸附與多層吸附的抗體會緩慢脫落,導致其信號值升高或者降低,從而影響其穩定性和精密性。目前針對磁珠表面非特異性吸附有較多的研究思路,例如可以加入表面活性劑,但表面活性劑有一定的缺點,其易于和蛋白形成膠束且后續無法將其除去,因此需要對不同的表面活性劑進行篩選。通過對文獻資料查閱,我們發現精氨酸在抑制蛋白吸附這方面有一定的效果[7-8]。因此可以通過精氨酸以及精氨酸復配表面活性劑將這部分抗體清除以解決磁珠包被后穩定性問題。本文對甲胎蛋白(AFP)磁微粒試劑盒中的磁微粒試劑進行研究以提出一種可以簡單提高穩定性性能的方法。
1 材料和方法
1.1 材料
1.1.1 主要試劑 磁微粒(Merck 公司,羧基磁珠,10%質量濃度);包被抗體(鄭州伊美諾生物技術有限公司);1-乙基-(3-二甲基氨基丙基)碳二亞胺鹽酸鹽(EDC)(Sigma 公司);N-羥基丁二酰亞胺(NHS)(Sigma 公司);磁微粒偶連緩沖液0.1 mol/L pH=7.4 MES 緩沖液;磁微粒保存液:緩沖液0.1 mol/L pH=7.4 PBS 緩沖液含1%牛血清蛋白(BSA);乙醇胺(Aladdin 公司);L-精氨酸(L-Arg)(Sigma 公司);3-[(3-膽酰胺基丙基)二甲基銨基]-1-丙磺酸鹽(CHAPS)(Aladdin 公司);十二烷基磺酸鈉(SDS)(Sigma 公司);十二烷基聚氧乙烯(23)醚(BRIJ-35)(Sigma 公司)。
1.1.2 主要儀器 全自動化學發光測定儀AutoLumo A2000 Plus(安圖生物);電熱恒溫培養箱(上海躍進醫療器材有限公司);振蕩器(TOPSCIEN 公司)。
1.2 研究方法
1.2.1 磁微粒試劑包被方法 在4 mL 玻璃瓶中分別加入0.1 mL 10%質量濃度羧基磁珠,1 mL 偶連緩沖液,震蕩混勻5 min 后磁吸分離并重復3 遍進行清洗,而后分別加入0.3 mL 0.1 mol/L EDC 溶液與0.3 mL 0.1 mol/L NHS 溶液(注:以偶連緩沖液進行溶解),室溫震蕩反應1 h;洗2 次后加入0.9 mL 磁微粒偶聯緩沖液和0.6 mg AFP 抗體,并室溫震蕩反應2 h。最后加入乙醇胺60 μL 繼續反應30 min,使用磁微粒保存液磁分離清洗3 次后定容至9 mL,2~8℃儲存。
1.2.2 磁微粒試劑穩定性洗脫處理方法 對測試磁微粒混懸液進行磁分離后加入等體積的洗脫液,而后對洗脫條件進行調整,而后采用磁微粒保存液進行3 次清洗后重新定容到初始濃度。洗脫條件為:①采用超聲清洗(15 min)與振蕩器震蕩(15 min);②震蕩時間對比;③震蕩溫度對比;④精氨酸與CHAPS 復配對比;⑤精氨酸與BRIJ-35復配對比;⑥精氨酸與SDS 復配對比。
1.2.3 測試模式 由機器按照上機文件進行測試,每次加入25 μL 校準品(濃度值為0 μIU/mL、10 μIU/mL、50 μIU/mL、100 μIU/mL、500 μIU/mL、1 000 μIU/mL)、50 μL 樣品稀釋液、20 μL 磁珠混懸液和100 μL 酶結合物以及100 μL 底物。具體過程使用A2000plus 儀器進行檢測,除磁珠混懸液其余均使用該公司在售試劑盒內組分。
1.2.4 檢測指標 目前IVD 行業對化學發光試劑盒的穩定性的共識為在37℃下放置7 d 約等于試劑條件下在2~8℃下存放8~12 個月,而針對這一情況本文更進一步選擇在37℃下放置10 d 來考察穩定性情況,計算濃度點發光值下降率(ROD)(%)=ABS(RLU37℃10d/RLU2~8℃-1)×100%,ROD均值為校準品各值的平均值,目前業內公認ROD值小于10%為合格標準。
2 結果
2.1 洗脫方式對磁微粒混懸液穩定性影響的結果
通過對比不同洗脫方式,我們發現超聲洗脫雖然與震蕩洗脫對于穩定性的影響類似,但是不論其熱加速后還是熱加速前的信號值均低于震蕩洗脫,并且長時間的超聲并放置一段時候后容易出現磁微粒凝集,因此可以選擇震蕩洗脫進行進一步研究。采用15%L-Arg 使用不同洗脫方式對AFP 項目磁微粒混懸液的影響如表1 所示。
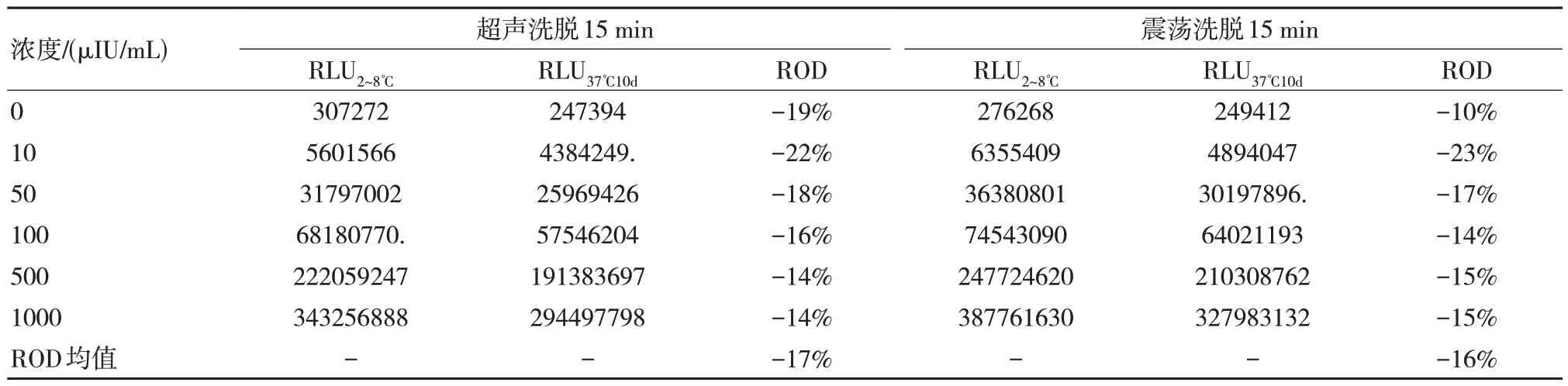
表1 磁微粒混懸液采用不同洗脫方式穩定性結果比較
2.2 洗脫時間對磁微粒混懸液穩定性影響的結果
洗脫時間的長短影響者洗脫效果,對洗脫15 min 與洗脫12 h 進行比較可以發現經過震蕩洗脫12 h,其磁珠混懸的ROD 為10%,基本合格。見表2。
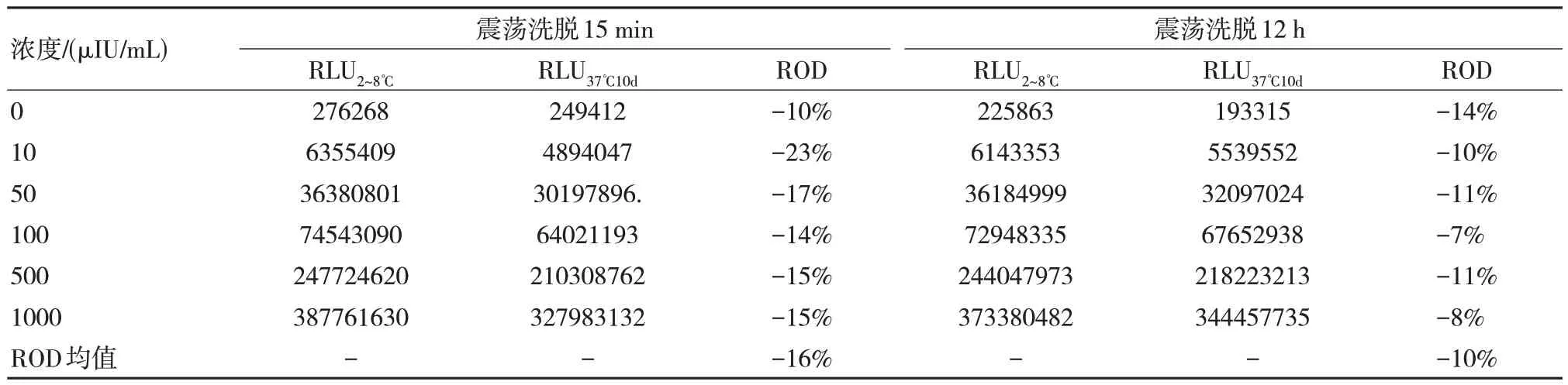
表2 磁微粒混懸液不同時間穩定性結果比較
2.3 洗脫溫度對磁微粒混懸液穩定性影響的結果
由于與表1、2 所使用的不是同一批包被好的磁微粒混懸液,所以可以發現其冷藏放置的初始值并不相同,而采用37℃震蕩的結果與常溫震蕩結果相當。且放置一段時間后上機混勻出現小顆粒凝集,所以根據以上條件,可以將洗脫工藝確定為采用振蕩器常溫震蕩過夜洗滌的方式進行洗脫,可以有效提高穩定性。以室溫和37℃烘箱進行洗脫對比,結果如表3 所示。
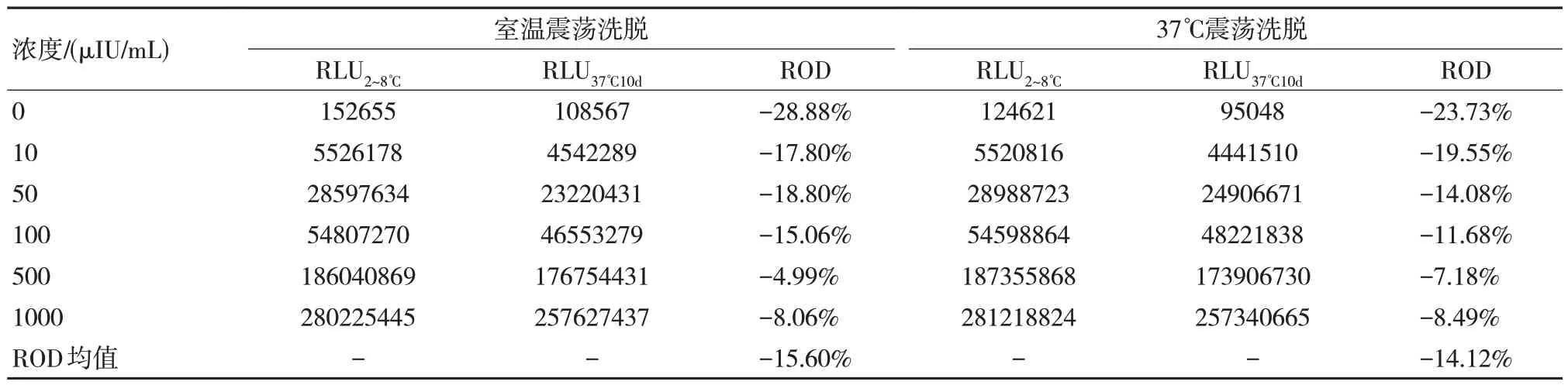
表3 磁微粒混懸液不同溫度穩定性結果比較
2.4 精氨酸復配表面活性劑對磁微粒混懸液穩定性影響的結果
為了控制非特異性吸附同時增加洗脫效果,本文選擇了CHAPS、SDS、BRIJ-35 與L-Arg 進行復配測試,結果如表4 所示。
依據表4 的數據發現在經過4 種洗脫液洗脫之后5%SDS+15%L-Arg 信號值最高,而5%CHAPS+15%L-Arg 信號值最低;但經過10 d 37℃的熱加速放置,發現5%SDS+15%L-Arg 信號值降幅較大,即使觀察其信號值也較低,因此其效果較差,而5%CHAPS+15%L-Arg 熱加速前后變化較小,為以上幾種方案中的最優方案。
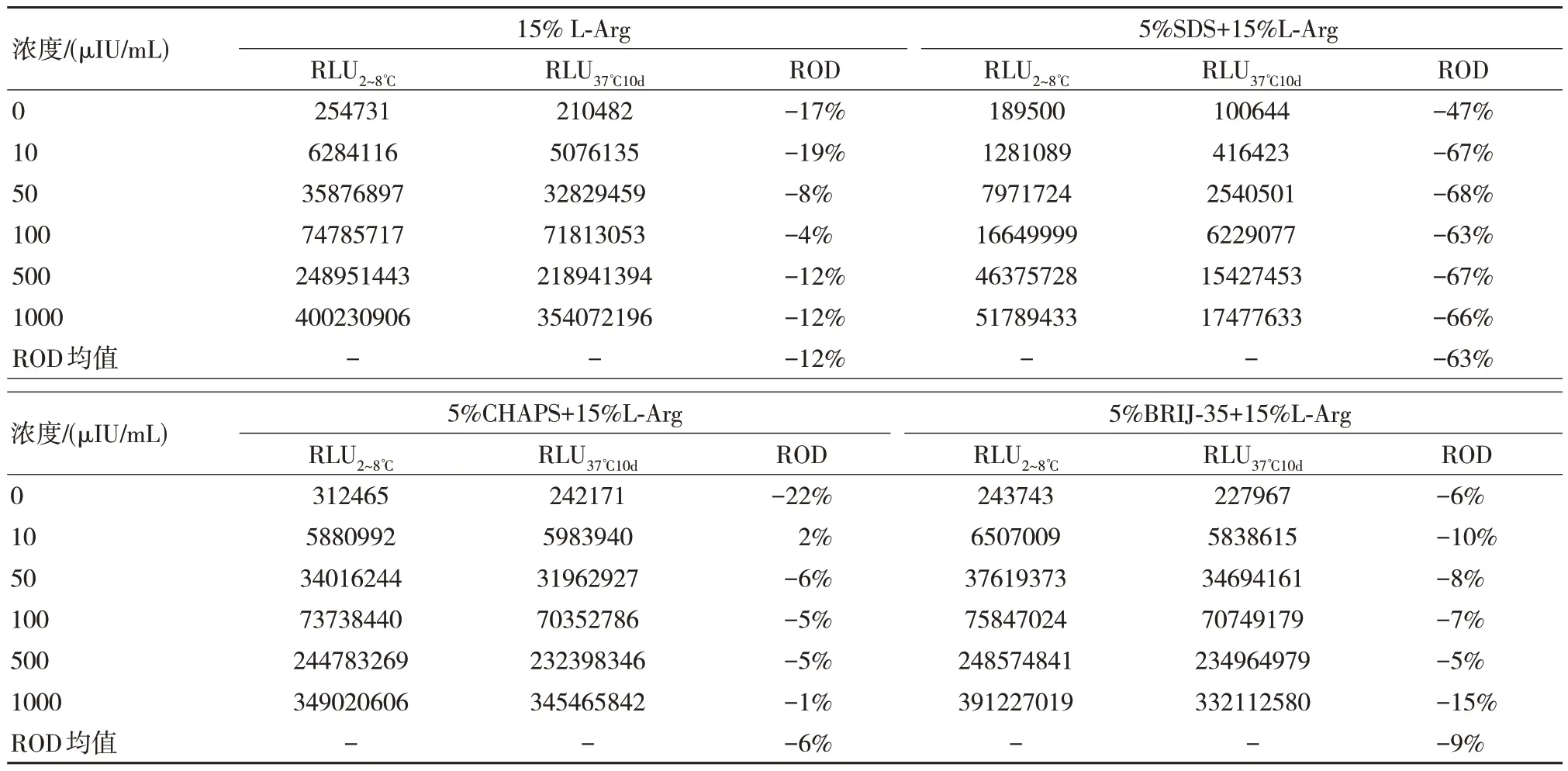
表4 L-Arg 復配不同表面活性劑穩定性結果比較
2.5 精氨酸復配表面活性劑用量對磁微粒混懸液穩定性影響的結果
根據表4 的分析除了可以得到5%CHAPS+15%L-Arg 具有較為優秀的結果之外,也可以得到5%BRIJ-35+15%L-Arg 信號值與之相當,同時BRIJ-35 成本較低,可以降低總體的成本,因此針對其調控濃度。
如表5 所示,提高了BRIJ-35 的復配比例,可以發現其可以提高穩定性,但是當提高到30%時雖然ROD 均值較低,但是觀察數據可以發現其校準品低值信號值降低而高值提升,說明其可能引起了基質效應。
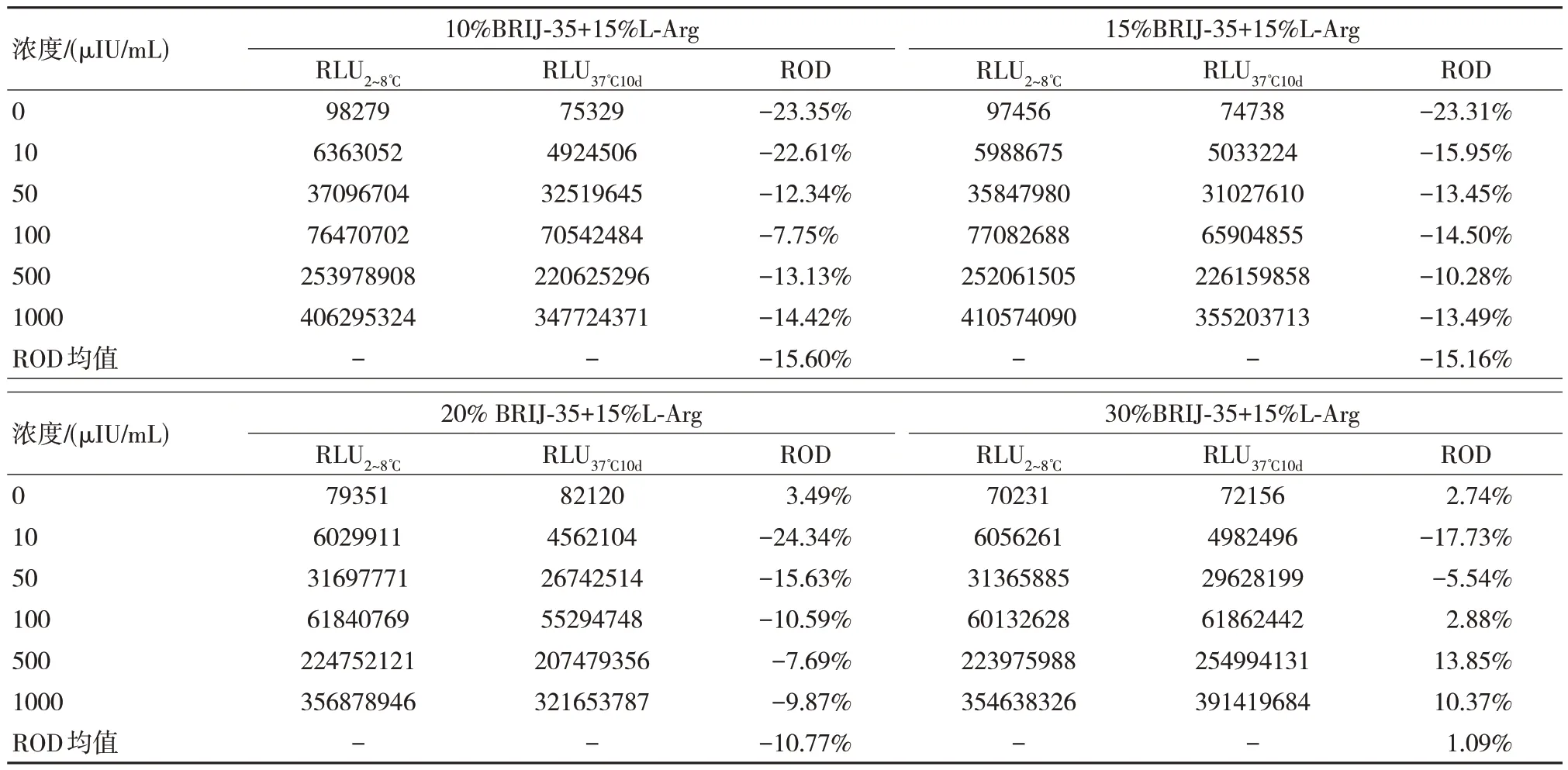
表5 不同濃度BRIJ-35 穩定性結果比較
3 討論
通過使用洗脫,可以在不調整包被工藝與保存液的成分的情況下提高磁微粒混懸液的穩定性:采用15%精氨酸與5%CHAPS[9]進行復配對磁微粒混懸液進行等體積置換后,在振蕩器上震蕩反應12 h,而后用磁微粒保存液進行清洗3 次后重新定容;如果為了降低成本還可以用BRIJ-35 進行替換,但是為了達到同樣的效果需要進行調控。
在包被抗體的過程中,除了一部分抗體通過化學連接在微球表面,還有一部分抗體會非特異性吸附于微球表面,這部分非特異性吸附的抗體不僅僅會在存放過程中脫落,其脫落后的位點還可能吸附其他物質從而影響后續檢測的進行。而精氨酸不僅可以抑制疏水作用[10],還因其離子特性能對靜電相互作用產生影響。而且對精氨酸的結構研究可以推測部分與聚苯乙烯顆粒芳香側鏈結合的抗體可以被精氨酸競爭性相互作用而導致有效解吸[11]。
綜上所述,使用精氨酸可以顯著抑制抗體在磁微粒表面吸附。而表面活性劑如CHAPS 可以增溶膜蛋白和裂解蛋白-蛋白之間的相互作用,BRIJ-35 本身也具有類似作用,這使這兩種表面活性劑成為一種適合復配的試劑。

