FFPE組織HPV檢測中PCR-反向點雜交技術的應用:兩種核酸提取方法的比較
王 誠,童玲玲,劉千琪,況 薇
四川大學華西第二醫院病理科/出生缺陷與相關婦兒疾病教育部重點實驗室,四川成都 610011
在全球范圍內,宮頸癌是女性癌癥死亡的第3大原因,每年新發病例約52.8萬,死亡病例約26.6萬[1]。約95%的宮頸癌是由人乳頭瘤病毒(HPV)持續感染引起的,尤其是高危型HPV(HR-HPV)16和18兩種亞型,是腫瘤轉化發生的主要激活因素[2-3]。目前,宮頸脫落細胞HPV檢測是宮頸癌篩查及后續疫苗接種研究的主要手段[4]。然而,行宮頸脫落細胞HPV檢測的大部分感染人群是一過性感染[5]。采用組織標本進行檢測對明確HPV感染亞型與腫瘤病變的關系尤為重要。福爾馬林固定石蠟包埋(FFPE)組織是使用最廣泛的可用于臨床回顧性研究的標本資料,近年來,FFPE組織用于HPV檢測引起研究者的廣泛關注[6]。福爾馬林固定及石蠟處理會引起DNA片段化、DNA與蛋白質相互交聯,從而影響標本DNA的提取產量和擴增效率,因此對于FFPE組織的DNA提取及HPV檢測方法尚存在爭議。本研究通過對比粗提法和純化法兩種核酸提取方法獲得的DNA質量,分析PCR-反向點雜交法(PCR-RDB)用于HPV檢測所得結果的有效性,根據經濟效益及實驗室條件選擇不同的核酸提取方法,為臨床提供有效的HPV檢測結果。
1 資料與方法
1.1一般資料 收集2019年9月至2020年10月四川大學華西第二醫院病理科存檔的宮頸癌標本(FFPE組織)25例。所有標本病理診斷均為浸潤性宮頸癌,標本來源患者的中位年齡為48.7歲。其中宮頸鱗癌12例,腺癌/黏液腺癌6例,腺鱗癌6例,小細胞神經內分泌癌1例。宮頸癌國際婦產科聯盟(FIGO)分期:ⅠB期14例,ⅡA期5例,Ⅲ期5例,Ⅳ期1例。
1.2儀器與試劑 FFPE組織核酸提取試劑盒(QIAamp?DNA FFPE Tissue kit,德國凱杰公司)、NanoDrop 2000分光光度計(賽默飛世爾科技公司)、PCR-RDB檢測試劑盒(深圳亞能生物技術有限公司)、內參β-Globin試劑(上海透景生命科技股份有限公司)。
1.3方法
1.3.1FFPE組織切片的制備 切片均由有經驗的病理技師完成。從蠟塊中切取6張5 μm切片(面積2~4 cm2),第1張及最后1張用于HE染色及癌灶面積評估,第2、3張用于粗提法,第4、5張用于純化法。操作前、后均用75%乙醇擦拭切片機、蠟塊和刀架表面,每切一個蠟塊更換一個刀口,用一次性塑料鑷子轉移切片至EP管。
1.3.2DNA提取 粗提法:加入200 μL裂解液,振蕩混勻1 min,置入金屬浴100 ℃加熱10 min,放入離心機中12 000 r/min離心5 min,離心后由上至下分為3層,分別為石蠟層、DNA溶液層、組織碎片層,取中間DNA溶液層進行檢測。
純化法:二甲苯加入EP管脫臘,無水乙醇洗滌去除殘留二甲苯,后續操作按照FFPE組織核酸提取試劑盒說明書操作。最后,加入100 μL洗脫液獲得DNA溶液。
1.3.3DNA質量評估 用NanoDrop 2000分光光度計檢測DNA純度和濃度。通常認為A260/A280為1.8~2.0表明DNA純度較好,低于1.6表明標本中蛋白質含量超標或酚等污染,高于2.0表明標本中含有RNA。采用實時熒光定量PCR法檢測標本中β-Globin(Cy5通道)Ct值,Ct值≤32判定結果為有效,Ct值>32判定結果為無效。
1.3.4HPV-DNA亞型檢測 HPV-DNA亞型檢測采用PCR-RDB。標本DNA提取后,按操作說明書進行PCR擴增、雜交和顯色。設置陰性和陽性對照品作為質控,以尼龍膜條上IC點作為內參質控點,膜條各檢測點有藍色信號表明HPV有對應基因亞型陽性;若HPV陽性,IC點無信號,則可能為PCR擴增競爭抑制,結果應判讀為HPV陽性;若HPV為陰性,且IC點無信號,則表明該標本檢測操作失敗。PCR-RDB檢測試劑盒可檢出23種亞型,包括18種HR-HPV亞型(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82、83)和5種低危型HPV(LR-HPV)亞型(6、11、42、43、81)。
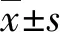
2 結 果
2.1兩種提取方法提取的DNA質量比較 粗提法提取的DNA濃度為(60.70±28.50)ng/μL,純化法提取的DNA濃度為(21.65±10.46)ng/μL,粗提法較純化法可獲得較高的DNA濃度(P<0.05);粗提法和純化法提取的DNA A260/A280分別為1.44±0.20、1.92±0.16,純化法獲得的DNA純度更高(P<0.05)。實時熒光定量PCR法檢測兩組標本β-Globin的Ct值,發現粗提法Ct值高于純化法(18.99±1.88vs.17.44±2.79,P<0.05),但有1例標本Ct值>32。粗提法提取的DNA A260/A280雖明顯低于純化法,但DNA提取成功率可達96%,除1例標本未獲得足量DNA外,其余標本均完成檢測,且Ct值均<32。見圖1。
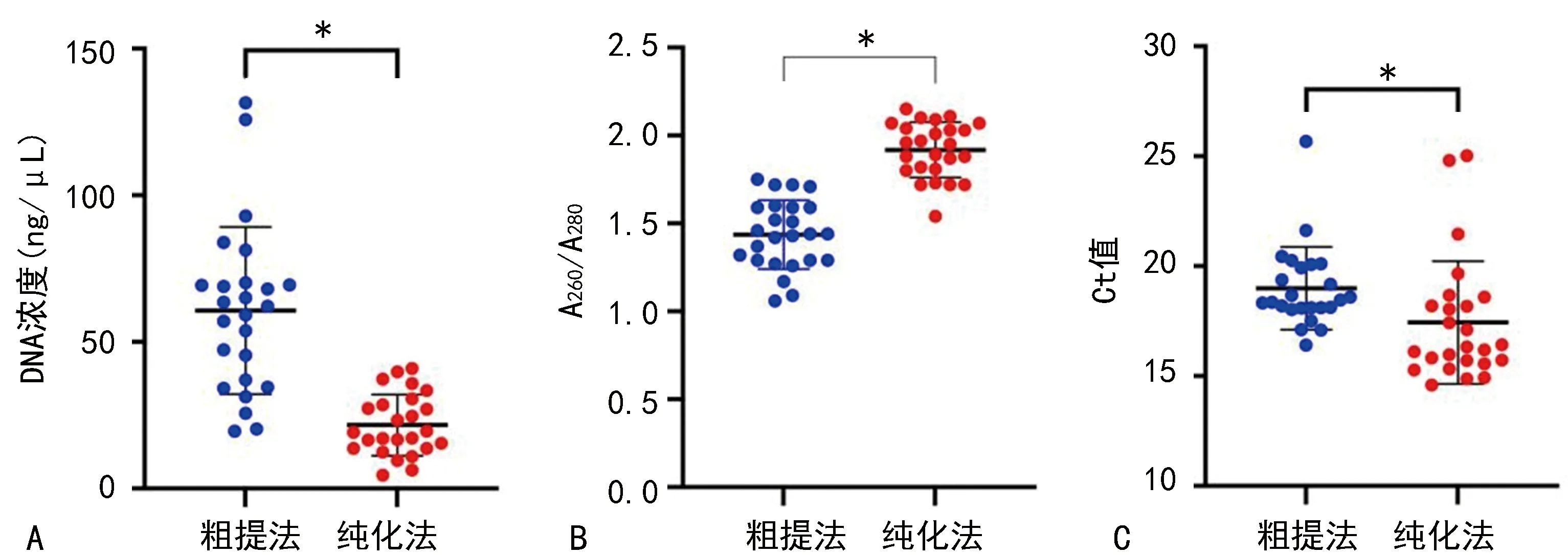
注:A為兩種方法DNA濃度比較;B為兩種方法A260/A280比較;C為兩種方法β-Globin Ct值比較;*表示P<0.05。
2.2宮頸癌標本HPV感染結果分析 采用粗提法和純化法提取DNA后檢測HPV感染情況,結果發現總HPV陽性率分別為92%和96%;在鱗癌標本中,粗提法提取時有1例失敗,且PCR-RDB檢測未獲得有效結果,但通過純化法檢測出HPV58感染。在腺癌/黏液腺癌和腺鱗癌中,兩種提取方法均發現HPV陽性病例,二者檢測結果比較,差異無統計學意義(P>0.05)。見表1。

表1 25例不同病理類型宮頸癌標本HPV感染情況

續表1 25例不同病理類型宮頸癌標本HPV感染情況
2.3兩種提取方法提取的DNA標本HPV亞型檢測結果對比 采用粗提法提取的DNA標本HR-HPV陽性率低于純化法(92%vs.96%),但單一型HPV16陽性率高于純化法(44%vs.36%);與純化法相比,粗提法提取的DNA無法檢測出更多型別的混合感染,但經純化法提取后可檢測出HPV33、HPV53、HPV58等多型別感染。二者陰性率相當,均為4%。見表2。
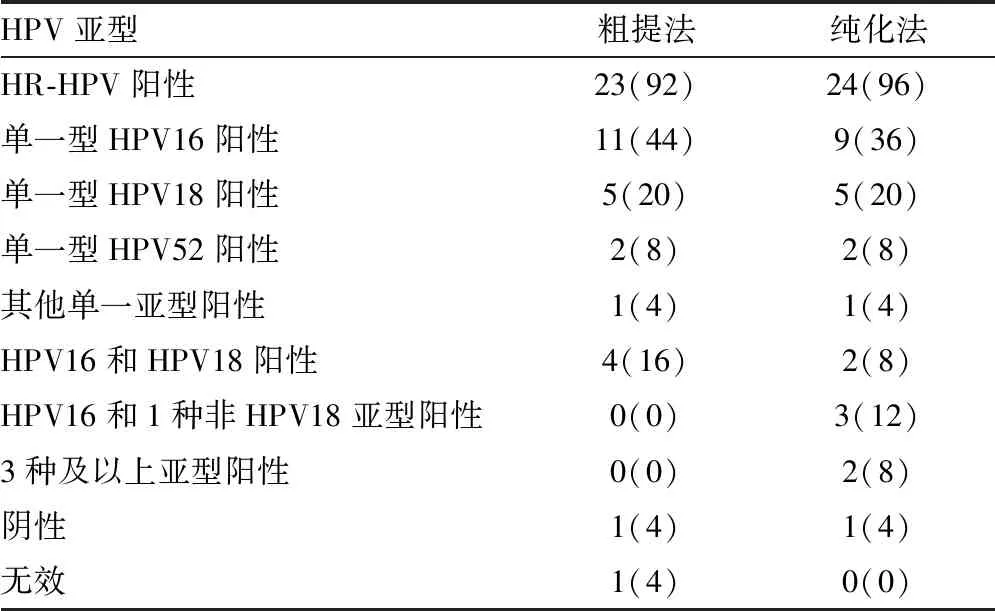
表2 兩種提取方法提取的DNA標本HPV亞型檢測結果對比[n(%)]
3 討 論
HPV是一種小型雙鏈環狀DNA病毒,其基因組長度為8 000 bp。現已知超過上百種HPV亞型,其中12種被世界衛生組織認定與癌癥密切相關,尤其是HPV16和HPV18與癌癥病變最相關[7]。HPV感染主要發生在上皮組織,包括宮頸、肛門和口咽部的上皮組織等,這可能與上述部位特殊的解剖結構有關,其黏膜表面可提供微生物感染的最佳環境,更容易造成HPV持續感染,導致腫瘤的發生[8]。目前,HPV檢測方法主要適用于宮頸脫落細胞。從FFPE組織中獲得高質量的DNA是一項難題,因為福爾馬林引起的核酸-蛋白質之間的交聯會影響DNA下游分析。通常,從福爾馬林固定的組織標本中提取的核酸處于高度降解狀態,且平均片段大小在300 bp左右。PCR-RDB主要用于宮頸脫落細胞HPV檢測,因其操作簡便及價格低廉,在國內較多醫院被廣泛使用,但其針對FFPE組織的HPV檢測研究甚少。SUN等[9]通過大樣本單中心臨床研究發現,PCR-RDB是一種可靠、靈敏、準確的方法,其檢測結果具有良好的臨床參考價值,可以準確檢測宮頸HPV感染[9-10]。
與宮頸脫落細胞相比,FFPE組織HPV亞型的準確鑒定對監測疾病進展和預防宮頸癌的發生具有重要意義。另外,FFPE組織可長期存放于病理檔案室,為回顧性流行病學研究提供了豐富的生物樣本。目前,德國凱杰公司FFPE組織核酸提取試劑已被廣泛運用于分子病理基因下游檢測,其主要通過二甲苯和無水乙醇預處理來去除石蠟,但存在操作復雜和二甲苯對人體危害大等缺點,尤其是反復洗滌的過程可能造成組織碎片的丟失[11]。同時,由于福爾馬林的固定及石蠟的存在會引起DNA的片段化及DNA與蛋白質相互交聯。一般情況下,DNA與蛋白質交聯可通過加熱在某種程度上逆轉,但對處理的時間和溫度卻存有爭議[12-13]。本研究采用粗提法,即標本與裂解液混合加熱100 ℃ 10 min解除DNA與蛋白質交聯,由于粗提法加入裂解液后直接加熱提取可能存在大量有機物或蛋白質污染的風險,影響核酸的分離及病毒基因擴增,而結果顯示純化法獲得的DNA純度確實較粗提法更高,提示粗提法獲得的DNA標本中殘存一定量有機溶劑和蛋白質污染,可能影響后續HPV檢測結果。但本研究結果發現,純化法獲得的DNA濃度明顯低于粗提法,粗提法獲得的DNA標本中除了1例未獲得足量DNA外,其他標本均完成HPV檢測,且粗提法獲得的DNA標本HPV陽性率為92%,與純化法結果相當(96%),粗提法單一型HPV16陽性率也明顯高于純化法(44%vs.36%)。粗提法中存在的有機物及蛋白質污染可能影響PCR反應擴增效率,本研究結果顯示,粗提法獲得的DNA標本HPV多型別感染陽性率較低,而純化法獲得的DNA標本HPV多型別感染陽性率明顯較高。然而,快速、簡單的粗提法獲得的DNA標本HR-HPV陽性率雖然低于純化法,但兩種提取方法獲得的DNA標本HR-HPV陽性率均超過90%。本研究發現粗提法獲得的DNA標本足以滿足HPV亞型檢測,且能獲得有效結果,操作過程簡便易行,耗時較短,可同時進行多個FFPE組織標本的提取;雖然純化法獲得的DNA質量較好,但操作復雜,耗時較長,組織經蛋白酶K消化不佳常發生堵管現象,且成本較高。
綜上所述,本研究證明了宮頸癌FFPE組織兩張5 μm切片(面積2~4 cm2)即可用于HPV亞型檢測。無論采用何種核酸提取方法都能獲得足量DNA用于HPV檢測,且在浸潤性宮頸癌組織中發現HR-HPV感染超過90%。此外,FFPE組織HPV檢測可以采用簡便易行的粗提法提取DNA,該提取方法可供基層醫院使用,操作中應避免交叉污染。若需要獲得更多HPV亞型或多型別HPV感染情況,仍推薦采用純化法提取DNA,但粗提法足以滿足常規臨床病理檢測工作,并能夠為臨床提供有效的HPV檢測結果。

