血清BG、GM在不同免疫狀態下肺煙曲霉菌感染大鼠中的實驗研究*
黃宛虹,磨立達△,羅曉璐,陳松林,劉澤端
1.南寧市第四人民醫院/廣西醫科大學附屬南寧市傳染病醫院/廣西艾滋病臨床治療中心(南寧)檢驗科,廣西南寧 530023;2.廣西中醫藥大學第一附屬醫院檢驗教研室,廣西南寧 530023
近年來,由于抗菌藥物的廣泛應用、惡性腫瘤發病率升高、器官移植術的開展、人類免疫缺陷病毒感染者增多、各種導管侵入性操作,以及免疫抑制劑、糖皮質激素的使用等導致肺部真菌感染發病率逐年增加,且關于免疫功能正常者患肺部真菌感染相關疾病的報道越來越多。免疫功能正常者感染煙曲霉菌的原因及機制均尚不明確,其中部分患者很可能存在某種潛在疾病,如惡性腫瘤[1-2],因此,明確不同免疫狀態下肺煙曲霉菌感染的原因及機制是亟待解決的問題,而CD4+T細胞是目前公認的反映患者免疫力的指標,半乳甘露聚糖(GM)、(1,3)-β-D-葡聚糖(BG)在侵襲性肺煙曲霉菌病(IPA)中有較高的診斷價值,是診斷IPA的良好指標。故本研究通過構建不同免疫狀態下肺煙曲霉菌感染的大鼠模型,動態分析血清BG、GM、白細胞計數(WBC)在肺煙曲霉菌感染中的水平變化,以明確免疫缺陷嚴重程度與肺煙曲霉菌感染的關系。
1 材料與方法
1.1材料來源 煙曲霉菌菌株購自中國科學院微生物研究所,編號3.15720。實驗動物為BALB/c清潔級雄性SD大鼠150只,6~8周齡,體質量為280~320 g,購自浙江維通利華實驗動物技術有限公司[SCXK(浙)2019-0001]。大鼠分組分籠飼養,每籠2只,清潔級環境,標準飼養,自由飲水。本研究符合動物實驗要求,經過醫院動物實驗倫理審查。
1.2儀器與試劑 環磷酰胺和地塞米松購自Sigma 公司;沙保弱培養基購自廣州迪景科技有限公司;生理鹽水購自旭東海普藥業有限公司;甲醛組織固定劑由中山市康乃欣生物醫療科技有限公司生產;蘇木精-伊紅染色劑由上海化學試劑有限公司生產;全自動細菌內毒素檢測系統及其配套的BG檢測試劑為湛江安度斯生物有限公司產品;嘉興科瑞迪醫療器械有限公司生產的HB-300E全自動酶聯免疫分析儀及丹娜生物科技有限公司生產的GM檢測試劑;美國BD公司生產的FACSVia流式細胞儀及其配套試劑;日本SYSMEX公司生產的XT-2000i全自動血液分析儀及其配套試劑;德國徠卡公司生產的EG11504顯微鏡。所有試劑均于有效期內使用。
1.3方法
1.3.1培養基配制 1 g葡萄糖、1 g蛋白胨和0.5 g酵母提取物加入100 mL的蒸餾水中,混合均勻,分裝至玻璃試管中,將松緊適宜的棉塞塞進試管,牛皮紙包扎滅菌。
1.3.2煙曲霉菌孢子懸液的制備 將煙曲霉菌株凍干粉用液體培養基復活后,取30 μL移植于含液體培養基的試管中,28 ℃培養5 d,孢子懸液轉入15 mL離心管中,3 000 r/min離心15 min,去除上清液,孢子重懸在生理鹽水中,調整孢子懸液濃度為1×107CFU/mL。
1.3.3實驗分組及模型構建 將150只大鼠均分為以下6組:組1為正常對照組;組2為低劑量免疫抑制組;組3為高劑量免疫抑制組;組4為正常狀態感染組;組5為低劑量免疫抑制感染組;組6為高劑量免疫抑制感染組。組1、組4連續注射生理鹽水3 d,組2、組5連續注射地塞米松0.3 mg/kg+環磷酰胺37.5 mg/kg 3 d,組3、組6連續注射地塞米松0.6 mg/kg+環磷酰胺75 mg/kg 3 d;第4天、第5天組1、組2、組3經鼻滴生理鹽水,組4、組5、組6經鼻滴1×107CFU/mL孢子懸液;各組將實驗開始第6天定義為感染1 d,在感染1、3、5、7、9 d這5個時間點分別處死1/5大鼠取肺組織及血液標本。
1.3.4實驗室指標檢測 通過酶聯免疫吸附試驗的競爭法檢測GM水平,光度法檢測BG水平,全自動全血五分類法檢測WBC、中性粒細胞計數(NEUT)。流式細胞計數:取 100 μL大鼠抗凝全血,加入相應水平抗體,避光孵育 30 min,加入紅細胞裂解液,混勻后避光靜置10 min,離心棄上清液,加入 500 μL磷酸鹽緩沖液(PBS),離心棄上清液,重復洗滌兩次。加500 μL流式上樣緩沖液重懸后,用流式細胞儀分析CD4+T細胞水平。
1.3.5肺組織真菌培養及病理組織檢查 所有大鼠自實驗開始每天均觀察一次至實驗結束,實驗中大鼠死亡后或麻醉處死大鼠后,于無菌條件下取出完整肺組織,左肺用40%甲醛溶液固定,石蠟包埋切片,蘇木精-伊紅染色法(簡稱HE染色法 )染色,光鏡下觀察。右肺采用5 mL 0.9%氯化鈉注射液漂洗后,用300目篩網過濾,制成懸液,加1 mL 0.9%氯化鈉注射液稀釋,取0.2 mL接種于沙保弱瓊脂培養基斜面,置于28 ℃溫箱培養4 d,觀察結果。
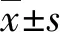
2 結 果
2.1實驗動物的一般狀況 組1飲水、進食、活動無明顯異常,體質量每天增加約7 g,無死亡;組2飲水、進食、活動先減少后增加,體質量在感染1~5 d每天減輕約8 g, 感染6~7 d未見明顯改變,到感染9 d時增加約6 g,全程均無死亡;組3飲水、進食、活動減少,體質量在感染1~7 d每天減輕6~10 g,感染9 d時體質量未見改變,全程均無死亡;組4一般情況同組1;組5飲水、進食、活動減少,精神萎靡,體質量在感染1~5 d每天減輕約10 g,感染6~7 d未見明顯改變,到感染9 d時增加約5 g,感染8 d時有1只出現尿血,全程均無死亡;組6飲水、進食、活動減少,毛無光澤、蜷縮、顫抖,體質量每天減輕9~10 g,在感染8~9 d時1只血便,2只死亡。
2.2不同免疫狀態下煙曲霉菌感染大鼠外周血NEUT動態分析 在感染1 d時,組2、組5、組3、組6 NEUT均不同程度降低,特別是組3、組6 NEUT<0.10×109/L,達到NEUT缺乏標準,且與組1比較,NEUT明顯降低,差異有統計學意義(P<0.05)。組6感染9 d 時NEUT較該組其他時期明顯升高,差異均有統計學意義(P<0.05),且與同時期組1比較,差異有統計學意義(P<0.05)。見表1。

表1 不同免疫狀態下煙曲霉菌感染大鼠NEUT動態分析
2.3不同免疫狀態下煙曲霉菌感染大鼠外周血WBC動態分析 與組1比較,感染1~7 d 時,組3、組6 WBC明顯降低,而組4 WBC在感染1~5 d明顯升高,差異有統計學意義(P<0.05),但到感染7 d及以后組1和組4 WBC比較,差異無統計學意義(P>0.05)。組3和組6在感染1 d 時WBC均處于極低水平,感染3 d時升高,至感染9 d時較前面幾天明顯升高,達正常或高水平,組3和組6同組中其他時期WBC與感染9 d時比較,差異有統計學意義(P<0.05)。見圖1、表2。

圖1 不同免疫狀態下煙曲霉菌感染大鼠WBC動態圖

表2 不同免疫狀態下煙曲霉菌感染大鼠WBC動態變化分析
2.4不同免疫狀態下煙曲霉菌感染大鼠免疫細胞動態分析 同時期組間CD4+T細胞水平比較,感染7 d 時,組1與組4比較,差異有統計學意義(P<0.05);組2與組5比較,除在感染7 d 時差異無統計學意義(P>0.05),其余各時期比較,差異均有統計學意義(P<0.05);而各時期組3與組6比較,差異有統計學意義(P<0.05)。在組內不同時期CD4+T細胞水平比較中,組2感染1、3、5 d 低于感染7、9 d,差異有統計學意義(P<0.05),感染3 d 明顯低于感染1 d,差異有統計學意義(P<0.05);組3感染3 d達低值,與其他時期比較,差異有統計學意義(P<0.05),感染5 d明顯低于感染7 d,差異有統計學意義(P<0.05);組4感染7 d達低值,明顯低于感染1、 3、5、9 d,差異有統計學意義(P<0.05);組5感染3 d明顯低于其余時期,差異有統計學意義(P<0.05);組6感染3、5、7、9 d比感染1 d時明顯降低,差異有統計學意義(P<0.05)。不同免疫狀態下大鼠吸入煙曲霉菌后CD4+T細胞水平變化不同,達到低值的時間不同,組4在感染7 d CD4+T細胞水平達低值,組5在感染3 d 時達低值,組6在感染5 d 時達低值。見表3。
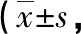
表3 不同免疫狀態下煙曲霉菌感染大鼠CD4+T細胞水平動態分析個/微升)
2.5不同免疫狀態下煙曲霉菌感染大鼠GM、BG水平動態分析 組內各時期GM水平比較,組4感染3 d分別與組內其他時期比較,GM水平明顯升高,差異有統計學意義(P<0.05);組5感染1 d與感染9 d比較,差異無統計學意義(P>0.05),感染1、5、7、9 d與感染3 d比較,差異有統計學意義(P<0.05);組6中,GM水平從感染3 d起均明顯高于感染1 d,差異有統計學意義(P<0.05),其余組內各時期比較,差異無統計學意義(P>0.05)。感染3 d 時組4 GM水平較組1明顯升高,差異有統計學意義(P<0.05);感染5 d時,組5 GM水平較組2明顯升高,差異有統計學意義(P<0.05);感染1~9 d,組6 GM水平較組3明顯升高,差異有統計學意義(P<0.05)。見表4。組6有3只大鼠在感染9 d時BG>100 pg/mL,而BG水平在各組各時期比較,差異無統計學意義(P>0.05)。見表5。

表4 不同免疫狀態下煙曲霉菌感染大鼠GM水平動態分析
2.6不同免疫狀態下煙曲霉菌感染大鼠肺組織培養與病理表現 組4與組5在感染3 d 時部分培養陽性,到感染9 d時再無真菌生長;而組6肺組織在感染1、3、5、7、9 d時培養陽性,煙曲霉菌菌落呈煙綠色;光鏡下,組1大鼠肺泡結構完整,肺泡間隔無增寬,肺間質無明顯水腫,肺泡腔內無炎癥細胞及液體滲出(圖2A);組2、組3可見輕至中度肺泡支氣管水腫,組4可見輕度的彌漫性肺水腫,上述3組均可見中性粒細胞浸潤、出血等病理改變(圖2B、C、D);組5、組6較組4肺部病變程度加重,病變程度隨著免疫抑制劑劑量的增加呈明顯加重,呈現較明顯的劑量依賴性,且隨著給藥時間的增加,病變程度呈明顯加重趨勢,時間依賴性較強(圖2E、F)。組2、組3、組5感染9 d時病理改變持續存在。

表5 不同免疫狀態下煙曲霉菌感染大鼠BG水平動態分析或M(P25,P75),pg/mL]

注:A、B、C、D、E、F分別為組1、組2、組3、組4、組5、組6感染5 d 時肺組織病理圖。
3 討 論
肺煙曲霉菌感染是一種嚴重的機會性感染,在機體免疫力低下時,容易經呼吸道吸入煙曲霉菌而引起感染。正常情況下人體吸入少量煙曲霉菌不致病,但近年來免疫輕度受損者感染煙曲霉菌的情況越來越多[3-5]。發生肺煙曲霉菌感染患者的免疫狀態有所不同,約18%無基礎肺疾病[6-7]。非粒細胞缺乏的肺煙曲霉菌感染患者中,約19%無任何潛在疾病,并且非嚴重免疫缺陷患者的病死率不低于嚴重免疫缺陷患者[8-9]。本研究中,組4與組5在感染3 d時GM水平有一過性升高,考慮出現該結果與煙曲霉菌進入大鼠體內初期階段,機體免疫屏障未能短時間內清除病原菌有關,但在感染5 d后逐漸恢復正常。在大鼠吸入煙曲霉菌后,機體免疫對其作出反應,不同免疫狀態下CD4+T細胞水平變化不同,組4大鼠機體在抵抗煙曲霉菌感染,機體清除煙曲霉菌后即感染7 d時有一過性的免疫力降低狀態,而后則恢復正常;組5前期受到免疫抑制及煙曲霉菌感染的雙重作用,在感染3 d時免疫力最低,表現為CD4+T細胞水平最低,而后CD4+T細胞水平升高但在感染9 d時又降低,考慮為機體免疫力與病原菌相互作用產生的結果;組6 CD4+T細胞水平達低值的時間比組1早,且比組5的輕度免疫抑制大鼠晚,分析原因為由于免疫抑制嚴重,機體在煙曲霉菌入侵時未能在短時間內清除病原菌,導致煙曲霉菌感染,從而使機體免疫力進一步降低,因此表現為CD4+T細胞在感染5、7 d時處于低水平,感染9 d時有所回升,考慮為免疫抑制劑作用減弱引起。早期研究中煙曲霉菌可誘導樹突狀細胞產生曲霉特異性T細胞,且曲霉特異性T細胞過繼免疫療法可使造血干細胞移植受者產生特異性免疫應答反應,同時形成長期的抗真菌保護作用,說明免疫力在肺煙曲霉菌感染中發揮重要作用[10-12]。同時免疫力正常或輕度受損者在肺煙曲霉菌入侵時的病理機制變化及轉歸引起了學者們的重視,本研究推薦在構建大鼠模型進行相關機制的研究時選擇感染后5~7 d的大鼠為佳。
本研究中組4 WBC在感染1~5 d時明顯升高,到感染9 d 時恢復正常水平,組4與組5 GM水平在感染3 d時明顯升高,其他時期相對正常,考慮這兩組在感染3 d 時機體與煙曲霉菌相互作用,原始CD4+T細胞水平較高,免疫力相對正常,在煙曲霉菌入侵時,血液中的單核-巨噬細胞和中性粒細胞系統能夠立即識別病原菌,啟動Toll樣受體等信號轉導通路,引起感染部位中性粒細胞和單核-巨噬細胞聚集,并釋放細胞因子及趨化因子,吞噬并殺滅煙曲霉菌[13-15];也正因為對煙曲霉菌的抵抗作用,導致組4 CD4+T細胞水平降低并在感染7 d或感染3 d 時達低水平后又逐漸升高。在真菌培養中,組4和組5感染3 d 時培養出真菌,但到感染9 d 時再無真菌生長,同時組4 肺組織顯示輕度的彌漫性肺水腫、中性粒細胞浸潤等病理改變,而組2、組3、組5肺組織均表現為輕至中度肺泡支氣管水腫、炎癥細胞浸潤等病理改變,到感染9 d 時病理改變持續存在,可見機體的免疫反應仍對肺組織產生了一定損傷[16]。
組6中由于使用了高劑量免疫抑制劑,WBC、NEUT在感染1~3 d 普遍較低,處于粒細胞缺乏狀態,CD4+T細胞水平在感染5 d 時低于50個/微升,使得機體在煙曲霉菌入侵時不能及時發揮作用,導致煙曲霉菌增殖,表現為肺組織煙曲霉菌培養陽性及GM水平自感染3 d 起較組1明顯升高,組織病理表現為肺泡壁毛細血管充血明顯,片狀的肺泡腔內可見藍紫色顆粒狀的滲出物,存在少量炎癥細胞浸潤,以單核-巨噬細胞為主并伴少量中性粒細胞浸潤。隨著免疫抑制劑對血液系統骨髓抑制作用的減弱,大鼠血液NEUT升高,在感染9 d 時,組6 WBC、NEUT明顯高于組1,CD4+T細胞仍處于低水平,提示煙曲霉菌感染的發生。該研究結果與李志云等[17]的研究結果一致。GM保持高水平,真菌培養陽性,大鼠肺組織炎癥反應進一步發展,肺組織大量彌漫性出血、水腫,正常肺泡結構消失,提示在免疫抑制作用消失后,一方面煙曲霉菌的侵襲作用和毒素對肺組織結構進一步破壞,造成肺組織壞死,另一方面高水平的免疫反應進一步造成肺組織的病理損傷[18-19]。據報道,血液BG水平升高出現較遲,主要用于疾病監測[20],本研究中僅組6在感染9 d 時有3只大鼠BG>100 pg/mL,與趙勇等[21]研究結果有一定差距,分析可能與試劑的靈敏度、臨界值、標本量等有關,具體原因有待進一步研究。
綜上所述,免疫力正常或輕度受損者感染煙曲霉菌后,GM水平表現為一過性升高,但仍有肺組織病理損傷,重度免疫抑制者受煙曲霉菌侵入及增殖的影響,GM水平持續增高,肺組織損傷明顯加重,可見不同免疫狀態可影響肺煙曲霉菌感染的發展和轉歸。

