急性心肌梗死患者血清IGFBP-6、TGF-β1水平變化及與冠狀動脈病變程度和預后的關系*
彭 偉,劉 暢,李 勇,史玉芳,江 蓉,黃薇隗,向常清,鄭永強
1.湖北省宜昌市第二人民醫院/三峽大學第二人民醫院急診內科,湖北宜昌 443000;2.三峽大學仁和醫院功能科,湖北宜昌 443000;3.湖北省宜昌市第二人民醫院/三峽大學第二人民醫院心血管內科,湖北宜昌 443000;4.湖北省宜昌市第二人民醫院/三峽大學第二人民醫院神經內科,湖北宜昌 443000
急性心肌梗死(AMI)是指冠狀動脈的供血減少或中斷導致的心肌壞死,是急性冠脈綜合征(ACS)的嚴重類型[1]。AMI具有較高的致死率,其中約33%的心臟病死亡患者為AMI患者,其嚴重威脅患者的生命安全[2]。AMI患者的冠狀動脈病變嚴重程度與其近、遠期預后相關。早期準確評估冠狀動脈病變的嚴重程度并采取積極措施對減少不良心血管事件的發生十分重要。胰島素樣生長因子結合蛋白-6(IGFBP-6)分布于人體的皮膚、心臟、肺、肝臟等,屬于胰島素樣生長因子結合蛋白家族成員之一,具有調節血管生成的作用[3]。轉化生長因子β1(TGF-β1)是一種具有抗炎效應的細胞因子,可保護缺血心肌細胞,促進心肌細胞分化和血管內皮細胞增生,進而改善心臟功能。在冠狀動脈粥樣硬化發生過程中,TGF-β1可以調節細胞分化,對受損細胞進行修復[4]。褚福永等[5]研究發現,冠心病心力衰竭患者血清TGF-β1水平呈低表達,TGF-β1對患者起到保護作用。本研究通過檢測AMI患者血清IGFBP-6、TGF-β1的水平,探討二者與冠狀動脈病變程度及預后的關系,以期為臨床診療提供參考。
1 資料與方法
1.1一般資料 選取2018年2月至2019年2月于湖北省宜昌市第二人民醫院心內科就診的180例AMI患者為AMI組,其中男95例,女85例;年齡21~78歲,平均(58.90±11.30)歲;體質量指數(BMI)為(25.41±11.96)kg/m2;有吸煙史86例;有高血壓史95例,冠心病史69例,高脂血癥史79例。選取同期體檢健康者50例為對照組,其中男29例,女21例;年齡20~79歲,平均(57.64±12.31)歲;BMI為(26.52±10.97)kg/m2;有吸煙史22例。兩組研究對象性別、年齡、BMI、吸煙史等一般資料比較,差異無統計學意義(P>0.05),具有可比性。納入標準:(1)符合《急性心肌梗死診斷和治療指南》中AMI相關診斷標準[6];(2)心電圖至少2個肢體導聯或相鄰胸前導聯ST段抬高>1 mm;(3)肌酸激酶峰值水平超過正常上限2倍;(4)經冠狀動脈造影檢查證實。排除標準:(1)合并血液疾病、外傷感染、甲狀腺疾病者;(2)合并陳舊性心肌梗死病史者;(3)合并其他心臟嚴重疾病者;(4)合并腫瘤或腦、腎等重要器官嚴重疾病者;(5)妊娠期或哺乳期女性。本研究經醫院醫學倫理委員會批準,納入研究對象均知情同意。
1.2儀器與試劑 IGFBP-6試劑盒購自普洛邁德生物工程有限公司,TGF-β1試劑盒購自碧云天生物技術有限公司,Q3000酶標儀購自美國Thermo Fisher Scientific公司。
1.3方法
1.3.1分組方法 采用Gensini評分法對冠狀動脈病變程度進行評分,并根據評分將AMI患者分為3組:低Gensini評分(LGS)組(<27分),中Gensini評分(MGS)組(27~38分)和高Gensini評分(HGS)組(>38分)。以AMI患者血清IGFBP-6、TGF-β1平均水平為界,將其分為IGFBP-6高表達組、IGFBP-6低表達組,TGF-β1高表達組、TGF-β1低表達組。
1.3.2標本采集 AMI組于入院次日清晨8:30,對照組于體檢當日抽取空腹靜脈血5 mL,4 ℃,3 000 r/min離心10 min,分離血清,并置于-80 ℃冰箱保存待測。
1.3.3血清IGFBP-6、TGF-β1水平檢測 采用酶聯免疫吸附試驗(ELISA)檢測血清IGFBP-6、TGF-β1水平,嚴格按照試劑盒說明書進行操作。
1.3.4AMI患者不良預后情況 在患者發生AMI后30 d觀察期內,記錄患者死亡、心源性休克、再次心肌梗死、致死性心律失常等不良預后情況的發生率。
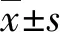
2 結 果
2.1兩組血清IGFBP-6、TGF-β1水平比較 與對照組比較,AMI組患者血清IGFBP-6水平明顯升高,TGF-β1水平明顯降低,差異有統計學意義(P<0.05),見表1。
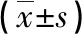
表1 兩組血清IGFBP-6、TGF-β1水平比較
2.2不同Gensini評分患者血清IGFBP-6、TGF-β1水平比較 根據Gensini評分,LGS組59例,MGS組52例,HGS組69例。與LGS組比較,MGS組、HGS組患者血清IGFBP-6水平升高,TGF-β1水平降低,差異有統計學意義(P<0.05);與MGS組比較,HGS組患者血清IGFBP-6水平升高,TGF-β1水平降低,差異有統計學意義(P<0.05),見表2。
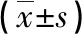
表2 不同Gensini評分患者血清IGFBP-6、TGF-β1水平比較
2.3AMI患者血清IGFBP-6水平與TGF-β1水平的相關性 Pearson相關分析結果顯示,AMI患者血清IGFBP-6水平與TGF-β1水平呈負相關(r=-0.642,P<0.05)。
2.4AMI患者血清IGFBP-6、TGF-β1水平與預后的關系 以AMI患者血清IGFBP-6、TGF-β1的平均水平(分別為483.24 ng/mL、109.10 pg/mL)為界,將AMI患者分為IGFBP-6高表達組101例和低表達組79例,TGF-β1高表達組98例和低表達組82例。結果顯示,IGFBP-6高表達組患者死亡、再次心肌梗死、心源性休克、致死性心律失常發生率高于IGFBP-6低表達組,差異有統計學意義(P<0.05)。TGF-β1高表達組患者死亡、再次心肌梗死、心源性休克、致死性心律失常發生率低于TGF-β1低表達組,差異有統計學意義(P<0.05),見表3、4。

表3 IGFBP-6高表達組和低表達組不良預后情況比較[n(%)]

表4 TGF-β1高表達組和低表達組不良預后情況比較[n(%)]
3 討 論
AMI的發生與各種原因導致的冠狀動脈粥樣硬化引起血管堵塞,進而導致心肌缺血、缺氧、壞死有關。AMI臨床主要表現為急性胸痛、胸悶,嚴重者可導致心律失常及心力衰竭,甚至引起猝死,其發病急、病死率較高[7]。隨著經皮冠狀動脈介入治療的全面開展,以及新型抗血小板藥物、抗凝藥物、溶栓藥物的廣泛使用,AMI患者的病死率降至5%~10%[8],然而AMI患者恢復期不良心血管事件發生率大大增加,包括致死性心律失常、充血性心力衰竭、再次心肌梗死或難治性心肌缺血等。目前,對于AMI患者的預后缺乏有效的評估手段,因此尋找新的生物標志物用于預后早期評估有著重要的臨床價值[9]。
IGFBP-6廣泛存在于人體組織細胞及體液中,能夠特異性地與胰島素樣生長因子Ⅱ(IGF-Ⅱ)結合,抑制IGF-Ⅱ介導的促細胞分化、增殖、生長的生理功能[10]。研究發現,IGFBP-6可通過抑制血管內皮生長因子(VEGF)的功能而抑制血管新生[11-12]。胰島素樣生長因子與心血管疾病存在密切關聯,而IGFBP-6有望成為診斷AMI的血清標志物[13]。吳琴琴等[14]研究表明,IGFBP-6表達上調可抑制心肌成纖維細胞的增殖與分化,推測IGFBP-6在心肌纖維化調控中具有重要作用。本研究結果顯示,AMI組患者血清IGFBP-6水平高于對照組,同時HGS組患者血清IGFBP-6水平高于MGS組及LGS組,MGS組患者血清IGFBP-6水平高于LGS組,提示IGFBP-6水平可能與AMI的發生及AMI患者冠狀動脈病變程度有關。此外,IGFBP-6高表達組患者死亡、再次心肌梗死、心源性休克、致死性心律失常發生率高于IGFBP-6低表達組,提示血清IGFBP-6水平升高還可能與AMI患者短期預后不良有關。
TGF-β1廣泛參與人體內各種病理生理過程,與炎癥、器官纖維化等的發生、發展有關。適量的TGF-β1可修復損傷,過量的TGF-β1則可導致纖維化[15]。TGF-β1可能作為保護因子參與了動脈粥樣硬化的病理過程[16]。本研究結果顯示,AMI組患者血清TGF-β1水平低于對照組,且HGS組患者血清TGF-β1水平低于MGS組及LGS組,MGS組患者血清TGF-β1水平低于LGS組,提示血清TGF-β1可能是AMI發生的保護因素,同時其也與AMI患者冠狀動脈病變程度有關。TGF-β1高表達組患者死亡、再次心肌梗死、心源性休克、致死性心律失常發生率低于TGF-β1低表達組,提示血清TGF-β1水平下降可能與患者短期預后不良有關。相關性分析顯示,AMI患者血清IGFBP-6水平和TGF-β1水平呈負相關(P<0.05),提示IGFBP-6、TGF-β1水平可能共同參與疾病發展,但二者之間相關作用的機制有待進一步研究。
綜上所述,AMI患者血清IGFBP-6水平呈高表達,TGF-β1水平呈低表達,二者表達水平與患者冠狀動脈病變程度有關,同時其還能作為患者預后評估的參考指標。

