褪黑素受體MT1和MT2在綿羊胃中的分布及表達
李衛東,蔣玉婷,段宏偉,何海軍,楊 帥,丁自強,吳建新,張恩秋,胡俊杰
(1.甘肅農業大學動物醫學院,蘭州 730070;2.四川省廣安市前鋒區桂興鎮畜牧獸醫站,廣安 638500;3.定西市畜牧技術推廣站,定西 743000)
褪黑素(melatonin,MT)是主要由松果體合成和分泌的一種吲哚類激素,對機體的生理功能具有廣泛的調控作用[1-2],如抗氧化[3]、抗炎[4]、抗癌[5]、免疫調節[6]和生殖生理功能調節等[2]。在哺乳動物體內,褪黑素的多種調節作用是通過其高親和力G蛋白耦聯膜受體介導的,即MT1和MT2,且不同受體介導所發揮的調控機制可能不同[7]。目前,在人及大鼠等動物胃中研究發現,褪黑素具有影響胃動力、抑制胃酸和胃蛋白分泌、清除氧自由基、保護胃黏膜等多種功能[8-9]。而綿羊作為反芻動物,其消化系統極為復雜,各胃室功能差異較大[10],在前期研究中已證實綿羊胃組織具有合成褪黑素的能力[11],但其特異性膜受體MT1和MT2在綿羊胃組織中的表達規律尚待揭示。
基于褪黑素與胃組織特異性受體耦合發揮調控胃動力的機制,研究褪黑素激素受體在體內的分布及生物學特性對于闡明褪黑素的作用機制十分重要。本研究運用ELISA、實時熒光定量PCR、免疫組化(immunohistochemistry,IHC)和Western blotting等分子生物學方法,從基因和蛋白水平探明褪黑素膜受體MT1和MT2在綿羊各胃中的定位和定量變化規律,以期為進一步研究褪黑素對綿羊等反芻動物不同胃功能的調控機制提供理論依據。
1 材料與方法
1.1 材料
1.1.1 樣品 樣品采自蘭州市某屠宰場6只10~15月齡健康綿羊的全胃組織,液氮保存立即運回實驗室,依次分離瘤胃、網胃、瓣胃和皺胃4個胃室,再將瘤胃依據組織形態分離背囊和腹囊組織。部分樣品用4%多聚甲醛溶液固定用于免疫組化檢測,其余樣品于-80 ℃保存備用。
1.1.2 主要試劑及儀器 兔抗MT1抗體購自PLIabs公司;兔抗MT2抗體購自Abcam公司;SP-0024 HistostainTM-Plus Kits免疫組化染色試劑盒和辣根過氧化物酶(HRP)標記的羊抗兔IgG(H+L)均購自北京博奧森生物技術有限公司;DAB顯色液和陽離子防脫玻片均購自北京中杉金橋生物技術有限公司;高效RIPA組織/細胞快速裂解液、TRIquick Reagent、PMSF和BCA蛋白濃度測定試劑盒均購自北京索萊寶科技有限公司;Go ScriptTMReverse Transcription System反轉錄試劑盒購自Promega公司;Trans Start Green qPCR Super Mix試劑盒購自北京全式金生物技術有限公司;綿羊褪黑素ELISA試劑盒購自上海穎心實驗室。
移液槍購自Eppendorf公司;超低溫冰箱、4 ℃離心機和ND2000紫外分光光度計均購自Thermo Fisher公司;實時熒光定量PCR儀購自Roche公司;垂直電泳槽、轉膜槽均購自Bio-Rad公司;超微量核酸蛋白測定儀購自Pultton公司;SpectraMax i3x多功能酶標儀購自Molecular Device公司;正置顯微鏡購自Olympus公司。
1.2 方法
1.2.1 ELISA方法測定綿羊不同胃室組織中褪黑素含量 參照綿羊褪黑素ELISA試劑盒說明書,將樣品置于預冷的含有50 mmol/L EDTANa2(pH 7.4)的PBS中,以9倍樣品重量的體積進行勻漿處理,超聲波破碎后4 ℃、3 000×g離心15 min,提取上清液并于-80 ℃保存。將瘤胃背囊、瘤胃腹囊、網胃、瓣胃、皺胃組織上清液加入包被好的96孔板中,設置標準品孔和樣本孔,標準品孔加入已知濃度的標準液(S0-S5)50 μL。空白孔不加,樣本孔加上清液10 μL,再加入Sample稀釋液40 μL,除空白孔外,標準品孔和樣本孔中加入 HRP標記的羊抗兔IgG 100 μL,于37 ℃溫育60 min;棄去液體,拍干孔內液體后每孔加入洗滌液1 mL,震蕩洗滌1 min,拍干,重復洗滌5次或以上。顯色:除對照孔外其他每孔加入底物A、B各50 μL,置于37 ℃避光溫育15 min。每孔加入終止液50 μL,在15 min內使用酶標儀于450 nm波長處測定各孔的D值。
1.2.2 實時熒光定量PCR檢測綿羊不同胃室組織中褪黑素膜受體mRNA的表達差異 將試驗樣品在液氮中快速研磨至粉狀,分別稱取500 g,加入1 mL Trizol裂解液提取總RNA,紫外分光光度計測定RNAD260 nm/D280 nm值及濃度。運用Go ScriptTMReverse Transcription System反轉錄試劑盒將提取的總RNA反轉錄為cDNA后于-20 ℃保存備用。
根據GenBank中公布的綿羊MT1和MT2受體mRNA序列,選用β-actin作為內參基因,用Primer Premier 5.0軟件設計MT1、MT2和β-actin的引物(表1)。使用Trans Start Top Green qPCR Super Mix試劑盒進行實時熒光定量PCR擴增,設置3個重復組。PCR反應體系20 μL:Trans Start Green qPCR Super Mix 10 μL,cDNA 1 μL,上、下游引物(10 μmol/L)各0.8 μL, ddH2O補至20 μL。PCR反應程序:95 ℃預變性3 min;95 ℃變性10 s,60 ℃退火10 s,72 ℃延伸2 min,共40個循環。
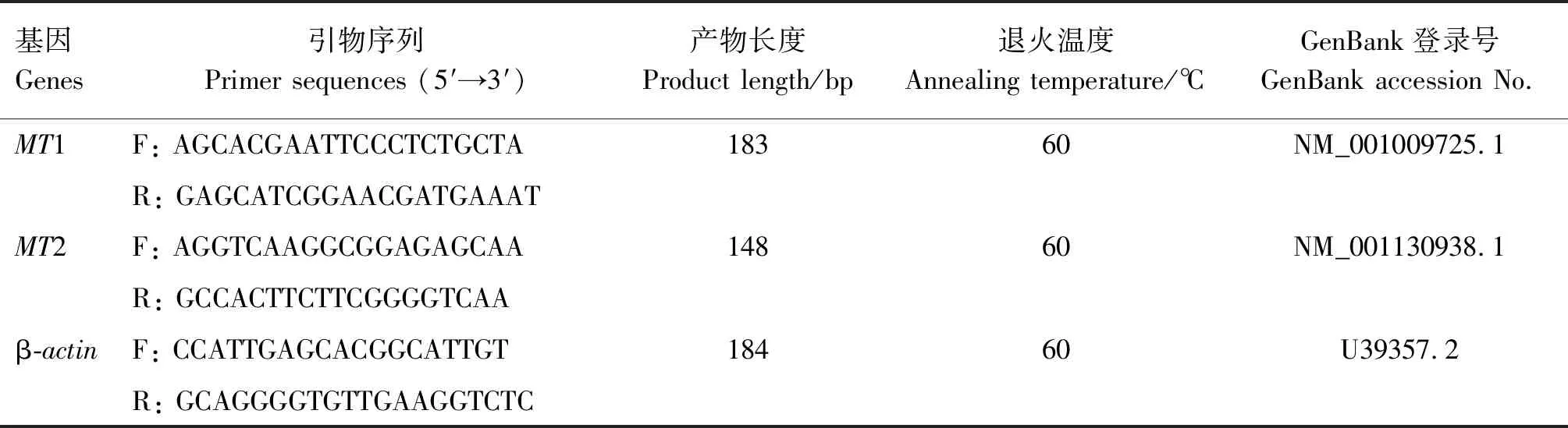
表1 引物信息
1.2.3 免疫組化檢測綿羊不同胃室組織中褪黑素膜受體分布 將不同胃室組織切片于60 ℃烘箱內烘烤4 h,經脫蠟和檸檬酸鈉煮沸抗原修復,按SP法免疫組化染色試劑盒說明書染色,一抗MT1(1∶400)和MT2(1∶400)4 ℃孵育過夜。二抗HRP標記鏈霉卵白素37 ℃孵育20 min后,DAB顯色,蘇木精復染2 min,用PBS漂洗,中性樹膠封片,干燥后,在顯微鏡下觀察、拍照。陰性對照一抗用PBS代替,其余步驟一致。
1.2.4 Western blotting檢測綿羊不同胃室組織中褪黑素膜受體蛋白的表達差異 在液氮中將試驗樣品快速研磨至粉狀,分別稱取500 g,加入1 mL RIPA裂解液和10 μL PMSF(1 mmol/L)提取總蛋白,BCA法測定蛋白濃度,取蛋白裂解液75 μL加入25 μL 4×Loading buffer,98 ℃變性10 min,進行SDS-PAGE,轉至PVDF膜上,5%脫脂奶粉封閉1 h,一抗MT1(1∶1 000)、MT2(1∶1 000)、β-actin(1∶3 000)4 ℃孵育過夜,PBST清洗5次,加入ECL發光液檢測蛋白條帶。
1.3 數據統計分析
用Excel對試驗數據進行整理匯總,然后運用SPSS 17.0軟件對褪黑素含量及MT1和MT2基因和蛋白的相對表達量進行單因素方差分析和鄧肯氏多重比較,P<0.05表示差異顯著。
2 結 果
2.1 綿羊不同胃室組織中褪黑素含量測定結果
ELISA檢測結果顯示,在綿羊瘤胃背囊、瘤胃腹囊、網胃、瓣胃和皺胃中均檢測到了褪黑素,依次為0.69、0.66、0.52、1.10和1.55 pg/mL,皺胃中含量最高,顯著高于其他胃室(P<0.05),瓣胃中含量顯著高于瘤胃背囊、瘤胃腹囊和網胃(P<0.05)(圖1)。
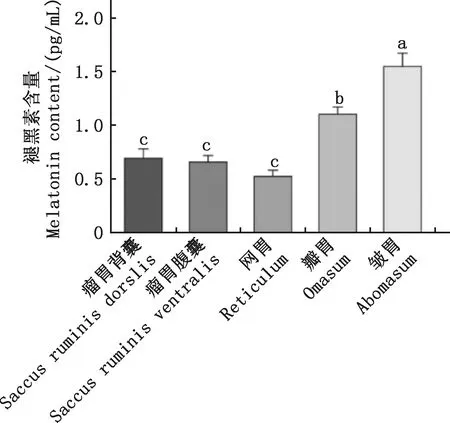
肩標不同字母表示差異顯著(P<0.05);肩標相同字母表示差異不顯著(P>0.05)。下同Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05). The same as below圖1 綿羊不同胃室組織中褪黑素的含量Fig.1 Content of melatonin in different stomachs of sheep
2.2 綿羊不同胃室組織中褪黑素膜受體mRNA的表達
由圖2可知,在綿羊的各胃室組織中均檢測到褪黑素受體MT1和MT2 基因mRNA。皺胃中MT1和MT2基因mRNA表達量最高,顯著高于其他胃室(P<0.05);其次是瘤胃腹囊,顯著高于瘤胃背囊、網胃和瓣胃(P<0.05),瘤胃背囊的表達量最低,而MT1基因mRNA在瓣胃中的表達量顯著高于瘤胃背囊和網胃(P<0.05),MT2基因mRNA在瓣胃中的表達量顯著高于瘤胃背囊(P<0.05)。
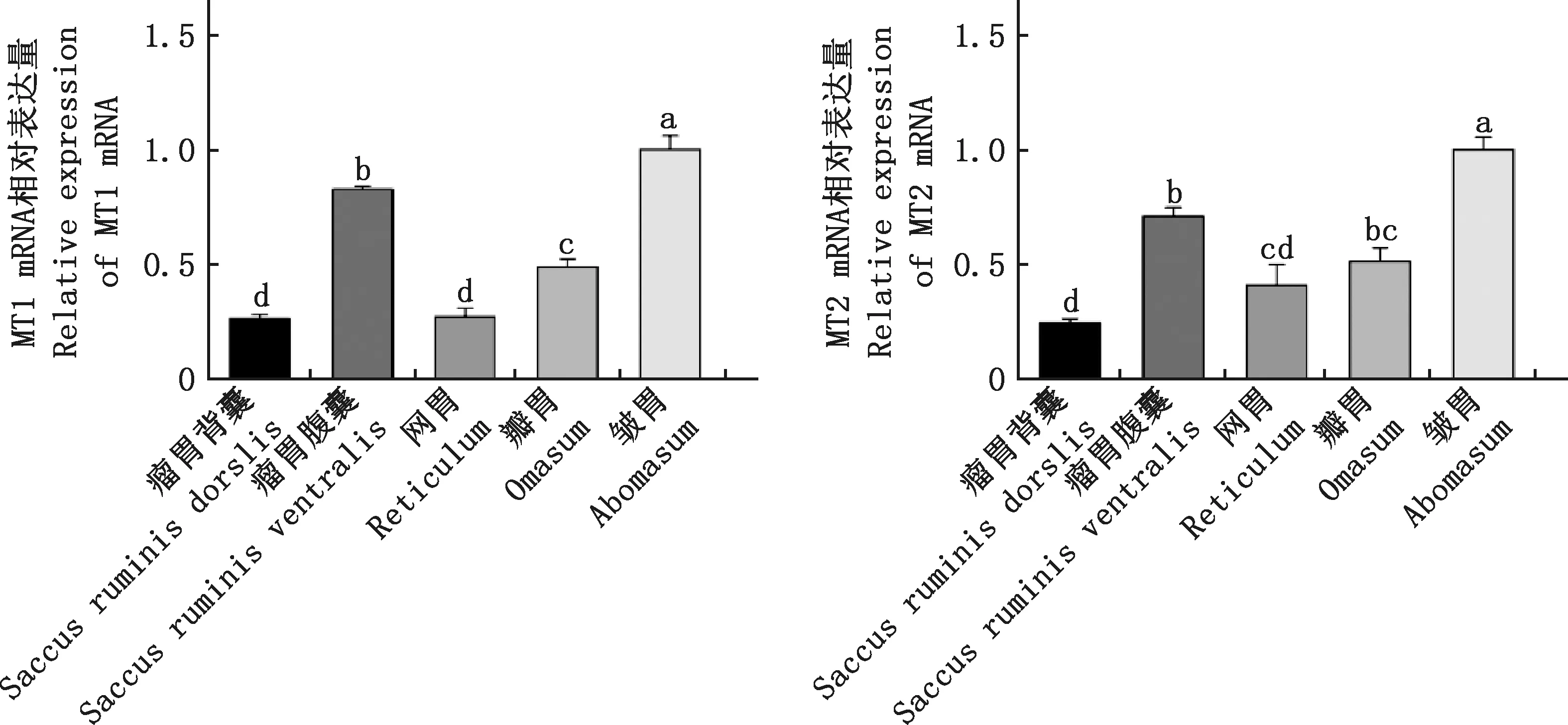
圖2 綿羊不同胃室組織中MT1和MT2基因mRNA的相對表達量Fig.2 Relative expression of MT1 and MT2 gene mRNA in different stomachs of sheep
2.3 綿羊不同胃室組織中褪黑素膜受體分布
由圖3可知,MT1和MT2分布在綿羊不同胃中的整個黏膜層(瘤胃背囊和瘤胃腹囊的結果一致),瘤胃、網胃和瓣胃均為無腺部,在黏膜上皮基底層陽性表達最強;皺胃為有腺部,主要分布在黏膜層,在黏膜上皮陽性表達最強,在固有層胃底腺體中的分布呈由底部到頸部呈逐漸增多的趨勢。
2.4 綿羊不同胃室組織中褪黑素膜受體蛋白的表達
由圖4可知,在綿羊不同胃室組織中均檢測到MT1和MT2蛋白的表達,且MT1和MT2在網胃中的表達量顯著高于瘤胃背囊、瘤胃腹囊和皺胃(P<0.05)。MT1蛋白在瓣胃中的表達量顯著高于瘤胃背囊和皺胃(P<0.05),MT2蛋白在在瓣胃中的表達量顯著高于瘤胃腹囊和皺胃(P<0.05)。
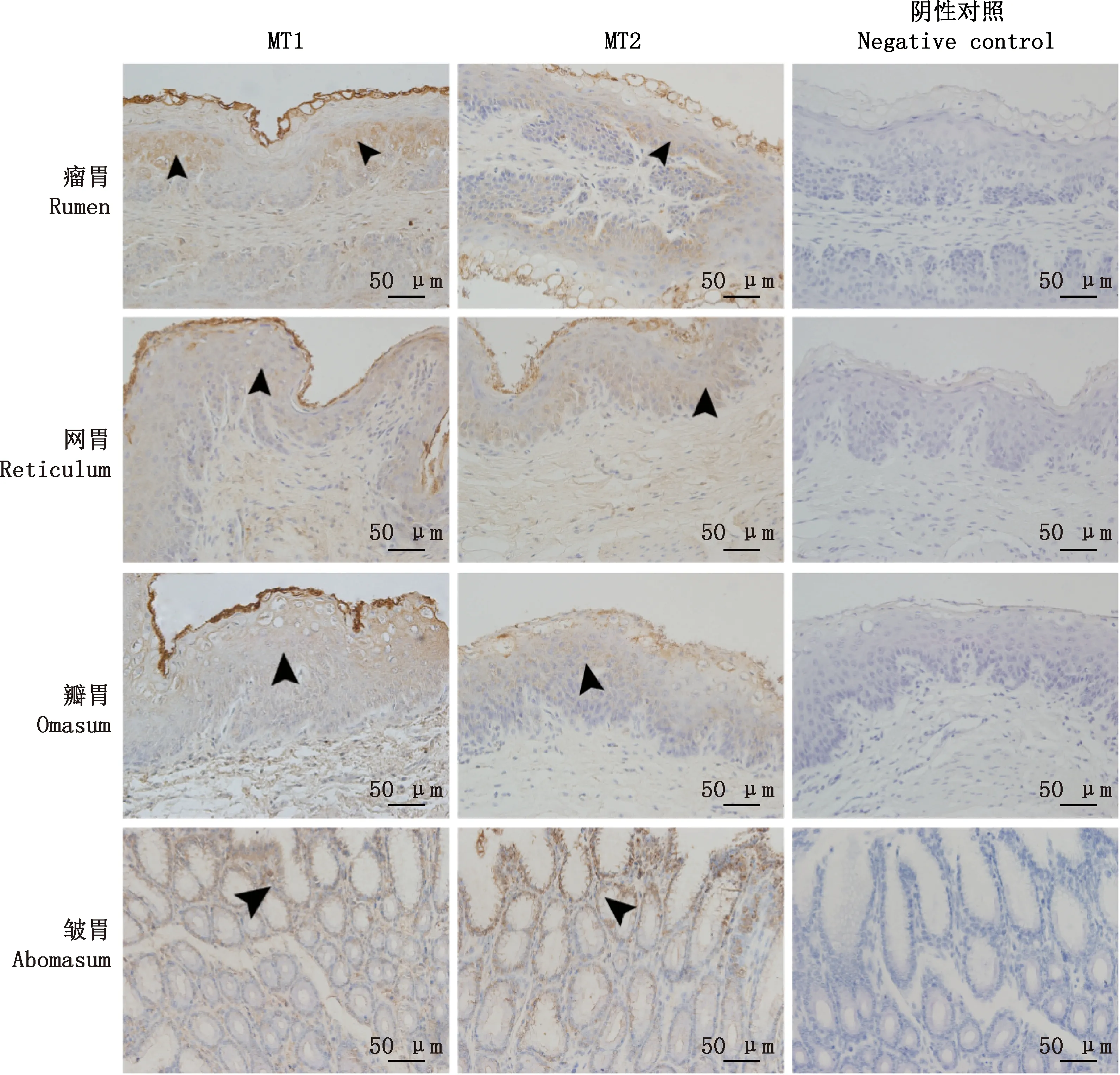
箭頭表示蛋白呈陽性表達Arrows indicate positive expression of the protein圖3 綿羊不同胃室組織中MT1和MT2蛋白的免疫組化檢測結果(400×)Fig.3 Immunohistochemistry detection result of MT1 and MT2 in different stomachs of sheep (400×)
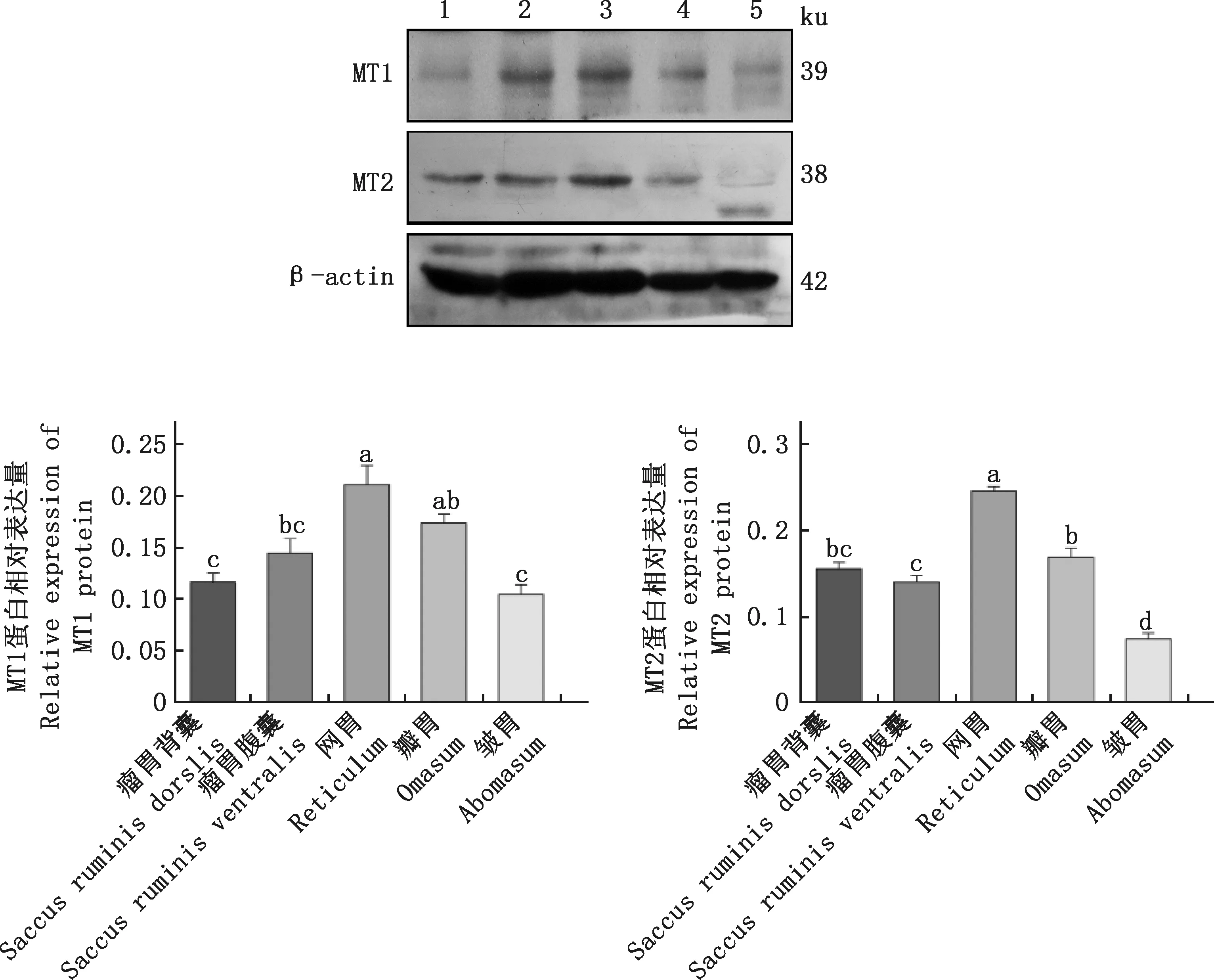
1~5,分別為瘤胃背囊、瘤胃腹囊、網胃、瓣胃和皺胃1-5,Saccus ruminis dorslis, saccus ruminis ventralis, reticulum, omasum and abomasum, respectively圖4 綿羊不同胃室組織中MT1和MT2蛋白的表達量Fig.4 Expression of MT1 and MT2 proteins in different stomachs of sheep
3 討 論
本試驗通過ELISA分析發現綿羊不同胃室組織中褪黑素含量差異較大,其中在皺胃組織中褪黑素含量最高,在瘤胃背囊、瘤胃腹囊和網胃中含量較低。Bubenik等[12-13]在奶牛和豬胃腸道組織中也檢測到褪黑素,且還發現褪黑素在奶牛的消化道前段含量較高,而豬的消化道后端含量較高。這些差異可能是由于不同動物的飲食習慣和胃室結構差異所致。此外,基于前期在綿羊胃組織中褪黑素關鍵合成酶5-羥色胺-N-2酰基轉移酶(AANAT)和羥基吲哚-氧-甲基轉移酶(HIOMT)的表達分析發現,AANAT和HIOMT表達量的變化趨勢與本試驗檢測到的褪黑素表達模式趨同[11]。這提示,綿羊各胃室至少能以自分泌的方式合成并釋放褪黑素。
褪黑素可通過抗氧化[14]、抗凋亡[14]、控制胃黏膜血流量[15]及防止胃缺血再灌注損傷[16]等方式保護胃黏膜,褪黑素對胃黏膜的保護和調控機制可能是通過與受體耦聯結合后發揮作用。本研究發現,褪黑素受體MT1和MT2主要分布于黏膜層,表明各胃的黏膜層均存在褪黑素作用靶點。研究顯示,黏液-碳酸氫鹽屏障是保護胃免受過量胃鹽酸侵襲的主要結構[17],而褪黑素可通過迷走神經和交感神經介導刺激胃黏膜層分泌碳酸氫鹽達到保護胃黏膜的作用[18]。結合本試驗結果推測,褪黑素可能主要是通過結合受體MT1和MT2介導參與分泌碳酸氫鹽的生理過程。此外,本研究還發現MT1和MT2蛋白在固有層呈現從底部到頸部陽性表達逐漸增強的現象。Taslidere等[19]研究顯示,在胃黏膜層中存在pH梯度,從胃腔到胃壁pH逐漸遞增,胃黏膜中H+主要通過HCO3-中和,因此胃黏膜中HCO3-分泌由底部到頸部也是逐漸增多的階梯式分布,這提示在綿羊皺胃壁褪黑素可能具有刺激黏膜層分泌碳酸氫鹽中和胃酸保護自身的作用。此外,褪黑素還可通過調節上皮細胞通透性防止有害物質滲透以及促進黏膜上皮細胞的生長方式保護胃黏膜[20]。褪黑素受體MT1和MT2在黏膜上的強陽性表達特點與碳酸氫鹽分泌趨勢一致,進一步驗證了褪黑素主要通過MT1和MT2對碳酸氫鹽分泌發揮調節作用。
作為多胃室動物,綿羊各胃室功能差異很大。本試驗檢測到綿羊各胃中褪黑素受體MT1和MT2基因和蛋白的表達存在差異,MT1和MT2蛋白在網胃中表達量最高,在皺胃中表達量最低,而MT1和MT2基因在皺胃中的表達量最高,在瘤胃背囊和網胃的表達量最低,這種差異表達可能是在轉錄翻譯空間上存在差異[21],或與褪黑素在不同胃室組織功能發揮作用的對應受體不同有關。Katarina等[22]研究發現,在小鼠胃腸道中,MT1蛋白在十二指腸高表達,而MT2蛋白則主要分布于結腸。結合本試驗結果,提示褪黑素對綿羊各胃的調控存在較大差異。Western blotting檢測發現MT1和MT2在網胃的表達量最大,可能通過膜受體介導的功能部位主要在網胃。綿羊前胃黏膜層無腺體,不能分泌胃液,主要通過微生物消化和前胃的運動進行機械研磨的消化。而皺胃黏膜層有腺體,主要依賴黏膜層分泌胃液進行消化,本試驗結果發現MT1和MT2蛋白在前胃中的表達量均高于皺胃,表明褪黑素受體MT1和MT2可能主要介導參與褪黑素對胃動力的調控。在前胃的運動過程中,始發于胃內容物刺激網胃發生雙向收縮,網胃將食糜壓向瘤胃。此外,當食物刺激口腔感受器,或食糜的性狀刺激網胃感受器均可引起動物機體發生逆嘔和反芻[17]。推測網胃與瘤胃的協同作用共同促進食糜的往復,佐證了受體在這兩部分表達量相似的試驗結果,而MT1和MT2在綿羊網胃中的高表達規律說明褪黑素通過MT1和MT2介導對胃腸運動的調控可能在前胃胃動力調節中起重要作用,其確切的調節作用機制需進一步研究。
4 結 論
褪黑素在綿羊各胃組織中差異化表達從而發揮多樣性生理功能,其還可能通過與胃組織上特異性受體MT1和MT2結合,通過信號傳導系統而調控前胃受食糜刺激后發生反芻生理過程。本研究結果為闡明褪黑素參與綿羊消化系統的調控機制奠定了理論基礎。

