豬輪狀病毒江西株AY01的分離鑒定
劉小蘭,劉昌錦,余文洋,李瀟翔,邊彥超,黃校花,羅 鋒,鄧舜洲
(1.江西農(nóng)業(yè)大學(xué)動(dòng)物科學(xué)技術(shù)學(xué)院,南昌 330045;2.江西金伊博生物科技有限公司,南昌 330013)
豬輪狀病毒(Porcine rotavirus,PoRV)是導(dǎo)致哺乳仔豬和斷奶仔豬腹瀉的常見(jiàn)病原之一,屬呼腸孤病毒科輪狀病毒屬成員[1]。感染PoRV后,發(fā)病豬主要表現(xiàn)厭食、嘔吐、水樣腹瀉等特征,PoRV在世界范圍的流行非常普遍,各種年齡、性別的豬均可感染,主要危害1~4周齡仔豬,尤其1~10日齡仔豬感染后發(fā)病率可超過(guò)80%,死亡率為50%~100%[2-3],成年豬多為隱性感染,該病潛伏期短、傳染性強(qiáng)、流行范圍廣,給養(yǎng)豬業(yè)造成巨大的經(jīng)濟(jì)損失。
PoRV為無(wú)囊膜正鏈 RNA 病毒,具有二十面體立體對(duì)稱的雙層衣殼,直徑在65~75 nm之間,在電鏡下,可觀察到形似“車輪狀”的病毒粒子[4]。病毒核酸由11個(gè)雙股RNA基因片段組成,每一基因片段各編碼一種蛋白,其中VP1~VP4、VP6、VP7為結(jié)構(gòu)蛋白,NSP1~NSP6為非結(jié)構(gòu)蛋白[5]。VP6是數(shù)量最多的結(jié)構(gòu)蛋白,是病毒的群抗原,根據(jù)VP6可將輪狀病毒分為10個(gè)基因群(A~J),其中A群輪狀病毒(RVA)是最典型的輪狀病毒。輪狀病毒的基因型主要根據(jù)病毒表面的VP4和VP7蛋白分型,分別為P、G血清型,目前在人和動(dòng)物的RVA中發(fā)現(xiàn)35個(gè)P血清型和27個(gè)G血清型[6]。
1969年輪狀病毒在犢牛中首次被報(bào)道[7],隨后1975年Rodger等[8]在豬糞便中分離到PoRV,中國(guó)于1982年由龐其方等[9]在腹瀉仔豬糞便中分離出該病毒,隨后陸續(xù)有學(xué)者在馬、羊、雞等多種動(dòng)物的腹瀉糞便中發(fā)現(xiàn)輪狀病毒。PoRV在全球范圍內(nèi)廣泛分布,以豬RVA最為常見(jiàn),其復(fù)雜的流行病學(xué)、遺傳多樣性被廣泛研究,在豬群中的患病率在3.3%~67.3%之間,豬場(chǎng)陽(yáng)性感染率為61%~74%[10-11],此病毒的感染傳播高發(fā)季為早春、冬季和晚秋這些溫度較低時(shí)節(jié)[12]。PoRV常與多種豬源性傳染病混合感染仔豬,導(dǎo)致PoRV的流行很復(fù)雜。本試驗(yàn)從疑似PoRV感染的豬場(chǎng)采集病料,對(duì)此病毒的分離培養(yǎng)條件進(jìn)行探究,利用MA104細(xì)胞分離獲得1株P(guān)oRV,觀察該分離株人工感染新生仔豬后的臨床表現(xiàn)和剖檢病理學(xué)變化,以期為PoRV的流行情況提供理論參考。
1 材料與方法
1.1 材料
1.1.1 病料、細(xì)胞系和試驗(yàn)動(dòng)物 病料為江西南昌某規(guī)模化豬場(chǎng)腹瀉仔豬的小腸樣品,-80 ℃保存?zhèn)溆茫籑A104細(xì)胞(CRL-2378.1)、Vero細(xì)胞(CCL-81)、PK15細(xì)胞(CCL-33)、MARC-145細(xì)胞(CRL-12231)、McCoy細(xì)胞(CRL-1696)、ST細(xì)胞(CRL-1746)、IEC-18細(xì)胞(CRL-1589)、IPEC-J2細(xì)胞均由江西農(nóng)業(yè)大學(xué)預(yù)防獸醫(yī)室保存;1日齡未吃初乳初生仔豬購(gòu)自江西省某規(guī)模化豬場(chǎng)。
1.1.2 主要試劑 高糖DMEM細(xì)胞培養(yǎng)液、胎牛血清(Gibco公司);反轉(zhuǎn)錄酶M-MLV、RRI試劑(TaKaRa公司);胰酶、羊抗鼠FITC-IgG抗體(Solarbio公司);鼠抗輪狀病毒VP6蛋白高免血清(效價(jià)1∶5.12×105至1∶10.24×105)由江西農(nóng)業(yè)大學(xué)預(yù)防獸醫(yī)教室制備保存;一步法反轉(zhuǎn)錄實(shí)時(shí)熒光定量檢測(cè)試劑盒(GenStar公司)。
1.2 病料處理
取小腸組織用無(wú)菌勻漿器勻漿后,按比例制成1∶10的DMEM懸液,反復(fù)凍融3次,4 ℃、12 000 r/min離心15 min,用0.22 μm細(xì)菌濾器過(guò)濾上清液,-80 ℃保存?zhèn)溆谩?/p>
1.3 引物設(shè)計(jì)與合成
參考GenBank中收錄的輪狀病毒VP4基因序列(登錄號(hào):KC113250.1)設(shè)計(jì)1對(duì)VP4基因全長(zhǎng)的測(cè)序引物;參考GenBank上收錄的A型輪狀病毒的VP7基因序列(登錄號(hào):MT025938.1)設(shè)計(jì)2對(duì)引物,分別作為檢測(cè)引物和VP7基因全長(zhǎng)的測(cè)序引物;參考CV777毒株的ORF1基因序列(登錄號(hào):LT906581.1)設(shè)計(jì)豬流行性腹瀉病毒(Porcine epidemic diarrhea virus,PEDV)的檢測(cè)引物;參考HE-1毒株的N基因序列(登錄號(hào):KX083668.1)設(shè)計(jì)豬傳染性胃腸炎病毒(Transmissible gastroenteritis virus,TGEV)的檢測(cè)引物,引物序列見(jiàn)表1。引物均由南京金斯瑞生物科技有限公司合成。
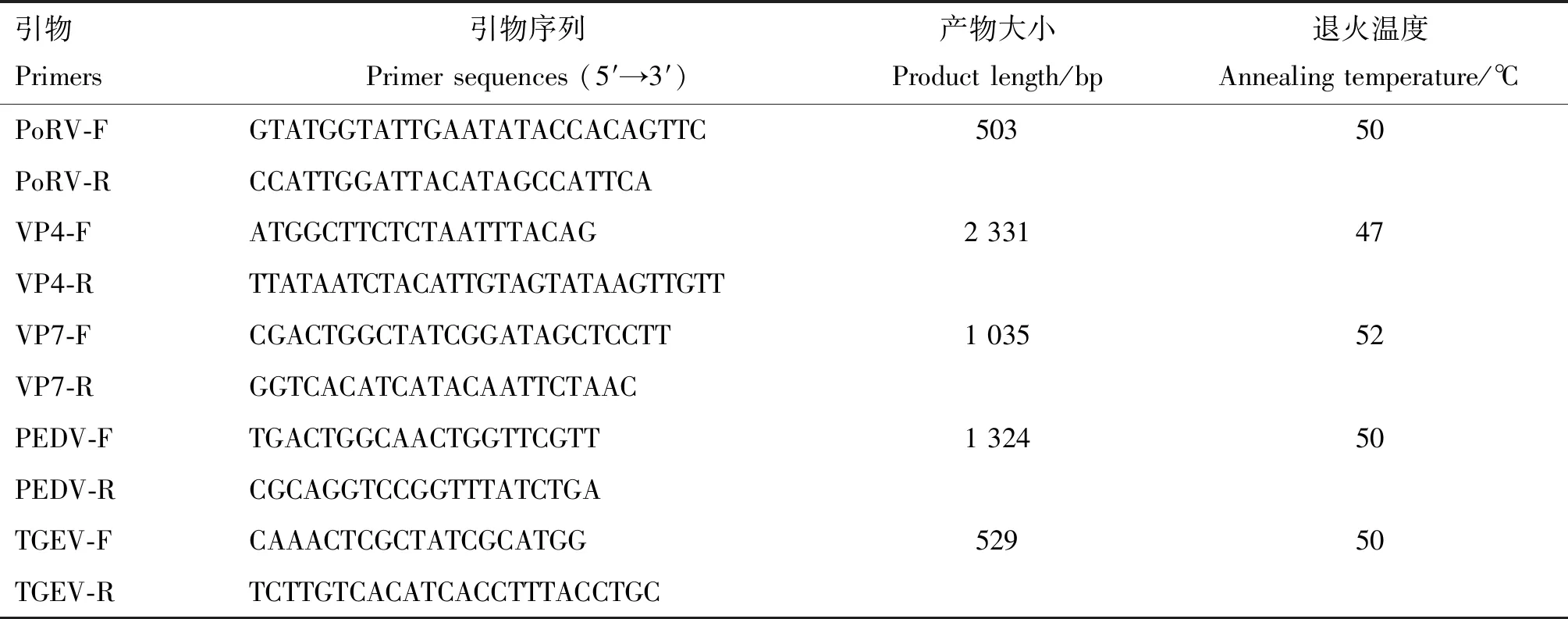
表1 引物信息
1.4 RT-PCR擴(kuò)增
采用TRIzol法提取病毒總RNA,按照反轉(zhuǎn)錄試劑盒說(shuō)明書(shū)將RNA反轉(zhuǎn)錄為cDNA,以其為模板進(jìn)行PCR擴(kuò)增。PCR反應(yīng)體系50 μL:cDNA模板2 μL,HiFi Buffer 5 μL,dNTPs 4 μL,HiFi酶0.5 μL,上、下游引物(20 μmol/L)各0.5 μL,ddH2O 37.5 μL。PCR反應(yīng)程序:94 ℃預(yù)變性5 min;94 ℃變性30 s,50 ℃退火30 s,72 ℃延伸1 min,共37個(gè)循環(huán);72 ℃延伸8 min。PCR產(chǎn)物經(jīng)1.0%瓊脂糖凝膠電泳進(jìn)行鑒定。
1.5 病毒分離培養(yǎng)
在病毒濾液中加入終濃度為15 μg/mL的胰酶,37 ℃處理1.5 h。取出匯合度約90%的MA104細(xì)胞,棄去培養(yǎng)液,并用無(wú)血清的DMEM洗3遍,將處理好的樣品接種于細(xì)胞,37 ℃吸附2 h,加入含終濃度為7.5 μg/mL胰酶的DMEM維持液,繼續(xù)培養(yǎng)48 h后收集病毒液,反復(fù)凍融3次,即為第1代P1分離株,收集培養(yǎng)液進(jìn)行下一代在MA104細(xì)胞上盲傳,直至產(chǎn)生細(xì)胞病變,同時(shí)收集每代的細(xì)胞培養(yǎng)物進(jìn)行RT-PCR擴(kuò)增鑒定。
1.6 病毒鑒定
1.6.1 病毒VP4、VP7基因RT-PCR鑒定 提取分離毒株的第5(P5)和第10代(P10)細(xì)胞培養(yǎng)物的RNA,將其反轉(zhuǎn)錄為cDNA,以此為模板,分別用VP4、VP7基因特異性引物進(jìn)行PCR擴(kuò)增,擴(kuò)增產(chǎn)物進(jìn)行1.0%瓊脂糖凝膠電泳檢測(cè),并將產(chǎn)物送至湖南擎科生物技術(shù)有限公司測(cè)序。將測(cè)序結(jié)果在NCBI上進(jìn)行BLAST比對(duì)分析,從GenBank中查找到PoRVVP4和VP7各型的參考毒株,利用Mega 7.0軟件構(gòu)建VP4、VP7基因的系統(tǒng)進(jìn)化樹(shù),確定分離株的基因型。
1.6.2 病毒間接免疫熒光試驗(yàn)鑒定 將MA104細(xì)胞接種于96孔細(xì)胞培養(yǎng)板,細(xì)胞長(zhǎng)成單層后接種病毒液,37 ℃培養(yǎng)48 h后棄上清,預(yù)冷甲醇固定,以鼠抗VP6蛋白多克隆抗體(1∶2 000)為一抗、羊抗鼠FITC-IgG(1∶500)為二抗對(duì)病毒進(jìn)行染色檢測(cè),于倒置熒光顯微鏡下觀察檢測(cè)結(jié)果。
1.6.3 病毒電鏡觀察 收集分離株細(xì)胞培養(yǎng)物,病毒液反復(fù)凍融3次,12 000 r/min離心10 min,離心上清經(jīng)蔗糖濃縮后透析,過(guò)0.22 μm細(xì)菌濾器,收集濾液經(jīng)磷鎢酸負(fù)染后用日立HT7700透射電鏡觀察病毒形態(tài)。
1.7 病毒部分生物學(xué)特性檢測(cè)
1.7.1 病毒增殖曲線繪制 取出匯合度約90% MA104細(xì)胞,用無(wú)血清培養(yǎng)液洗3次,以感染復(fù)數(shù)(MOI)為0.05的病毒量感染,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)2 h后,棄病毒液,每孔補(bǔ)加含5 μg/mL胰酶的無(wú)血清DMEM維持液,每隔4 h刮取細(xì)胞,收集病毒液。將各時(shí)間點(diǎn)收集的病毒液分別按照10倍倍比稀釋,從10-1稀釋至10-8,接種于已鋪滿MA104細(xì)胞的96孔細(xì)胞培養(yǎng)板,并設(shè)正常細(xì)胞作為對(duì)照,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)2 d后。利用間接免疫熒光試驗(yàn)進(jìn)行熒光染色觀察,按照Reed-Muench法計(jì)算各時(shí)間點(diǎn)的50%組織細(xì)胞感染量(TCID50),并以時(shí)間為橫坐標(biāo)、各時(shí)間點(diǎn)的TCID50為縱坐標(biāo),繪制病毒的增殖曲線。
1.7.2 分離毒株對(duì)不同細(xì)胞的易感性 將MA104、Vero、IPEC-J2、PK15、MARC-145、McCoy、ST、IEC-18細(xì)胞分別接種于96孔細(xì)胞培養(yǎng)板中培養(yǎng),待細(xì)胞鋪滿培養(yǎng)板后,用無(wú)血清的DMEM培養(yǎng)液洗3次,以MOI為0.05的病毒量感染分離毒株,置于37 ℃、5% CO2培養(yǎng)箱中吸附2 h,棄病毒液,每孔補(bǔ)加含5 μg/mL胰酶的無(wú)血清DMEM維持液,同時(shí)設(shè)置相應(yīng)的正常細(xì)胞作為對(duì)照,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)2 d后棄培養(yǎng)液,固定,進(jìn)行間接免疫熒光檢測(cè)。
1.8 動(dòng)物回歸試驗(yàn)
將4頭1日齡未吃初乳的新生仔豬隨機(jī)分組,其中試驗(yàn)組3頭,對(duì)照組1頭,試驗(yàn)組仔豬經(jīng)人工口服分離株第20代細(xì)胞培養(yǎng)液,1 mL/頭(病毒含量106.0TCID50/mL),對(duì)照組仔豬口服等體積DMEM。每隔2 h飼喂仔豬專用豬奶粉,每隔4 h采集糞便拭子,并記錄試驗(yàn)仔豬的食欲及精神狀況,攻毒后48 h剖殺。參考許夢(mèng)怡等[13]建立的PEDV、TGEV、PoRV的多重?zé)晒舛縋CR檢測(cè)方法,應(yīng)用一步法反轉(zhuǎn)錄實(shí)時(shí)熒光定量檢測(cè)試劑盒檢測(cè)糞便排毒情況。上游引物:5′-CGCGGAGCTAAACGTGAAAA-3′;下游引物:5′-TTACTCTCCATAATTGCGTCTATGTTC-3′;探針:5-(ROX)-CCACAACAGAATGAACGTCTGC-AAGAAAAA-(BHQ2)-3′。PCR反應(yīng)體系20 μL:2×StarScript Ⅱ Probe One-Step qRT-PCR Buffer 10 μL,StarScript Ⅱ Probe One Step Enzyme Mix 2 μL,探針(10 μmol/L) 0.5 μL,上、下游引物(10 μmol/L)各0.5 μL,RNA模板 2 μL,DEPC水補(bǔ)至20 μL。PCR反應(yīng)程序:50 ℃ 15 min;94 ℃ 2 min;94 ℃ 15 s,60 ℃ 30 s,共40個(gè)循環(huán)。試驗(yàn)結(jié)束后,剖檢,收集仔豬小腸樣品,用4%多聚甲醛固定,用于HE病理切片染色和免疫組織化學(xué)檢測(cè)。
2 結(jié) 果
2.1 病料RT-PCR檢測(cè)
對(duì)處理好的病料樣品進(jìn)行RT-PCR,經(jīng)1.0%瓊脂糖凝膠電泳分析,結(jié)果表明PoRV-F/R引物擴(kuò)增產(chǎn)物電泳后可見(jiàn)約503 bp的擴(kuò)增條帶,與預(yù)期大小相符,而使用PEDV和TGEV特異性引物未擴(kuò)增出特異性條帶(圖1),表明該病料樣品含PoRV。

M,DL2000 DNA Marker;1、4、7,病料樣品;2,PoRV陽(yáng)性對(duì)照;5,PEDV陽(yáng)性對(duì)照;8,TGEV陽(yáng)性對(duì)照;3、6、9,陰性對(duì)照M,DL2000 DNA Marker;1,4 and 7,Sick material samples;2,PoRV positive control;5,PEDV positive control;8,TGEV positive control;3,6 and 9,Negative control圖1 樣品PoRV RT-PCR檢測(cè)結(jié)果Fig.1 RT-PCR detection results of samples for PoRV
2.2 病毒分離
病料濾液經(jīng)胰酶處理后接種MA104單層細(xì)胞,盲傳細(xì)胞第1~3代無(wú)明顯變化;第4~5代細(xì)胞在48 h脫落細(xì)胞增多;傳至第6代時(shí),16~24 h時(shí)產(chǎn)生明顯的細(xì)胞病變,具體表現(xiàn)為細(xì)胞變圓皺縮,出現(xiàn)拉網(wǎng)現(xiàn)象并逐漸脫落(圖2A),未感染的MA104細(xì)胞正常生長(zhǎng)(圖2B)。繼續(xù)傳代后,分離毒株逐漸適應(yīng)MA104細(xì)胞,將該毒株命名為PoRV AY01株。

A,AY01毒株感染的MA104細(xì)胞;B,正常MA104細(xì)胞A,MA104 cells infected with AY01 strain;B,Normal MA104 cells圖2 分離株感染MA104細(xì)胞時(shí)的細(xì)胞病變(100×)Fig.2 Cytopathic effect of the isolated strain on MA104 cells (100×)
2.3 分離株鑒定結(jié)果
2.3.1VP4和VP7基因檢測(cè)結(jié)果 提取分離株的P5和P10代細(xì)胞培養(yǎng)液進(jìn)行RT-PCR,RT-PCR產(chǎn)物經(jīng)1.0%瓊脂糖凝膠電泳的檢測(cè)結(jié)果見(jiàn)圖3、4。結(jié)果顯示在約2 331和1 035處出現(xiàn)目的條帶,分別與預(yù)期VP4、VP7基因片段大小相符。

M,DNA Marker Ⅳ,1,陽(yáng)性對(duì)照;2,P5代細(xì)胞培養(yǎng)物;3,P10代細(xì)胞培養(yǎng)M,DNA Marker Ⅳ; 1,Positive control; 2,P5 generation cell culture; 3,P10 generation cell culure圖3 AY01株VP4基因RT-PCR擴(kuò)增結(jié)果Fig.3 RT-PCR amplification result of VP4 gene of AY01 strain

M,DL2000 DNA Marker;1,陽(yáng)性對(duì)照;2,P5代細(xì)胞培養(yǎng)物;3,P10代細(xì)胞培養(yǎng)物M,DL2000 DNA Marker;1,Positive control;2,P5 cell culture;3,P10 cell culure圖4 AY01株VP7基因RT-PCR擴(kuò)增結(jié)果Fig.4 RT-PCR amplification result of VP7 gene of the AY01 strain
2.3.2 分離株基因型鑒定及基因進(jìn)化樹(shù)分析 對(duì)分離株VP4基因測(cè)序結(jié)果經(jīng)BLAST在線比對(duì),結(jié)果顯示,分離株與PoRV的VP4基因相似性達(dá)96.65%,確定分離株VP4基因?yàn)镻[23]型。系統(tǒng)進(jìn)化樹(shù)結(jié)果顯示,AY01株的VP4基因與四川的豬輪狀病毒SCYB-C3株(MT198752.1)的親緣關(guān)系最近(圖5)。分離株VP7基因測(cè)序結(jié)果經(jīng)BLAST在線比對(duì),結(jié)果顯示,分離株與PoRVVP7基因相似性達(dá)97.78%,確定分離株VP7基因?yàn)镚5型。系統(tǒng)進(jìn)化樹(shù)結(jié)果顯示,AY01株的VP7基因與黑龍江的豬輪狀病毒Zjh3-2株(JX498961.1)的親緣關(guān)系最近,同時(shí)與中國(guó)流行血清型G5型的代表毒株OSU在進(jìn)化關(guān)系上構(gòu)成一個(gè)分支(圖6)。因此分離毒株的基因型為G5P[23]型。

圖5 AY01株VP4基因核苷酸序列系統(tǒng)進(jìn)化樹(shù)Fig.5 Phylogenetic tree based on the nucleotide sequence of VP4 gene of AY01 strain

圖6 AY01株VP7基因核苷酸序列系統(tǒng)進(jìn)化樹(shù)Fig.6 Phylogenetic tree based on the nucleotide sequence of VP7 gene of AY01 strain
2.3.3 間接免疫熒光試驗(yàn)結(jié)果 將分離毒株的細(xì)胞培養(yǎng)液接種MA104細(xì)胞,以鼠抗VP6蛋白多克隆抗體為一抗、羊抗鼠FITC-IgG為二抗進(jìn)行間接免疫熒光試驗(yàn),結(jié)果顯示,感染病毒的孔內(nèi)細(xì)胞胞漿內(nèi)可見(jiàn)特異性綠色熒光(圖7A),正常MA104細(xì)胞孔內(nèi)未見(jiàn)熒光(圖7B)。

A,AY01毒株感染的MA104細(xì)胞;B,正常MA104細(xì)胞A,MA104 cells infected with AY01 strain;B,Normal MA104 cells圖7 PoRV AY01株感染MA104細(xì)胞間接免疫熒光試驗(yàn)檢測(cè)結(jié)果(100×)Fig.7 IFA test results of MA104 cells infected with PoRV AY01 strain (100×)
2.3.4 病毒電鏡觀察結(jié)果 PoRV AY01株細(xì)胞培養(yǎng)物經(jīng)超速離心純化,負(fù)染后進(jìn)行透射電鏡觀察,電鏡下可看到形態(tài)呈球形,具有明顯的雙層衣殼結(jié)構(gòu),似車輪狀的病毒顆粒,直徑大小為61~70 nm,平均大小65 nm(圖8)。

圖8 PoRV AY01株病毒粒子電鏡觀察 (20 000×)Fig.8 Electron micrograph of virus particle of PoRV AY01 strain (20 000×)
2.4 分離毒株的部分生物學(xué)特性檢測(cè)結(jié)果
2.4.1 分離毒株增殖曲線的繪制 由圖9可知,分離株AY01在接毒后8~12 h就可達(dá)到病毒滴度峰值,隨后進(jìn)入病毒增殖穩(wěn)定期(圖9)。
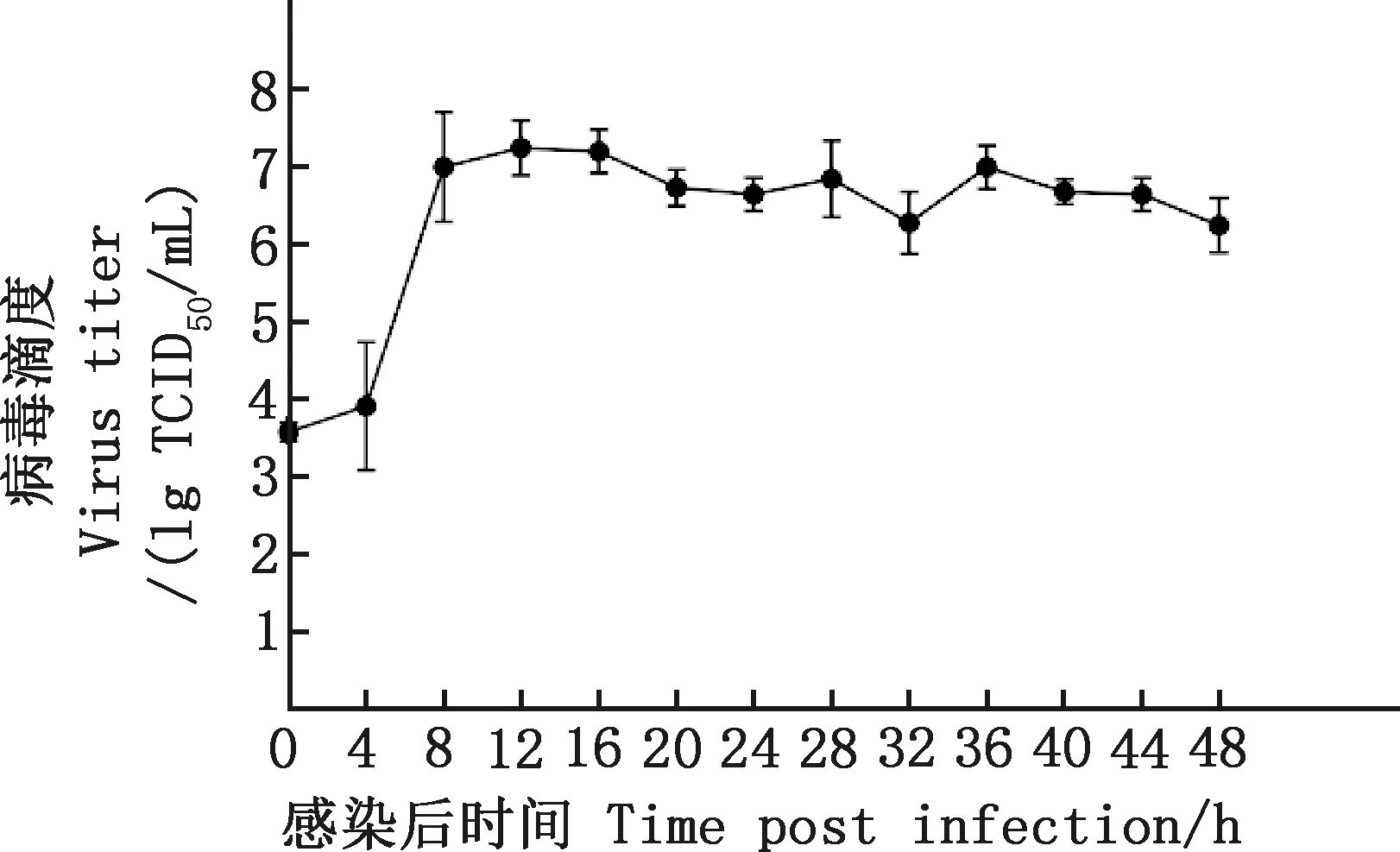
圖9 PoRV AY01株的增殖曲線Fig.9 Proliferation curve of PoRV AY01 strain
2.4.2 分離毒株對(duì)不同細(xì)胞的易感性 間接免疫熒光試驗(yàn)結(jié)果顯示,分離毒株對(duì)試驗(yàn)所用細(xì)胞有感染,可用免疫熒光方法檢測(cè)PoRV。在可見(jiàn)光下,分離株在MA104、Vero、IPEC-J2、PK15細(xì)胞中產(chǎn)生細(xì)胞病變,在ST、McCoy、IEC-18細(xì)胞中無(wú)細(xì)胞病變;經(jīng)免疫熒光檢測(cè),分離株在MA104、Vero細(xì)胞中可檢測(cè)到大面積的熒光,其中毒株在MA104細(xì)胞的胞漿內(nèi)可見(jiàn)特異性綠色熒光,在Vero細(xì)胞的細(xì)胞核中能檢測(cè)到特異性綠色熒光,在IPEC-J2、PK15細(xì)胞中的熒光較少,在ST、McCoy細(xì)胞中只有零星的熒光,在MARC-145、IEC-18細(xì)胞中無(wú)熒光(圖10)。綜上得出,分離毒株在所用細(xì)胞中的易感性排序?yàn)镸A104>Vero>IPEC-J2>PK15>ST>McCoy>MARC-145>IEC-18細(xì)胞,表明PoRV分離株在MA104細(xì)胞上的易感性最好。

圖10 分離毒株AY01對(duì)不同細(xì)胞的易感性(100×)Fig.10 Susceptibility of isolated strain AY01 to different cells (100×)
2.5 動(dòng)物回歸試驗(yàn)
2.5.1 臨床癥狀及剖檢變化 試驗(yàn)組3頭仔豬接種AY01株后,8~24 h時(shí)3頭豬排軟糞,24~48 h時(shí)均陸續(xù)由黃色軟糞轉(zhuǎn)為水樣腹瀉,具體表現(xiàn)為精神沉郁、嗜睡,飲食量嚴(yán)重下降,排黃色水樣稀糞便,并伴有腥臭味,48 h時(shí)剖檢攻毒組仔豬可見(jiàn)胃內(nèi)有未消化的凝乳,小腸腸壁變薄、出血,腸內(nèi)有黃色液體。試驗(yàn)期間,對(duì)照組仔豬未出現(xiàn)上述癥狀。表明分離毒株AY01株攻毒可致使仔豬持續(xù)排毒,并產(chǎn)生典型腹瀉癥狀。
2.5.2 PoRV感染后排毒檢測(cè) 試驗(yàn)期間每4 h收集2組仔豬肛門(mén)拭子,利用一步法實(shí)時(shí)熒光定量PCR方法監(jiān)測(cè)排毒情況,結(jié)果顯示,在24~48 h時(shí)Ct值變化明顯,36~44 h降到最低(圖11),此時(shí)仔豬臨床表現(xiàn)為飲食量下降,精神萎靡,腹瀉嚴(yán)重,排黃色水樣糞便。

圖11 仔豬接種PoRV AY01株后糞便排毒檢測(cè)Fig.11 Detection of fecal detoxification in piglets inoculated with PoRV AY01 strain
2.5.3 病理組織及免疫組化切片觀察 病理組織切片觀察結(jié)果顯示,試驗(yàn)組仔豬小腸絨毛呈彌漫性萎縮、絨毛減少,脫落(圖12A),對(duì)照組腸道結(jié)構(gòu)完整,未見(jiàn)壞死脫落(圖12C)。免疫組化檢測(cè)結(jié)果顯示,試驗(yàn)組仔豬腸絨毛及黏膜層處分散有褐色點(diǎn)狀物(圖12C),為PoRV陽(yáng)性;對(duì)照組仔豬腸道均正常(圖12D)。
3 討 論
PoRV在豬群中的感染非常普遍,在中國(guó)規(guī)模化豬場(chǎng)仔豬腹瀉糞便中的陽(yáng)性率為7.69%~28.76%[14-17],早期分離的PoRV很難適應(yīng)細(xì)胞,直到1984年Bohl等[18]首次用胰酶處理樣品,感染MA104細(xì)胞,開(kāi)啟了PoRV的體外分離培養(yǎng)進(jìn)程,Benureau[19]證實(shí)胰酶能結(jié)合輪狀病毒顆粒,溶解其外殼蛋白,從而增強(qiáng)病毒的感染能力。隨著現(xiàn)代生物科技的發(fā)展,對(duì)PoRV的分離培養(yǎng)技術(shù)逐漸成熟,目前的輪狀病毒體外培養(yǎng)是否成功主要由細(xì)胞種類、胰酶濃度以及糞液中病毒粒子的完整性等因素決定,其中胰酶在輪狀病毒增殖時(shí)有重要作用,時(shí)洪艷等[20]在處理病料時(shí)加入20 μg/mL胰酶消化,從MA104細(xì)胞上分離到1株P(guān)oRV。陳淑紅等[21]則使用30 μg/mL胰酶消化處理才從MA104細(xì)胞上分離到PoRV毒株。楊娟[22]僅加入0.1 μg/mL胰酶消化處理病料便從Vero細(xì)胞上分離到PoRV SWU-1C/2018株。本研究將病料濾液經(jīng)終濃度15 μg/mL胰酶預(yù)處理,在維持液中添加終濃度7.5 μg/mL胰酶為分離培養(yǎng)PoRV的條件,成功分離到1株P(guān)oRV,將該毒株命名為PoRV AY01株。AY01株在MA104細(xì)胞上盲傳至第6代后表現(xiàn)穩(wěn)定的細(xì)胞病變,具體表現(xiàn)為細(xì)胞折光性增強(qiáng)、拉網(wǎng)脫落等,這與張賀偉等[23]、黃小波等[24]結(jié)果一致。PoRV在體內(nèi)只感染腸絨毛的上皮細(xì)胞,在體外能感染腎或腸道上皮細(xì)胞,其中最敏感的是MA104細(xì)胞,隨后發(fā)現(xiàn)用胰酶處理的輪狀病毒也能在ST、MARC-145、PK15、Vero等細(xì)胞上增殖[25-27],本試驗(yàn)分離株能夠在MA104、Vero、IPEC-J2、PK15、ST、McCoy、MARC-145細(xì)胞中增殖,其易感性排序?yàn)镸A104>Vero>IPEC-J2>PK15>ST>McCoy>MARC-145>IEC-18細(xì)胞,進(jìn)一步驗(yàn)證MA104細(xì)胞是分離輪狀病毒的最佳選擇。
輪狀病毒基因型和血清型很多,且在自然界中還存在著人與動(dòng)物、動(dòng)物與動(dòng)物之間的基因片段重組現(xiàn)象[28-30],RVA的基因型眾多,且G型與P型之間會(huì)產(chǎn)生不同的組合,不同組合型的RVA毒株的交叉保護(hù)性很低[31-32]。目前,RVA中與豬相關(guān)的輪狀病毒G血清型有12種,P血清型16種,其中在中國(guó)流行的PoRV G血清型為G3、G4、G5、G9、G11和G26,通常會(huì)與P[5]、P[6]、P[7]、P[13]、P[23]組合的形式流行[33-34]。在本試驗(yàn)中,分離株的VP4基因與P[23]型的PoRV SCYB-C3株親緣關(guān)系最近,相似性為96.65%,VP7基因與G5型的PoRV Zjhzl3-2株和OSU/USA株相似性分別為97.78%和93.8%,據(jù)Matthijnssens等[6]提出的“輪狀病毒VP4編碼區(qū)核苷酸序列相似性>90%,即為同一基因型,輪狀病毒VP7編碼區(qū)核苷酸序列相似性>80%,即為同一基因型”的劃分方法,確定AY01株屬于G5P[23]型PoRV。在眾多PoRV G/P組合型中,G5P[7]型PoRV是全球流行最廣泛的組合型,占所有PoRV的37.3%[35],但隨著RVA基因片段間重組頻繁,近年來(lái)在中國(guó)陸續(xù)報(bào)道了G11P[13]、G9P[23]、G9P[7]、G4P[13]、G26P[13]等新型組合的PoRV[36-38],本試驗(yàn)報(bào)道了一種新組合型PoRV AY01株,豐富了國(guó)內(nèi)PoRV的資料,有利于對(duì)國(guó)內(nèi)PoRV的監(jiān)測(cè)。
目前,國(guó)內(nèi)關(guān)于PoRV分離的報(bào)道越來(lái)越多,但關(guān)于PoRV對(duì)豬致病性的相關(guān)報(bào)道較少。本試驗(yàn)開(kāi)展PoRV AY01毒株人工感染仔豬的致病性研究,為防止仔豬母源抗體對(duì)試驗(yàn)的影響,選擇1日齡新生未吃初乳的仔豬為試驗(yàn)對(duì)象,仔豬經(jīng)口感染分離毒株,在攻毒后24~48 h期間,仔豬表現(xiàn)嘔吐、腹瀉、排黃色水樣并伴有腥臭的稀糞的癥狀,剖檢可見(jiàn)各腸段脹氣明顯,小腸腸壁變薄,腸系膜充血腫脹,小腸絨毛萎縮,腸上皮細(xì)胞脫落、壞死。黃小波等[24]使用3日齡仔豬感染PoRV OSU株,在感染10 h后,仔豬開(kāi)始腹瀉,拉黃色水樣稀糞,感染42 h后仔豬脫水死亡。Narita等[39]通過(guò)對(duì)8頭口服PoRV的新生仔豬的腸道病變進(jìn)行研究時(shí),發(fā)現(xiàn)感染PoRV的仔豬在接種后18~24 h表現(xiàn)腹瀉,腸絨毛脫落、萎縮,特別是空腸和回腸的變性,這與本試驗(yàn)分離株感染仔豬的癥狀和病理切片觀察結(jié)果一致。此外,在整個(gè)試驗(yàn)過(guò)程中,使用實(shí)時(shí)熒光定量PCR方法對(duì)試驗(yàn)組仔豬糞便排毒情況進(jìn)行檢測(cè),發(fā)現(xiàn)試驗(yàn)組仔豬均在24~48 h期間Ct值變化明顯,36~44 h降到最低,此時(shí)仔豬臨床表現(xiàn)為腹瀉、嘔吐、排黃色水樣糞便等典型的PoRV癥狀,表明此時(shí)是仔豬糞便排毒的高峰期。因此,初步得出PoRV在進(jìn)行動(dòng)物致病性研究時(shí),可結(jié)合仔豬臨床與實(shí)時(shí)熒光定量PCR方法,對(duì)試驗(yàn)過(guò)程進(jìn)行監(jiān)測(cè),當(dāng)發(fā)病癥狀表現(xiàn)明顯及Ct值最低時(shí)處死仔豬,能最大程度得到病毒含量高的病料樣品。
4 結(jié) 論
本試驗(yàn)成功分離到1株基因型為G5P[23]型的PoRV,為了解江西地區(qū)PoRV的流行變異情況及有效防治PoRV感染提供了參考依據(jù)。

