藏綿羊KLF7基因表達特征分析及其過表達對前脂肪細胞增殖分化的影響
張雪萍,石斌剛,金夏陽,王向彥,蘭麗娟,時 鈺,祁有鵬,趙世杰,李少斌,胡 江
(甘肅農業大學動物科學技術學院,甘肅省草食動物生物技術重點實驗室,蘭州 730070)
脂肪組織主要分布在動物皮下、內臟及肌肉間等部位,可調節動物機體能量平衡和脂質代謝[1]。動物脂肪代謝過程受到多種轉錄因子調控,如過氧化物酶體增殖物激活受體(peroxisome proliferator-activated receptors,PPARs)、CCAAT增強子結合蛋白(CCAAT/enhancer binding protein,C/EBP)、固醇調節元件結合蛋白(sterol regulatory element binding proteins,SREBPs)、叉頭框蛋白家族(Fork head box,Fox)[2]、鋅指蛋白家族2(GATA-binding protein 2,GATA2)和鋅指蛋白家族3(GATA-binding protein 3,GATA3)[3]及Krüppel樣因子(Krüppel-like factors,KLFs)家族等。
KLFs是一類廣泛分布于真核生物體內的轉錄因子[4],KLFs家族包括17個成員,轉錄調節細胞增殖、分化和胚胎發育等生物學過程[5]。據報道,KLFs家族多個成員在脂肪細胞分化中發揮重要作用[6],其中KLF4、KLF5、KLF6和KLF15正向調控脂肪細胞分化,而KLF2、KLF3和KLF7則負向調控脂肪細胞分化[7]。KLF7基因也稱為UKLF,在動物體多個組織中廣泛表達,參與調節神經系統發育、Ⅱ型糖尿病發生及脂質代謝等多種生物學過程[8-11]。研究表明,過表達KLF7基因可抑制C2C12成肌細胞、髓前體細胞增殖[12-13];人和小鼠中過表達KLF7基因會抑制脂肪細胞分化和脂質生成關鍵基因的表達[10];miR-146b可下調KLF7基因表達并促進人內臟脂肪分化[14];KLF7基因突變與雞血漿極低密度脂蛋白(very low-density lipoprotein,VLDL)含量、腹脂重等脂肪性狀相關[15]。
藏綿羊是中國三大原始綿羊品種之一,目前存欄量約2 500萬只,主要分布在海拔3 000 m以上的青藏高原及其毗鄰地區[16]。藏綿羊適應青藏高原嚴酷的環境條件,耐寒、耐粗飼能力強,羊肉纖維致密,細嫩多汁,且具有高蛋白、低脂肪的特點[17],是當地牧民重要的生活資源。脂肪沉積與綿羊生產性能(如肉品質)及飼料報酬等密切相關,但目前對藏綿羊脂肪沉積機制的分子遺傳研究相對較少。基于KLF7基因在動物機體脂質代謝中的重要作用,本研究擬檢測KLF7基因在藏綿羊各組織及成脂誘導分化不同階段脂肪細胞中的表達水平,構建pcDNA3.1-KLF7過表達載體,探究過表達KLF7基因對前脂肪細胞增殖及分化的影響,以期為深入了解KLF7基因在藏綿羊脂肪生成中的調控機制提供參考資料。
1 材料與方法
1.1 材料
1.1.1 樣品采集 于甘肅省甘南藏族自治州選取飼養條件相同的3月齡健康藏綿羊公羊3只,屠宰后采集皮下脂肪、腎臟、瘤胃、背最長肌、大腦、睪丸、回腸等組織樣,同時每只藏綿羊采集腹股溝處約1 cm3皮下脂肪組織樣,立刻投入液氮中,帶回實驗室-80 ℃保存,用于組織表達譜分析及真核過表達載體構建,皮下脂肪樣品用含雙抗的PBS緩沖液清洗3遍,用于前脂肪細胞增殖分化研究。
1.1.2 主要試劑及儀器 DL2000 DNA Marker、1 kb DNA Marker、Trizol Reagent試劑盒和SYBR Green ProTaqHS預混型qPCR試劑盒均購自艾科瑞生物公司;限制性核酸內切酶KpnⅠ和XhoⅠ均購自TaKaRa公司;大腸桿菌Trans5α感受態細胞購自北京全式金生物科技有限公司;胎牛血清購自Invitrogen公司;PBS緩沖液、雙抗和DMEM培養基均購自HyClone公司;反轉錄試劑盒和HiScript Ⅲ 1st Strand cDNA Synthesis Kit均購自諾唯贊生物科技有限公司;BeyoClickTMEdU-555細胞增殖檢測試劑盒購自上海碧云天生物技術有限公司;INVI DNA RNA Transfection ReagentTM轉染試劑和CCK-8試劑盒均購自Invigentech公司;質粒提取試劑盒購自天根生化科技(北京)有限公司;油紅O染色液購自索萊寶生物科技有限公司。
超微量分光光度計(NanoDropTMOne)、Varioskan LUX酶標儀均購自Thermo Scientific公司;IX53型熒光倒置顯微鏡購自Olympus公司。
1.2 方法
1.2.1 藏綿羊前脂肪細胞的分離培養 采用酶消化法分離培養藏綿羊前脂肪細胞[18],具體為:脂肪組織去除肉眼可見的血管和筋膜后,用含1%雙抗的PBS緩沖液清洗3次后,剪至1 mm3大小的微粒狀,加入0.1%中性蛋白酶Ⅱ和Ⅳ型膠原酶,放置搖床消化90 min;加入等體積含10%胎牛血清的DMEM培養基終止消化,用200目的細胞過濾篩,反復過濾消化液,1 500 r/min離心10 min,棄上清;加入1 mL紅細胞裂解液,吹打數次,室溫靜止5 min,1 500 r/min離心5 min。離心結束后棄上清,用含10%胎牛血清的DMEM培養基重懸細胞,并將細胞接種至T25細胞培養瓶中,培養24 h棄上清,細胞長滿后進行傳代及凍存。
1.2.2 總RNA提取及cDNA合成 根據Trizol Reagent試劑盒說明書分別提取藏綿羊不同組織總RNA,用1.5%瓊脂糖凝膠電泳檢測RNA完整性,用超微量分光光度計評估RNA純度和濃度。檢測合格的總RNA使用反轉錄試劑盒反轉錄為cDNA,-20 ℃保存備用。
1.2.3 PCR擴增與測序 根據GenBank中公布的綿羊(Ovisaries)KLF7基因mRNA序列(登錄號:XM_027965128),應用Primer Premier 3.0在線軟件設計引物P1(表1),用于藏綿羊KLF7基因CDS區擴增。引物由楊凌天潤奧科生物科技有限公司合成。PCR反應體系20 μL:高保真Taq酶10 μL,脂肪組織cDNA(100 ng/μL)0.8 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 7.6 μL。PCR反應程序:94 ℃預變性5 min;94 ℃變性30 s,57 ℃退火30 s,72 ℃延伸30 s,共35個循環;72 ℃延伸10 min;4 ℃保存。PCR擴增產物經1.5%瓊脂糖凝膠電泳檢測后送楊凌天潤奧科生物科技有限公司進行測序。
1.2.4 藏綿羊KLF7基因組織表達差異分析 根據綿羊KLF7基因mRNA序列(GenBank登錄號:XM_027965128),應用Primer Premier 3.0在線軟件設計引物P2(表1),用于實時熒光定量PCR檢測KLF7基因在藏綿羊大腦、皮下脂肪、腎臟、背最長肌、瘤胃、睪丸和回腸中的相對表達量,以β-tubulin為內參基因,對應引物P9(表1)。引物均由楊凌天潤奧科生物科技有限公司合成。PCR反應體系20 μL:2×SYBR qPCR MasterMix 10 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA(100 ng/μL) 2 μL,ddH2O補足體系。PCR反應條件:95 ℃預變性15 min;95 ℃變性10 s,60 ℃退火32 s,72 ℃延伸30 s,共40個循環。每個樣品設置3個重復。
1.2.5KLF7基因在藏綿羊脂肪細胞不同分化期的表達 復蘇藏綿羊前脂肪細胞,將前脂肪細胞接種于12孔板,加入適量基礎生長培養基(10%胎牛血清、90% DMEM基礎培養基、0.1%雙抗)培養;待細胞匯合度至90%時,用MDI(DMEM基礎培養基+胰島素+地塞米松+3-異丁基-1-甲基黃嘌呤)誘導分化培養基培養至第8天。按照1.2.2方法分別從分化第0、2、4、8天的脂肪細胞提取總RNA并反轉錄為cDNA,按照1.2.4方法使用P2引物檢測誘導分化不同階段脂肪細胞中KLF7基因的表達量。

表1 引物信息
1.2.6 過表達載體構建及測序 將1.2.3測序正確的KLF7基因PCR擴增產物純化后,使用KpnⅠ和XhoⅠ限制性核酸內切酶37 ℃酶切30 min,酶切產物再次純化;將純化產物與Solution Ⅰ連接酶混合均勻,連接至pcDNA3.1(+)真核表達質粒,轉化大腸桿菌Trans5α感受態細胞,涂布于含有氨芐青霉素的LB固體培養板上,于搖床中倒置培養過夜;次日挑取單克隆菌落于LB液體培養基中搖至渾濁有明顯沉淀后,利用pcDNA3.1(+)通用引物(T7-BGH)進行菌液PCR擴增鑒定,經1.5%瓊脂糖凝膠電泳檢測后,采用質粒提取試劑盒提取質粒并送測序,重組質粒命名為pcDNA3.1-KLF7,-20 ℃保存備用。
1.2.7 藏綿羊前脂肪細胞增殖及活力檢測 取出凍存的藏綿羊前脂肪細胞,37 ℃水浴鍋解凍復蘇后接種于12孔板內,培養24 h待細胞匯合度達到50%左右,將pcDNA3.1-NC(對照組)和pcDNA3.1-KLF7質粒轉染至12孔板內,48 h后按照1.2.2方法提取細胞總RNA。應用實時熒光定量PCR檢測KLF7和增殖標志基因CDK4、CyclinB1和CyclinD1的mRNA表達量,以β-tubulin為內參基因,相應基因的引物分別為P3、P4、P5和P9(表1),PCR反應體系及程序同1.2.4。按照BeyoClickTMEdU-555細胞增殖檢測試劑盒處理步驟,對轉染pcDNA3.1-NC和pcDNA3.1-KLF7質粒48 h后的脂肪細胞進行EdU染色處理,染色后放置熒光顯微鏡觀察染色結果并拍照。采用CCK-8試劑盒檢測前脂肪細胞活力,將pcDNA3.1-NC和pcDNA3.1-KLF7過表達質粒轉染至96孔板,48 h后每孔加入10 μL的CCK-8試劑,并在37 ℃孵育1 h后,VarioskanTMLUX酶標儀測定每個樣品在450 nm波長的光密度值。
1.2.8 藏綿羊前脂肪細胞的轉染、誘導分化及油紅O染色 取出凍存的前脂肪細胞,接種于12孔板,培養24 h后,按照INVI DNA RNA Transfection ReagentTM轉染試劑盒說明書將pcDNA3.1-NC和pcDNA3.1-KLF7質粒分別轉染至細胞內,基礎生長培養基培養24 h后,替換為MDI(DMEM基礎培養基+胰島素+地塞米松+3-異丁基-1-甲基黃嘌呤)誘導分化培養基繼續培養2 d,8 d后收集細胞,按照1.2.2方法提取總RNA。用實時熒光定量PCR檢測KLF7基因及脂肪細胞分化標志基因PPARγ、Glut4和ELOVL6的mRNA表達情況,以β-tubulin為內參基因,相應基因的擴增引物分別為P6、P7、P8和P9(表1),PCR反應體系及程序同1.2.4。此外,檢測轉染pcDNA3.1-NC和pcDNA3.1-KLF7質粒后脂肪細胞脂滴著色情況,即4%多聚甲醛固定脂肪細胞30 min,PBS清洗3遍,油紅O染色液染色1 h,置于熒光倒置顯微鏡觀察著色脂滴并拍照。
1.2.9 數據統計分析 使用2-ΔΔCt法計算相對表達量。利用SPSS 26.0軟件進行顯著性分析,使用Image J軟件統計脂肪細胞中脂滴含量和EdU陽性細胞數目,利用GraphPad Prism 8.0繪圖。結果以平均值±標準差表示,P<0.05表示差異顯著;P<0.01表示差異極顯著。
2 結 果
2.1 KLF7基因在藏綿羊不同組織及不同分化期脂肪細胞中的表達特性
KLF7基因在藏綿羊不同組織及不同分化期脂肪細胞中的表達譜見圖1。由圖1A可知,KLF7基因在藏綿羊不同組織中均有表達,且有明顯的組織特異性,以回腸表達水平為參照,KLF7基因在藏綿羊大腦、皮下脂肪和腎臟中表達量較高,且顯著高于背最長肌、瘤胃、睪丸和回腸(P<0.05)。由圖1B可知,以分化第0天的脂肪細胞表達水平為參照,KLF7基因在成脂分化第2天的脂肪細胞中表達水平最高,且顯著高于第0、4和8天(P<0.05);在成脂分化第0天最低,且顯著低于第4和8天(P<0.05)。
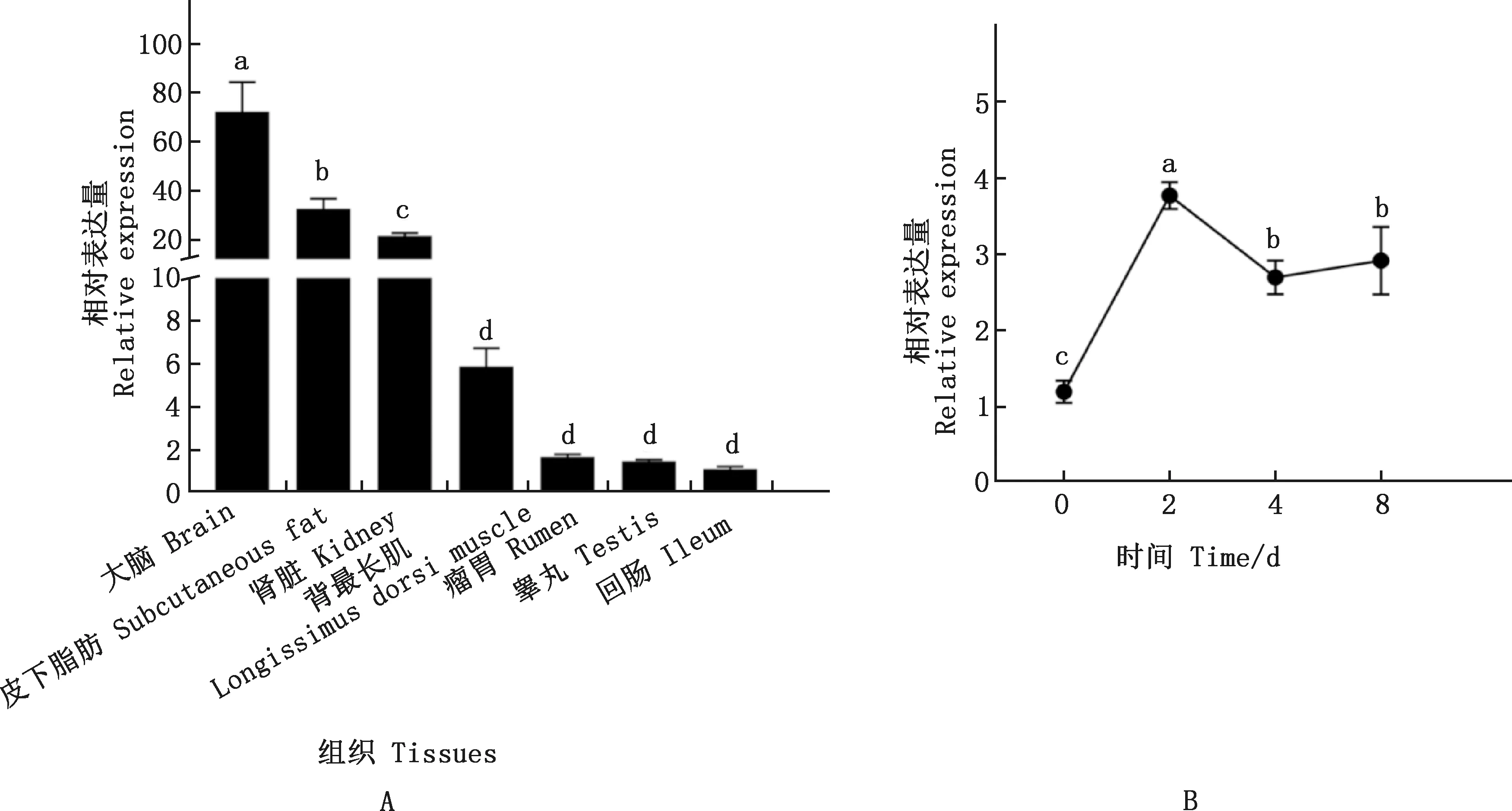
肩標不同字母表示差異極顯著(P<0.05);肩標相同字母表示差異不顯著(P>0.05)Values with different letter superscripts mean extremely significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05)圖1 KLF7基因在藏綿羊不同組織(A)及不同分化期脂肪細胞(B)中的表達Fig.1 Expression of KLF7 gene in different tissues (A) and adipocytes at different differentiation stages (B) of Tibetan sheep
2.2 KLF7基因真核過表達載體鑒定
對藏綿羊KLF7基因真核過表達載體(pcDNA3.1-KLF7)進行鑒定,結果顯示,片段大小為1 143 bp(圖2),與預期相符。取鑒定正確的菌液提取質粒并測序,結果與GenBank中綿羊KLF7基因CDS序列(登錄號:XM_027965128)相一致,表明成功構建了藏綿羊KLF7基因真核過表達載體。
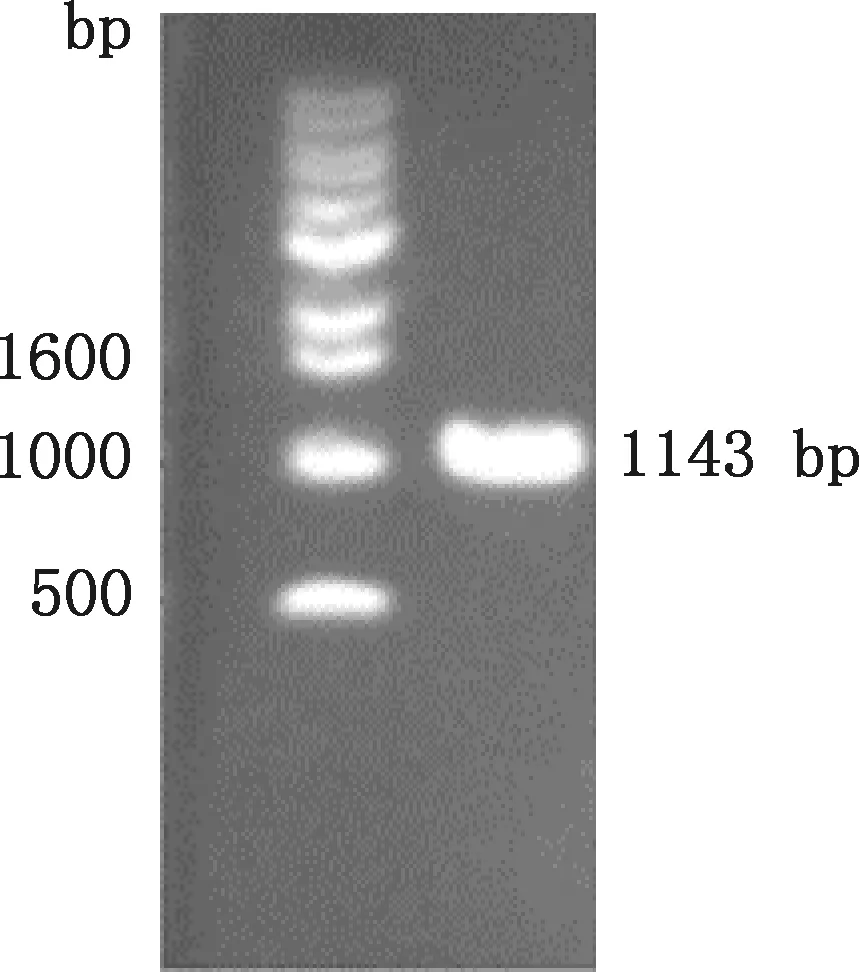
圖2 藏綿羊KLF7基因過表達載體PCR擴增電泳圖Fig.2 Agarose gel electrophoresis of PCR amplification of KLF7 gene overexpression vector in Tibetan sheep
2.3 過表達KLF7基因對藏綿羊前脂肪細胞增殖的影響
2.3.1 細胞增殖標志基因mRNA表達 過表達
KLF7基因對藏綿羊前脂肪細胞增殖的影響見圖3。由圖3A可知,前脂肪細胞轉染pcDNA3.1-KLF7質粒48 h后,KLF7基因的表達水平較pcDNA3.1-NC提高了67倍以上(P<0.01),表明KLF7基因成功過表達。由圖3B可知,細胞增殖標志基因CDK4、CyclinB1及CyclinD1表達水平比對照組顯著或極顯著下調(P<0.05;P<0.01)。表明過表達KLF7基因抑制了藏綿羊前脂肪細胞增殖標志基因的表達。

*,差異顯著(P<0.05);**,差異極顯著(P<0.01)。下同*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01).The same as below圖3 藏綿羊前脂肪細胞KLF7(A)及增殖標志基因(B)mRNA相對表達量Fig.3 The mRNA relative expression of KLF7 (A) and proliferation marker genes (B) in preadipocytes of Tibetan sheep
2.3.2 過表達KLF7基因對前脂肪細胞EdU陽性細胞數量的影響 轉染pcDNA3.1-NC和pcDNA3.1-KLF7質粒48 h后,前脂肪細胞EdU染色及陽性細胞比例見圖4。由圖4可知,過表達KLF7基因極顯著下調了EdU陽性細胞數量(P<0.01),表明過表達KLF7基因可抑制新生成的前脂肪細胞數目,即抑制前脂肪細胞的增殖。

A,EdU染色圖(40×);B,EdU陽性細胞比例A,EdU staining chart (40×);B,Percentage of EdU positive cells圖4 前脂肪細胞過表達KLF7基因后EdU陽性細胞數量Fig.4 Number of EdU positive cells after overexpression of KLF7 gene in preadipocytes
2.3.3 過表達KLF7基因對前脂肪細胞活力的影響 轉染pcDNA3.1-NC和pcDNA3.1-KLF7質粒48 h后,采用CCK-8檢測前脂肪細胞活力,結果顯示,過表達KLF7基因極顯著降低了前脂肪細胞活力(P<0.01,圖5)。
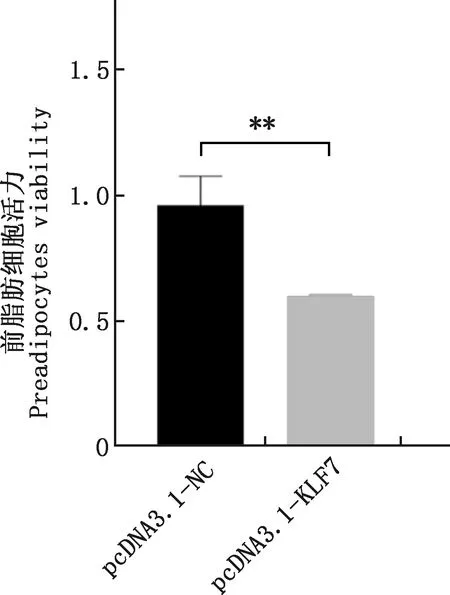
圖5 過表達KLF7基因后對前脂肪細胞活力的影響Fig.5 Effect on cell viability after KLF7 gene overexpression in preadipocytes
2.4 過表達KLF7基因對藏綿羊前脂肪細胞分化的影響
2.4.1 細胞分化標志基因mRNA的表達 過表達KLF7基因藏綿羊前脂肪細胞分化標志基因的表達水平見圖6。由圖6A可知,轉染pcDNA3.1-KLF7質粒后KLF7基因表達量極顯著高于pcDNA3.1-NC(P<0.01),即KLF7基因成功過表達。由圖6B可知,過表達KLF7基因后脂肪細胞分化標志基因PPARγ、Glut4和ELOVL6的mRNA相對表達水平均顯著或極顯著低于pcDNA3.1-NC組細胞(P<0.01;P<0.05),表明脂肪細胞過表達KLF7基因后抑制了脂肪細胞分化標志基因的表達。
2.4.2 脂肪細胞過表達KLF7基因對脂滴含量的影響 過表達KLF7基因的前脂肪細胞油紅O染色和脂滴生成量測定結果見圖7。由圖7可知,前脂肪細胞過表達KLF7基因后,脂滴生成量極顯著減少(P<0.01),表明過表達KLF7基因極顯著下調了前脂肪細胞內的脂滴含量。

圖6 脂肪細胞過表達后KLF7(A)和分化標志基因(B)mRNA相對表達量Fig.6 The mRNA relative expression of KLF7 (A) and adipogenic marker genes (B) after overexpression in adipocytes
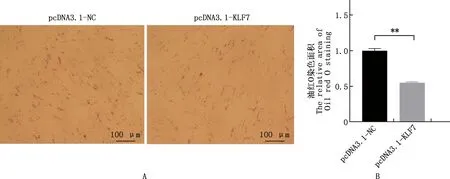
圖7 油紅O染色的前脂肪細胞(A)及其脂滴含量(B)Fig.7 Oil red O staining (A) and amount of lipid droplets (B) in preadipocytes
3 討 論
3.1 藏綿羊KLF7基因表達特性分析
KLF7基因廣泛存在于海膽、魚、兩棲類、鳥類、爬行類、哺乳類和人等動物的多種組織中,對神經系統發育和脂肪形成發揮著重要作用。本研究發現,藏綿羊KLF7基因在大腦組織中表達量最高,其次是皮下脂肪和腎臟,而在背最長肌、瘤胃、睪丸和回腸中的相對表達水平較低。基因在動物不同組織中的表達量與其功能息息相關,KLF7基因在藏綿羊大腦中的高表達可能與其腦神經發育相關。研究證實,KLF7基因在小鼠脊索、大腦皮層及小腦等部位均表達,參與哺乳動物神經系統發育,促進軸突生長和神經元分化[19];KLF7基因可調控雞腹脂重及血漿中VLDL含量[15,20],且在多個物種脂肪組織中高度表達,如牦牛[21]、黃牛[22]、豬[23]及高腹部脂肪肉雞[24]。本研究中,KLF7基因在藏綿羊脂肪組織中高表達,推測該基因與藏綿羊脂肪沉積密切相關,這一結果也為進一步研究過表達KLF7基因對前脂肪細胞增殖和分化的影響奠定了基礎。
前脂肪細胞分化受許多轉錄因子協同作用,對動物脂肪沉積有重要影響。研究表明,KLFs參與調控動物前脂肪細胞分化[25-26]。KLF7基因在藏綿羊前脂肪細胞分化過程中的時序表達表明,在未分化的前脂肪細胞中KLF7基因表達量較低,分化早期(第2天)的脂肪細胞表達量最高。KLFs家族成員在脂肪細胞分化過程中存在時序表達,前脂肪細胞中KLF2基因表達量較高,分化狀態下KLF3、KLF4、KLF5和KLF7基因表達量較高,且隨著分化時間延長其表達量逐漸下降[7]。朱江江等[27]研究發現,KLF7基因在山羊脂肪細胞誘導分化第0天表達量極低,第3天達到最高峰,從5天開始逐漸下降。Li等[28]研究表明,KLF7基因在山羊皮下脂肪細胞誘導分化第2天的表達量最高,與本研究結果一致。但Zhang等[24]研究表明,雞前脂肪細胞中KLF7基因誘導分化的0 h表達量最高,第1、2天表達量著降低,而第3天又上升到峰值,其時序表達結果與藏綿羊及山羊有所不同,這可能與物種有關。
3.2 過表達KLF7基因抑制藏綿羊前脂肪細胞增殖
前脂肪細胞的增殖是脂肪組織發育過程中的關鍵事件,研究證實,KLF7基因參與調控細胞的增殖[29],但有關藏綿羊前脂肪細胞增殖的功能研究較少。本研究通過檢測前脂肪細胞增殖標志基因、EdU染色及細胞活力發現,過表達KLF7基因可顯著抑制前脂肪細胞增殖。細胞增殖過程受眾多細胞周期調節因子調控,如CDKs、Cyclins及CKI,其中CDK4、CyclinB1和CyclinD1基因可加速細胞G1期到S期過渡,從而正向調節細胞增殖[30]。王小斌[12]研究表明,過表達KLF7基因可抑制C2C12成肌細胞增殖;Schuettpelz等[13]報道,過表達KLF7基因可抑制髓前體細胞增殖;Li等[29]研究發現,miR-103通過靶向KLF7基因促進非小細胞肺癌增殖,推測過表達KLF7基因可抑制脂肪細胞增殖;但Zhang等[24]研究表明,過表達KLF7基因可促進雞前脂肪細胞增殖,可能是KLF7基因在不同物種中表達規律具有差異性,具體原因尚需進一步研究。
3.3 過表達KLF7基因抑制藏綿羊前脂肪細胞分化
前脂肪細胞分化是不同分化標志基因時序表達的過程。PPARγ、Glut4、ELOVL6等基因在脂肪細胞分化過程中發揮重要作用,檢測此類標志基因有助于深入了解脂肪細胞中脂質代謝。PPARγ是脂肪沉積關鍵轉錄因子,其表達被抑制后導致脂質分解,脂肪酸合成減少[31]。研究表明,PPARγ與視黃醛X受體結合形成異源二聚體,并與其他核受體共同作用進而調控下游靶基因脂肪酸結合蛋白4(fatty acid binding protein 4,FABP4)和脂蛋白脂酶(lipoprotein lipase,LPL)表達,最終導致脂肪沉積[32];Glut4主要分布于脂肪、骨骼肌和心肌組織細胞內,是哺乳動物最主要的葡萄糖轉運體,在小鼠脂肪和肌肉組織中表達量較低[33-34];ELOVL6在白色脂肪和小腸中表達量較高[35],可影響單不飽和脂肪酸的延長,生成油脂[36]。據報道,KLF7基因可負向調控脂肪細胞分化,并結合其靶基因PPARγ的啟動子,抑制PPARγ基因啟動子活性,最終抑制一些脂質生成關鍵基因如Glut2、Glut4和脂肪酸合成酶(fatty acid synthase,FASN)等表達,從而負向調控脂肪細胞分化[7]。本研究發現,藏綿羊前脂肪細胞過表達KLF7基因后PPARγ、Glut4和ELOVL6基因表達量顯著降低。Kawamura等[10]及Zhang等[24]報道,過表達KLF7基因可抑制人及雞前脂肪細胞分化;Sun等[37]研究證實,KLF7基因可調控GATA3基因轉錄,抑制雞脂肪細胞分化;金釗等[38]研究表明,KLF7基因可調控低氧誘導因子1α(hypoxia-inducible factor-1α,HIF-1α)轉錄,進而抑制脂肪組織發育;但Li等[28]研究表明,KLF7基因敲低則抑制山羊肌內脂肪及皮下脂肪細胞分化,與本研究結果不同,推測可能是細胞類型不同或細胞在體內具有復雜的調控機制導致,具體原因仍需進一步研究。
4 結 論
KLF7基因在藏綿羊大腦、皮下脂肪、腎臟、背最長肌、瘤胃、睪丸和回腸中廣泛表達,且大腦、皮下脂肪及腎臟中表達量較高;誘導分化后的脂肪細胞表達量顯著高于分化前,且分化第2天表達量最高;KLF7基因參與藏綿羊脂肪細胞增殖分化過程,其過表達可抑制前脂肪細胞的增殖及分化。研究結果為進一步探究藏綿羊脂肪沉積的分子調控機制提供參考。

