miR-219a-5p在癲癇患兒血清中的表達及臨床意義
秦建品,陳 明,許 詣,沈文婷
(湖北文理學院附屬醫院/襄陽市中心醫院兒科,湖北 襄陽 441021)
癲癇是一類由腦組織內神經元高度同步化異常放電引起的綜合征,是兒科常見疾病之一,其發病機制復雜,臨床以反復、短暫、發作性中樞神經系統功能紊亂為特征,患者多表現為意識喪失、四肢抽搐、精神及行為障礙等[1]。流行病學結果顯示,癲癇在一般人群中的發病率為0.4%~0.7%左右,以少兒居多[2]。微小RNA(miRNA)是一類長度約18~25個核苷酸的內源性非編碼RNA,通過與靶基因的3′端非翻譯區匹配轉錄后進行調控,可抑制翻譯或降解mRNA來阻止蛋白表達;miRNA的失調可能導致神經損傷和神經退行性疾病,包括癲癇[3]。早期研究發現,miR-219是一種腦特異性miRNA,通過調節CaMK2G/NMDA通路在抑制癲癇發作的過程中發揮關鍵作用[4]。有研究表明miR-219a-5p是鈣/鈣調蛋白依賴性蛋白激酶Ⅱ(calcium/calmodulin dependent protein kinase Ⅱ gamma,CaMK2G)的靶基因[5],在神經元的發育中起重要作用;而癲癇的發作與神經元凋亡和腦損傷有關[6],但其具體作用機制至今尚未闡明。基于此,本研究通過檢測癲癇患兒血清中miR-219a-5p與CaMK2G的表達水平,探討二者的關系及臨床意義。
1資料和方法
1.1研究對象
選取2017年6月至2019年6月本院收治的46例癲癇患兒為研究組,均符合國際抗癲癇聯盟于2016年制定的癲癇及癲癇綜合征分類診斷新方案[7]。同期選取與研究組性別、年齡相對應的50例健康體檢兒童為對照組,排除既往癲癇發病史或家族癲癇發病史、合并感染性疾病、腦炎、腫瘤、自身免疫性疾病患兒。本研究獲得本院倫理委員會批準(NO.2017-0326),入組兒童家屬或監護人均知情同意。
1.2樣本采集與檢測
研究組患兒在癲癇發作時取外周血5mL,對照組兒童取清晨空腹靜脈血5mL,3 000r/min離心15min,分別置于干凈EP管中,貼好標簽,-20℃條件下保存。采用熒光定量PCR技術對血清中miR-219a-5p、CaMK2G水平進行檢測。使用Trizol試劑盒從血清中提取總RNA,利用NanoDropND-1000分光光度儀(NanoDrop Tech,美國)檢測RNA濃度。使用PrimeScript RT反轉錄試劑盒將RNA反轉錄為cDNA,以上均嚴格按照說明書操作步驟執行。循環參數:95℃,預變性3min;90℃,變性5s;60℃,退火20s,共40個循環。miR-219a-5p以U6為內參,CaMK2G以GAPDH為內參。引物序列由生工生物工程公司合成(表1)。采用2-△△Ct法計算miR-219a-5p的相對表達量及CaMK2G水平。

表1 引物序列
1.3統計學方法
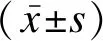
2結果
2.1兩組患兒一般資料的比較
研究組和對照組患兒在年齡、性別、身高、體重方面的差異均無統計學意義(P>0.05),具有可比性,見表2。
2.2兩組患兒血清miR-219a-5p、CaMK2G表達水平比較
研究組患兒血清中miR-219a-5p水平明顯高于對照組,CaMK2G水平明顯低于對照組,差異均有統計學意義(t值分別是5.314、3.855,P<0.05),見表3。

表2 兩組患兒一般資料的比較
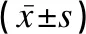
表3 研究組和對照組血清中miR-219a-5p、CaMK2G表達水平比較
2.3血清miR-219a-5p、CaMK2G水平對癲癇患兒的診斷價值
ROC分析結果顯示,血清miR-219a-5p、CaMK2G診斷癲癇患兒的曲線下面積(area under the curve,AUC)分別為0.807(95%CI:0.714~0.881)、0.752(95%CI:0.653~0.834),其靈敏度分別是69.57%、78.26%,特異度分別是80.00%、62.00%;血清miR-219a-5p、CaMK2G聯合預測癲癇患兒的AUC為0.860(95%CI:0.774~0.922),靈敏度和特異度分別為97.83%、60.00%,詳見圖1和表4。

圖1 血清miR-219a-5p、CaMK2G水平斷癲癇患兒的ROC曲線

表4 血清miR-219a-5p、CaMK2G水平對癲癇患兒的診斷價值
2.4癲癇患兒血清miR-219a-5p、CaMK2G水平的相關性
Pearson相關性分析顯示(圖2),癲癇患兒血清miR-219a-5p與CaMK2G水平呈負相關關系(r=-0.424,P<0.05)。由miRTarBase可知miR-219a-5p靶向CaMK2G表達的基因序列有3段,如圖3所示。

圖2 癲癇患兒血清miR-219a-5p、CaMK2G表達的相關性

圖3 miR-219a-5p靶向CaMK2G表達的基因序列
3討論
3.1探討癲癇發生相關指標的重要性
癲癇是由腦組織神經元異常放電引起腦功能異常的神經系統疾病,其發病具有不可預知性,反復性發作可導致腦功能損傷;若未得到及時治療,可造成患兒智力障礙,不僅影響身心健康,還對今后的學習、生活造成嚴重損害。我國癲癇相關的流行病學研究顯示,華東和西南地區的癲癇患病率在0.5%左右,患病人數高達900萬,首次發病多發生于兒童、青少年時期,男性多于女性,有顯著的遺傳傾向,基因突變和蛋白質異常修飾在癲癇的發病中占主要原因[8]。
3.2 miRNA在癲癇發病機制中的作用
隨著生物基因技術的發展,人們發現miRNA廣泛存在于生物體內,能夠結合數百種轉錄產物,參與生命過程中細胞的增殖、分化、發育及凋亡[9]。有研究表明,miRNA參與調控少突膠質細胞的增殖、分化過程,通過結合靶mRNA抑制蛋白質合成或導致mRNA降解來調控基因表達。研究發現,臨床上可利用側腦室注射miRNAs激動劑治療腦損傷[10]。廖蕓茜等人將出生2天的Sprague-Dawley大鼠用脂多糖模擬早產兒腦白質損傷,通過側腦室注射miR-219激動劑提高miR-219在大鼠腦組織中的表達,結果發現可有效抑制SOX6蛋白表達,提高成熟少突膠質細胞標志物MBP表達,從而改善全身炎癥導致的新生大鼠少突膠質細胞成熟障礙[11]。
3.3血清miR-219a-5p和CaMK2G水平在癲癇患兒中的表達及診斷價值
少突膠質細胞活化、增生可使血腦屏障的完整性和細胞內微環境電解質的平衡遭到破壞,導致神經元過度異常放電,從而引起癲癇的發生、發展[12]。miR-219是少突膠質細胞特有的miRNA,是促進少突膠質細胞分化成熟的必需物質,能改善由總miRNA缺失導致的少突膠質細胞分化發育缺陷。最新研究發現,miR-219在癲癇患者杏仁核中低表達,可能在癲癇患者的興奮性神經傳遞中發揮調控作用,為耐藥癲癇的miRNA生物學開辟了新的途徑[13]。Wang等人將miR-219模擬物轉染大鼠海馬神經元,觀察miR-219對谷氨酸誘導的海馬神經元神經毒性的保護作用,熒光素酶報告基因確認CaMK2G是miR-219的靶基因,經谷氨酸刺激后miR-219表達下降、CaMK2G表達上升,說明miR-219通過負調控CaMK2G表達而減輕谷氨酸誘導的神經源毒性[14]。CAMK2G表達降低可能嚴重損害神經元的遷移和成熟[15]。有報道稱,可在小鼠海馬神經元損傷模型中檢測到miR-219a-5p差異性表達[16]。本研究結果顯示,與對照組相比,癲癇患兒血清中miR-219a-5p表達上調而CaMKII2G表達下調;Pearson相關分析顯示癲癇患兒血清miR-219a-5p與CaMK2G水平呈負相關,上述結果均提示miR-219a-5p可能靶向負調控CaMK2G表達,與癲癇的發病、發展有關。ROC分析顯示,血清miR-219a-5p和CaMK2G對癲癇患兒均有一定的預測價值,且二者聯合應用時預測價值最大。
綜上所述,癲癇患兒血清miR-219a-5p表達上調,CaMK2G表達下調,miR-219a-5p可能通過靶向負調控CaMK2G表達參與癲癇的發生發展,但具體的作用機制有待進一步研究。

