草酸青霉和棘孢木霉對青枯勞爾氏菌的生防效果
方啟航,顏顧浙,方 偉,高 競,趙 凱,蔣仁強,趙夢麗,徐秋芳
(浙江農林大學 環境與資源學院 浙江省森林生態系統碳循環與固碳減排重點試驗室,浙江 杭州 311300)
番茄Lycopersicon esculentum青枯病是由病原菌青枯勞爾氏菌Ralstonia solanacearum(簡稱青枯菌)引起的病害,該菌被公認為最具侵染力和破壞力的土傳病害之一[1-2]。侵染后引起植株維管束堵塞,嚴重時導致植物枯萎死亡。據估算,由青枯病造成的農業經濟損失高達30萬元·hm-2,山東、新疆、河北、河南、云南、江蘇等地都是番茄青枯病的重災區[3]。目前,對于番茄青枯病的防控措施主要有:抗病品種篩選,如BHN466和FL7514[4-5],但其果實普遍比正常果實小[6],且篩選抗病品種周期長;采用嫁接方式,雖能增強植物抗病能力,但經濟成本較大,目前中國在栽培番茄上采用嫁接技術比例不足2%[7];化學農藥噴施,易促進病源菌產生抗病性和造成土壤污染[8]。尚未有單一的物理化學防治方法能完全有效地抑制番茄青枯病[9]。
目前,關于利用生防菌進行生物防治研究集中在以根際促生菌作為拮抗微生物防治病源菌侵染[10]。其中芽孢桿菌Bacillus、青霉菌Penicillium、木霉菌Trichoderma等常用來作為生防菌應用于植物病害防治研究中。研究發現:芽孢桿菌中解淀粉芽孢桿菌B.amyloliquefaciensAm1和枯草芽孢桿菌B.subtilisPTS-394對番茄青枯病抑制率分別達88.98%[11]和80.00%[12]。木霉菌主要通過競爭作用、誘導宿主抗性、重寄生作用、抗生作用等機制抑制目標病原菌的生長繁殖[13],其中棘孢木霉T.asperellum是目前開發應用最多的菌種之一。平板對峙試驗發現:棘孢木霉F2通過空間位置和營養競爭有效抑制三七Panax notoginseng灰霉病病菌Botrytis cinerea,其抑制率高達90%[14];棘孢木霉GDFS1009對秸稈腐爛病的抑制率達60%[15]。青霉菌對植物病原菌的抑制效果研究比木霉少,KOMAI等[16]從青霉菌P.simplicissimumIFM53375中分得的Penicillide(1-4)類化合物及其衍生物、嘌呤活性蛋白等具有抗真菌活性作用;夏漢祥等[17]發現淡紫擬青霉P.lilacinus產生的類植物生長素有防治病蟲害、促進植物生長的作用;淡紫擬青霉能在香蕉Musa nana根際穩定定殖,對香蕉枯萎病有很強的防控效果。草酸青霉P.oxalicum通過營養競爭、重寄生等多種方式抑制尖孢鐮刀菌Fusarium oxysporum生長發育,它對蘋果Malus pumila連作土壤中常見的4種有害鐮孢菌有抑制作用[18]。
木霉菌和青霉菌是有潛力的生防菌,但作為青枯菌的生防菌研究鮮見報道。本研究利用篩選獲得的棘孢木霉QZ2和草酸青霉QZ8等2株生防菌探究對青枯菌的防治效果。
1 材料與方法
1.1 供試菌株與培養基
1.1.1 供試菌株 青枯勞爾氏菌 QL-RS 1115,GenBank: GU390462 (簡稱青枯菌)由南京農業大學資源與環境學院提供,從出現嚴重青枯病病癥的番茄根際分離,經過科赫法則(Koch’ spostulates)[19]證實具有強致病性。棘孢木霉QZ2和草酸青霉QZ8由浙江農林大學浙江省森林生態系統碳循環與固碳減排重點實驗室從衢州退化植被恢復試驗區土壤中分離獲得,經過ITS序列克隆測序、美國國家生物信息中心(NCBI)數據庫比對鑒定,用甘油保存法-80 ℃保存[20]。
1.1.2 培養基 包括:①馬鈴薯葡萄糖培養基 (PDA);②NA 培養基:葡萄糖 10 g,蛋白胨 5 g,酵母粉0.5 g,牛肉膏3 g,1 L蒸餾水;③NB培養基:NB培養基基礎上加20 g瓊脂;④SMSA培養基:1 L NA培養基中加入質量濃度3%多黏菌素3 mL,質量濃度3%放線菌酮3 mL,質量濃度1%氯霉素450 μL,質量濃度為1%青霉素450 μL,質量濃度為1%結晶紫450 μL,質量濃度為1% TTC 4.5 mL,質量濃度為1%桿菌肽2.25 mL,于倒平板前加入到三角瓶中[17];⑤青霉選擇培養基:孟加拉紅(虎紅)培養基;⑥木霉選擇培養基:每升孟加拉紅(虎紅)培養基中加入氯霉素0.25 g,質量濃度為1%鏈霉素9 mL,于倒平板前加入到三角瓶中[21]。
1.2 方法
1.2.1 平板對峙試驗 參照嚴無瑕等[22]方法,用兩點法進行平板對峙試驗,以不接種生防菌為對照,每個處理設置3個重復。將青枯菌和棘孢木霉QZ2菌株分別接種于PDA固體培養基中,(28±1) ℃黑暗培養4 d后,用無菌槍頭挑取棘孢木霉QZ2和青枯菌單菌落,接種于100 mL的PDA液體培養基中,28 ℃,170 r·min-1轉速震蕩培養14 h,得到棘孢木霉QZ2與青枯菌的種子液,取100 μL接種于PDA固體培養基,(28±1) ℃黑暗培養4 d,待平板長滿后,用直徑9 mm的打孔器獲得青枯菌的菌餅,接種于平板中央,用同樣方法得到棘孢木霉QZ2菌餅接種青枯菌左右間距40 mm位置。以只在中央接種青枯菌的平板作為對照,每個處理設置3個重復。接種后置于(28±1) ℃黑暗條件下培養,分別于培養4、6、8、10 d時測量青枯菌菌落直徑。用同樣方法進行草酸青霉QZ8兩點法平板對峙試驗。青枯菌生長抑制率=(對照菌落直徑-處理的菌落直徑)/對照菌落直徑×100%。
1.2.2 生防菌滅菌發酵液對病原菌抑制效果 生防菌發酵液的制備參照程敏等[23]的方法,生防菌種子液的配置參照1.2.1,將種子液按照體積分數為3%的接種量接種至500 mL的PDA液體培養基中,28 ℃、170 r·min-1震蕩培養 48 h,得到棘孢木霉 QZ2 和草酸青霉 QZ8 的發酵液。以 6 000 r·min-1離心 5 min 發酵液后,收集上清液,分別與PDA液體培養基按照1∶1的體積比均勻混合,并加入質量濃度為20%的瓊脂粉,115 ℃高壓滅菌30 min,制成PDA與棘孢木霉QZ2發酵液的混合培養基。用直徑9 mm的打孔器獲取青枯菌菌餅,接種至棘孢木霉QZ2和草酸青霉QZ8的混合培養基的中央,用無菌水代替發酵液的PDA培養基平板作為對照,每個處理設置3個重復。分別于培養4、6、8、10 d時測量青枯菌菌落的直徑,抑菌率計算公式同1.2.1。
1.2.3 生防菌活性發酵液對病原菌生長抑制效果的液培養試驗 生防菌發酵液滅菌后一些活性物質可能會失活,通過活性發酵液的液培試驗進一步研究生防菌抑菌機制。液培試驗參照譚軍等[24]的方法,棘孢木霉QZ2和草酸青霉QZ8的初次發酵液制備參照1.2.1,然后通過無菌濾膜過濾,分別取100 mL棘孢木霉QZ2和青霉QZ8無菌發酵液,與NA液體培養基按照1∶1體積比混合均勻,制成含有棘孢木霉QZ2或草酸青霉QZ8發酵液的NA液體培養基。青枯菌種子液制備:用無菌槍頭挑取青枯菌單菌落,接種至裝有20 mL的NA液體培養基的三角瓶中,28 ℃、170 r·min-1搖床培養12 h,得到青枯菌種子液。取6 mL接種至生防菌發酵液NA混合培養基中,28 ℃、170 r·min-1搖床培養60 h。用滅菌的PDA代替發酵液與NA液體培養基混合均勻作為對照,每個處理3個重復。每隔6 h取樣,測定各培養時間菌液的D(600),共計10次。通過D(600)比較不同環境中青枯菌的含量,并繪制青枯菌的生長曲線。
1.2.4 生防菌對病原菌抑制效果的土培試驗 鑒于土壤中微生物豐富多樣,本研究開展土培試驗驗證生防菌的生防效果。青枯菌菌液制備參照熊漢琴[25]的方法,青枯菌種子液的制備參照1.2.1,吸取2 mL青枯菌接種于200 mL NB液體培養基,28 ℃,170 r·min-1搖床培養36 h制作青枯菌的菌液,隨后將青枯菌菌液分裝于50 mL無菌離心管中,6 000 r·min-1離心5 min,去上清液,加無菌水,重復2次,最后加無菌水調整菌液含量,通過分光光度計測D(600),使其含量達1011CFU·L-1。2株生防菌孢子液制備方法參考文獻[26],首先分別將2種生防菌接種于PDA固體培養基中,在(28±1) ℃、黑暗條件下培養至孢子長滿整個平板,將5 mL無菌水注射在平板上,用涂布棒刮下孢子溶解于無菌水中,用4層紗布過濾后得到孢子懸液,最后將孢子液稀釋到1010CFU·L-1。
采集無青枯菌污染的森林土,土壤pH 6.0~7.0,設置青枯菌+棘孢木霉(QZ2)、青枯菌+草酸青霉(QZ8)、青枯菌+無菌水(對照)3個處理,每處理9個重復,每個重復用100 g土。QZ2和QZ8處理分別將青枯菌菌液與棘孢木霉QZ2和草酸青霉QZ8孢子液按體積比1∶1混合后加入土中,每100 g土加13 mL混合液,置于(28±1) ℃的氣候培養箱培養。分別在3、7、14、20、28 d,用SMSA培養基,采用稀釋涂布平板法計數所有土壤中青枯菌菌落數量[25]。由于群體效應,孢子在土壤中數量達到峰值需要一定時間,因此從處理7 d開始用孟加拉紅(虎紅)培養基和木霉選擇性培養基,采用稀釋涂布平板法,獲得棘孢木霉QZ2和草酸青霉QZ8菌落數量。
1.3 數據處理
用Excel 2010統計數據,結果以平均值±標準差表示;用SPSS 22.0處理工作平臺進行單因素方差分析,顯著性水平取0.05;用Origin Pro 2019b繪圖。
2 結果與分析
2.1 生防菌對青枯菌抑制效果
平板對峙結果(圖1和表1)表明:棘孢木霉QZ2對青枯菌有顯著的抑制效果(P<0.05),棘孢木霉QZ2的菌絲生長速度明顯快于青枯菌生長速度,與對照相比,青枯菌的生長明顯受到棘孢木霉QZ2抑制,對峙培養4 d時棘孢木霉QZ2菌絲布滿了整個培養皿,包圍了青枯菌,抑制率為45.5%,之后青枯菌停止擴大,對照青枯菌則持續生長,10 d對照青枯菌也停止擴大,此時棘孢木霉QZ2對青枯菌的抑制率達80.9%。草酸青霉QZ8對青枯菌也有顯著抑制效果,對峙培養4 d時草酸青霉QZ8對青枯菌抑制率為30.5%,之后草酸青霉QZ8繼續生長,10 d時草酸青霉QZ8與青枯菌菌落直徑都不再擴大,此時草酸青霉QZ8對青枯菌生長抑制率達到45.9%。
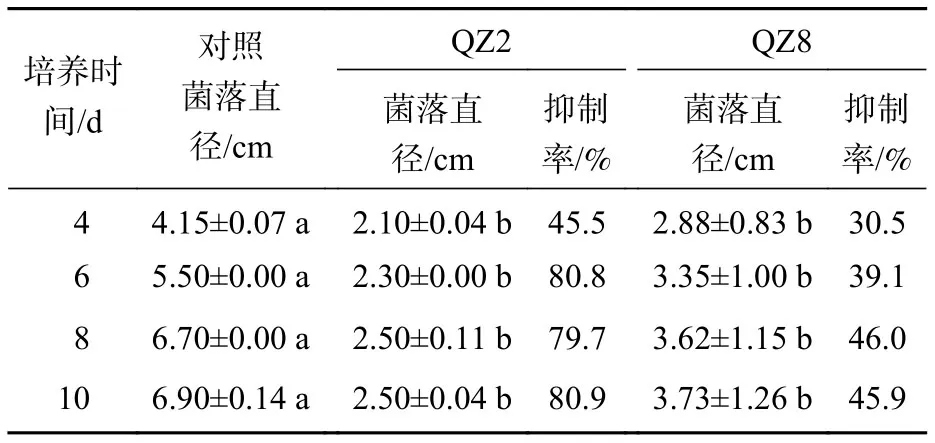
表1 平板對峙中棘孢木霉 QZ2 和草酸青霉QZ8對青枯菌的抑制率Table 1 Inhibition rate of T. asperellum QZ2 and P. oxalicum QZ8 against R. solanacearum in plate confrontation

圖1 平板對峙試驗樣本結果Figure 1 Result of plate confrontation experiment
2.2 生防菌滅菌發酵液對青枯菌的抑制效果
由圖2和表2可見:2株生防菌制成的滅菌發酵液均對青枯菌產生顯著的抑制效果(P<0.05)。棘孢木霉QZ2滅菌發酵液平板中的青枯菌菌落生長速度明顯比對照慢,3個處理的青枯菌菌落均在培養10 d時停止擴大,故以10 d為試驗結果的統計時間。2株生防菌發酵液的抑制率隨著培養時間的增加而增加,4 d時棘孢木霉QZ2發酵液對青枯菌抑制率僅為9.6%,10 d時最大抑制率達33.3%。草酸青霉QZ8發酵液對青枯菌抑制作用與棘孢木霉QZ2相似,10 d時最大抑制率為34.8%,抑制率略高于棘孢木霉QZ2發酵液,差異不顯著。
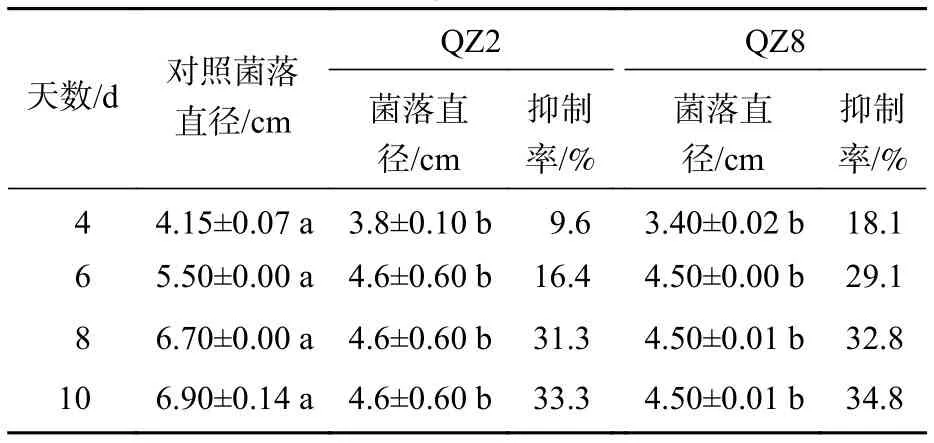
表2 棘孢木霉 QZ2 和草酸青霉 QZ8 滅菌發酵液對青枯菌的抑制情況Table 2 Inhibition effect of sterilized fermentation supernatant of biocontrol broth on the growth of R. solanacearum

圖2 生防菌滅菌發酵液平板培養結果Figure 2 Inhibitory effect of supernatant of sterilized fermentation broth incubated for 10 days
2.3 生防菌活性發酵液對青枯菌的抑制效果
由圖3可見:2株生防菌制成的活性發酵液均對青枯菌有顯著的抑制效果(P<0.05)。對照培養6~18 h時青枯菌呈指數生長,18~24 h時逐漸趨向穩定,其生長曲線與大部分細菌相似。但棘孢木霉QZ2處理在30和36 h時青枯菌D(600)下降,而草酸青霉QZ8處理則在24 h青枯菌D(600)達到峰值后呈緩慢下降,青枯菌較早進入衰亡期。差異檢驗結果表明:24 h以后,2株生防菌活性發酵液處理的青枯菌D(600)均顯著低于對照(P<0.05),其中草酸青霉QZ8處理的D(600)低于棘孢木霉QZ2;60 h時,三者之間的D(600)差異均顯著(P<0.05)。
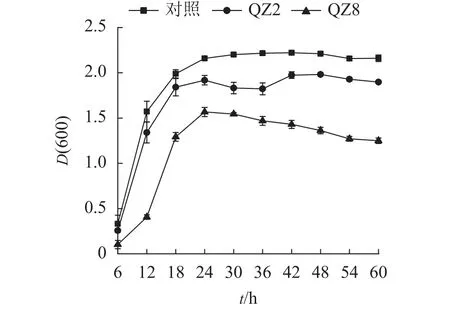
圖3 生防菌活性發酵液對青枯菌數量變化的影響Figure 3 Effect of efermination broth on number of soil R.solanacearum
2.4 生防菌在土壤中的抑菌效果
2.4.1 不同處理土壤青枯菌的數量變化 圖4表明:棘孢木霉QZ2與草酸青霉QZ8在土壤中均能抑制番茄青枯菌的生長繁殖,其在4個測定時間的青枯菌數量均小于對照土壤;抑制效果最好的是7 d,QZ2與QZ8處理土壤中青枯菌數量均顯著低于對照(P<0.05),分別下降了51.3%和64.7%;28 d,QZ2與QZ8處理青枯菌數量比對照顯著下降了38.9%和34.1%(P<0.05);除20 d外,QZ8處理的青枯菌數量均顯著低于對照(P<0.05);前期(7、14 d)的抑制效果是QZ8好于QZ2,而后期(20、28 d)則相反。
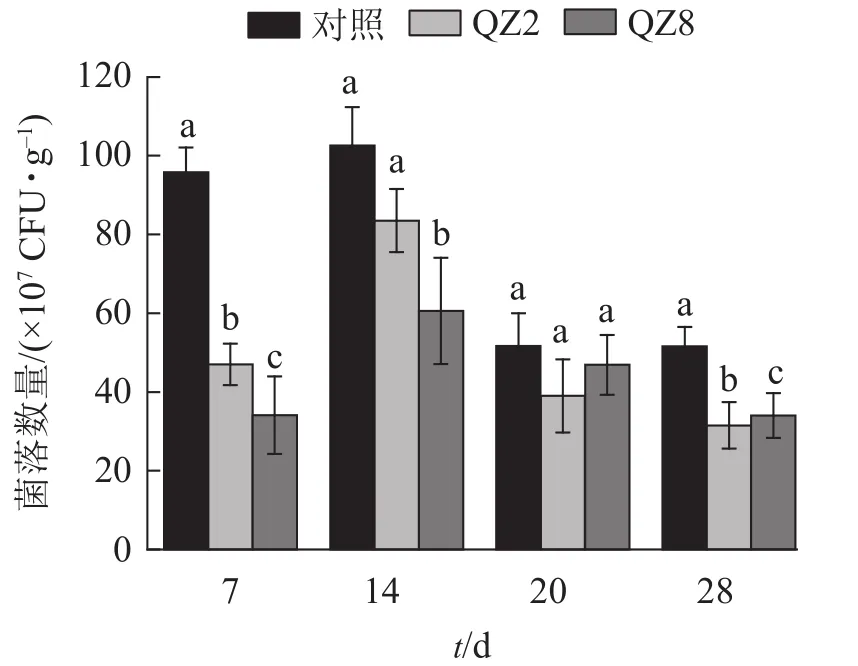
圖4 不同處理土壤青枯菌數量變化Figure 4 Number of R. solanacearum in soil under different treatments
2.4.2 土壤中棘孢木霉 QZ2和草酸青霉 QZ8的數量變化 圖5表明:棘孢木霉 QZ2數量在處理 7 d時處于低位,14 d達峰值,隨后逐漸開始下降。草酸青霉QZ8數量在處理14 d時達到峰值,且明顯多于棘孢木霉QZ2,但之后急劇下降,20 d時與棘孢木霉QZ2相近,28 d時反而少于棘孢木霉QZ2。
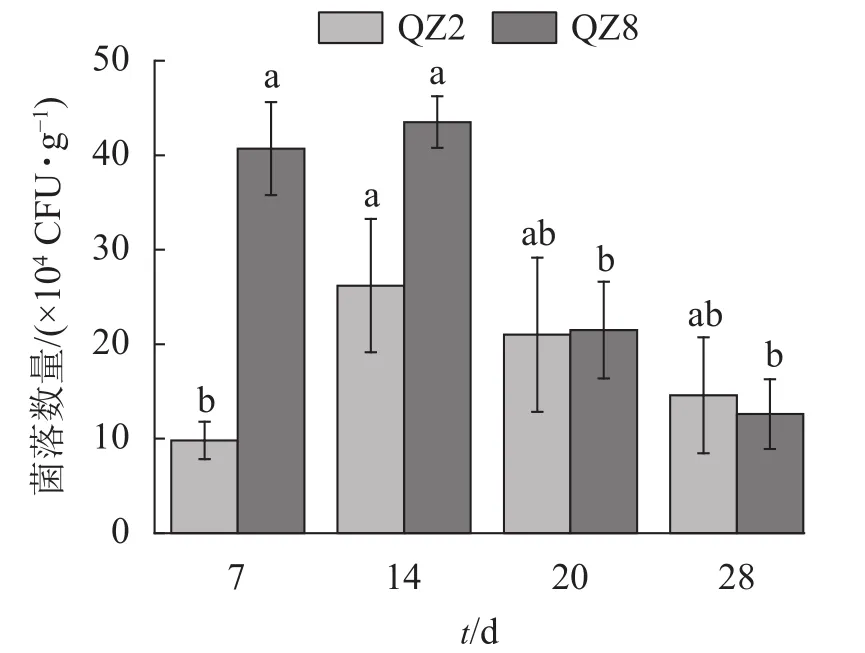
圖5 土壤中棘孢木霉 QZ2 和草酸青霉 QZ8 的數量變化Figure 5 Quantitative changes of T. asperellum QZ2 and P. oxalicum QZ8 in soil
3 討論與結論
木霉菌的拮抗機制包括營養和空間競爭、重寄生、分泌有活性代謝產物、誘導宿主植物抗性等[27]。通過平板對峙試驗發現:棘孢木霉QZ2生長速度明顯快于青枯菌,8 d時已將青枯菌包圍,10 d時占領整個生存空間和營養空間,對青枯菌抑制率達80.9%。黃遠迪等[28]研究發現:棘孢木霉菌株GX004對尖孢鐮刀菌在平板上的抑制率達85.2%;張曉夢等[29]發現棘孢木霉發酵11 d時的無菌濾液對枸杞炭疽病菌Collectotrichum gloeosporioides的抑制率達85.3%。可見棘孢木霉抑制效果良好。平板對峙培養過程中草酸青霉QZ8的生長速度與青枯菌基本一致,也沒有發現明顯的抑制帶,可以推測草酸青霉QZ8能分泌某些代謝產物,從而抑制青枯菌生長。培養10 d時草酸青霉QZ8對青枯菌抑制率為45.9%,抑制效果較好。張先富[30]研究發現:草酸青霉A1對尖孢鐮刀菌抑制率為47.1%,且草酸青霉A1與尖孢鐮刀菌菌落交界處會產生抑菌帶。說明草酸青霉具有較好的生防效果。
本研究結果表明:2株生防菌高溫滅菌發酵液和無菌過濾發酵液均對青枯菌有顯著的抑制作用。高溫滅菌發酵液平板試驗中,棘孢木霉QZ2和草酸青霉QZ8在混合培養基上培養10 d時最大抑制率分別為33.3%和34.8%。無菌過濾發酵液液培試驗中,草酸青霉QZ8對青枯菌的抑制效果顯著好于棘孢木霉QZ2。前人研究發現:木霉和青霉均能產生豐富的代謝產物,其中具有抑菌作用的有聚酮類、生物堿、萜類、大環內酯、纖維素酶和幾丁質酶等物質[31-32]。棘孢木霉QZ2與草酸青霉QZ8滅菌發酵液對青枯菌的抑制效果差別不大,說明均存在耐高溫的抑菌物質,而未滅菌發酵液青霉QZ8抑制作用明顯強于木霉QZ2,說明草酸青霉QZ8發酵液中的某些不耐高溫活性物質如生物堿、酶類化合物,對青枯菌的生長起到較強的抑制作用。
棘孢木霉QZ2和草酸青霉QZ8在土壤中的抑菌效果顯著,在處理28 d時青枯菌數量顯著下降,對照土壤中青枯菌數量始終高于2株生防菌處理的土壤中青枯菌數量。草酸青霉QZ8在處理7、14 d時的抑制效果好于棘孢木霉QZ2,后期則相反,這與土壤中草酸青霉QZ8和棘孢木霉QZ2數量的動態變化規律一致,說明草酸青霉QZ8比棘孢木霉QZ2能更快地在土壤中萌發、定殖,并發揮生防作用。
本研究的2株生防菌對青枯菌均有較好的抑制效果,抑制機制為營養和空間競爭、分泌有活性代謝產物等,其中棘孢木霉QZ2以營養和空間競爭作用為主,而草酸青霉QZ8則以代謝產物的抑制作用為主。兩者均是防治番茄青枯病的潛在生防菌,它們在土壤以及番茄體內定殖情況需進一步研究。

