靈芝UDP-GlcDH基因的cDNA克隆及生物信息學分析
章鴻宇,張燎原
(福建農林大學生命科學學院, 福建 福州 350002)
靈芝Ganodermalucidum屬多孔菌科高等真菌,是我國傳統藥用真菌,具有補氣安神,止咳平喘的功效。靈芝多糖是靈芝重要的活性成分,具有調節免疫作用、抗腫瘤作用、促進體內核酸與蛋白質的代謝、抗衰老作用、鎮靜作用等功能[1-2]。
尿苷二磷酸葡萄糖脫氫酶(UDPglucose dehydrogenase,UDP-GlcDH)廣泛分布于微生物及動植物的組織中,是多糖合成中糖醛酸途徑的限速酶,參與糖代謝,催化尿苷二磷酸葡萄糖(UDP-Glc)反應生成尿苷二磷酸葡萄糖醛酸(UDP-GlcUA),UDP-GlcUA是細胞生長代謝和形成結構多糖必不可少的前體物質[3]。
截至目前,靈芝UDP-GlcDH基因的cDNA序列尚未見報道。本研究利用靈芝表達序列標簽數據庫(EST)資源和生物信息學分析方法,電子克隆了靈芝UDP-GlcDH基因的cDNA,并對其表達的蛋白序列的理化性質、結構特征以及系統進化關系進行預測和分析,為進一步開展靈芝多糖生物合成機制等相關研究奠定基礎。
1 材料與方法
1.1 試驗菌種
靈芝GanodermalucidumCurtis:Fr.P.Karst 由福建農林大學菌物研究中心保藏。
1.2 試驗方法
1.2.1靈芝UDP-GlcDH基因的電子克隆 以黃曲霉AspergillusflavusAF70的UDP-GlcDH蛋白序列(GenBank accession: KOC08495.1)作為探針,利用NCBI中的tBLASTn工具與靈芝Ganodermalucidam的EST數據庫進行相似性搜索,選擇與探針序列同源性較高的序列。利用BioEdit軟件進行拼接,將拼接后的基因序列在NCBI的ORF finder進行開放閱讀框查詢,結合SmartBLAST分析,確認UDP-GlcDH基因。
1.2.2靈芝UDP-GlcDH基因序列的驗證 按照北京鼎國昌盛生物技術有限責任公司的Trigol試劑提取靈芝細胞的RNA,再用反轉錄劑盒將mRNA反轉錄成cDNA。以電子克隆所得的基因序列為模板,用 Primer 5.0軟件設計正向引物F:5′-ATGGCCCCCGTCAAGGTCTC-3′,反向引物R:5′-TCAAAGGCGGTCTCC ACGACCA-3′,預計產物大小為1 416 bp。以反轉錄的cDNA作為模板進行PCR反應,PCR條件為:95℃預變性5 min,循環35次(95℃、30 s,55℃、30 s,72℃、90 s),最后72℃充分延伸10 min,4℃保存。用1.0%瓊脂糖凝膠電泳鑒定PCR產物,并將PCR產物交上海生工測序。
1.2.3生物信息學分析 利用生物信息學軟件對所得的UDP-GlcDH基因序列進行分析,并對基因編碼的蛋白質進行理化性質、親/疏水性、跨膜區結構、信號肽、二級結構、活性中心及底物結合位點等生物信息學的分析和預測[4],具體分析內容和工具軟件見表1。

表1 預測基因結構功能所用到的網站及軟件
2 結果與分析
2.1 靈芝UDP-GlcDH基因的克隆與驗證
經過相似性搜索、拼接、驗證、延伸等電子克隆過程,獲得1條全長為1 591 bp的基因序列,ORF finder分析顯示,該序列從13~1 428 bp包含一個長度為1 416 bp的完整的開放閱讀框,該序列編碼471個氨基酸,起始密碼子和終止密碼子分別為ATG和TGA。電子克隆獲得的靈芝UDP-GlcDH基因序列及其編碼的氨基酸序列見圖1。

圖1 靈芝UDP-GlcDH基因cDNA序列及其編碼的氨基酸序列
提取靈芝mRNA,經過RT-PCR驗證,得到電泳圖,從圖2可知,電泳條帶與預計的1 416 bp相符。將PCR產物進行測序,結果也與電子克隆得到的基因相序列符,確定所克隆的基因確實為靈芝UDP-GlcDH基因。

圖2 RT-PCR電泳結果
2.2 蛋白質分析結果
2.2.1靈芝UDP-GlcDH蛋白的保守結構域預測與分析 利用NCBI中的conserved domain search 工具分析蛋白序列,結果見圖3,可以看出該蛋白的Specfic hits為UDPG_MGDP_dh_N、UDPG_MGDP_dh、UDPG_MGDP_dh_C,分別屬于F420_oxidored superfamily、UDPG_MGDP_dh和UDPG_MGDP_dh_C的超家族,是一個Multi domains蛋白,編號為PLN02353,是UDPglucose dehydrogenase。
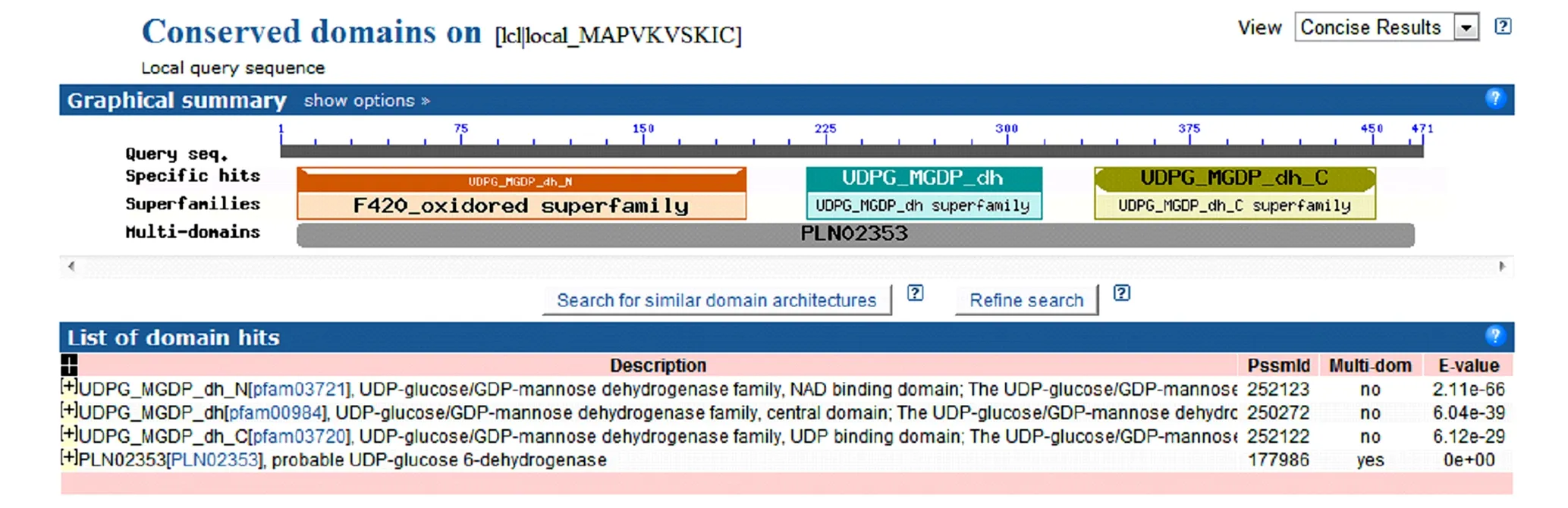
圖3 蛋白質的保守結構域預測結果
從上述結果可以得出,電子克隆出的序列所編碼的蛋白確為UDP glucose dehydrogenase,說明電子克隆的結果是準確的。
2.2.2蛋白質理化性質預測與分析 利用Protparam軟件對蛋白質的理化性質進行分析,得出該蛋白包含471個氨基酸,含有20種基本氨基酸,每種氨基酸的含量見表2。

表2 UDP-GlcDH蛋白的氨基酸含量
結果表明,該蛋白相對分子質量為51 764.4 Da,等電點為6.29。該蛋白中含量較高的氨基酸是Ala(A)11.0%和Val(V)9.1%,含量較低的是His(H)1.1%和Met(M)1.3%。另外,該蛋白含有55個帶負電荷的殘留物(天冬氨酸+谷氨酸),含有53個帶正電荷的殘留物(精氨酸+賴氨酸),其分子表達式為C2317H3683N627O685S15。
該蛋白質水溶液在280 nm處所有成對的半胱氨酸形成半胱氨酸吸光系數為59 400,吸光度為1.148,所有半胱氨酸藏殘留減少吸光系數58 900,吸光度為1.138。估計其半衰期在哺乳動物體內為30 h。不穩定系數(II)為25.52,是穩定蛋白。脂肪指數高達96.31,蛋白質流動性好,平均親水性為0.010,表明該蛋白總體上親水性和疏水性比較平衡。
2.2.3蛋白質親/疏水性預測與分析 利用ProtScale在線分析蛋白質親/疏水性,結果見圖4,可知波動在0上下,說明該蛋白質蛋白總體上親水性和疏水性比較平衡。
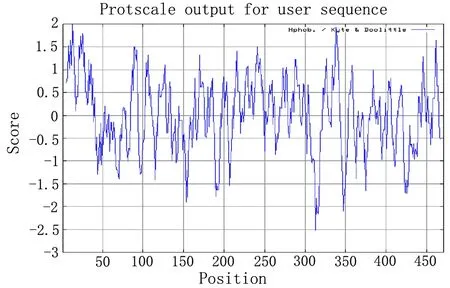
圖4 親/疏水性分析結果
2.2.4蛋白質信號肽預測和分析 采用SignalP 4.1 Server軟件預測靈芝UDP-GlcDH蛋白的信號肽,結果見圖5,根據馬爾可夫模型,由于C、S、Y峰值分別為0.166、0.157、0.288,均不達到0.5,沒有發現信號肽的存在,所以基本可以推測此蛋白不是分泌蛋白。
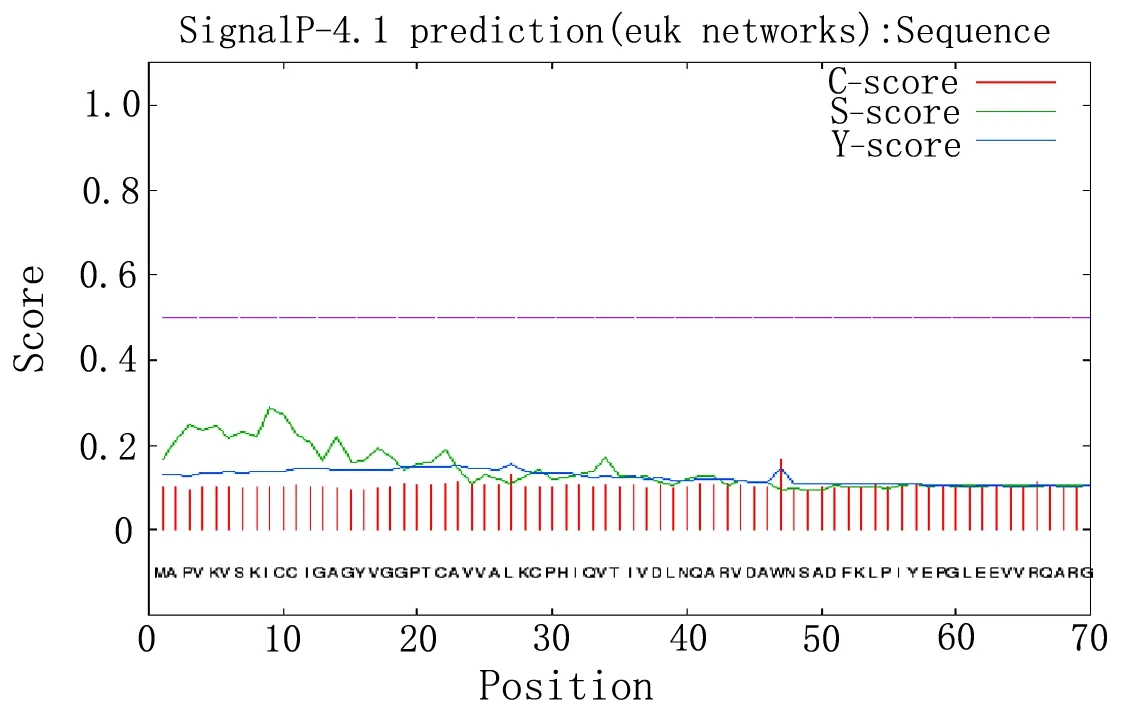
圖5 信號肽預測結果
2.2.5蛋白質亞細胞定位預測與分析 利用PSORT軟件,對蛋白質的亞細胞定位進行預測與分析,結果見表3,該蛋白質的亞細胞定位在內質網膜的概率最大。

表3 亞細胞定位預測結果
2.2.6蛋白質跨膜區域結構預測與分析 使用TMHMM在線預測工具對蛋白質進行跨膜分析,結果見圖6,在1.0處為細胞膜外分界線,0是細胞膜內,本試驗的UD-PGlcDH蛋白在此范圍內并無發現跨膜結構,其主要是胞內活動,與細胞質之外缺少關聯,其結果表明靈芝UDP-GlcDH蛋白不存在跨膜區。
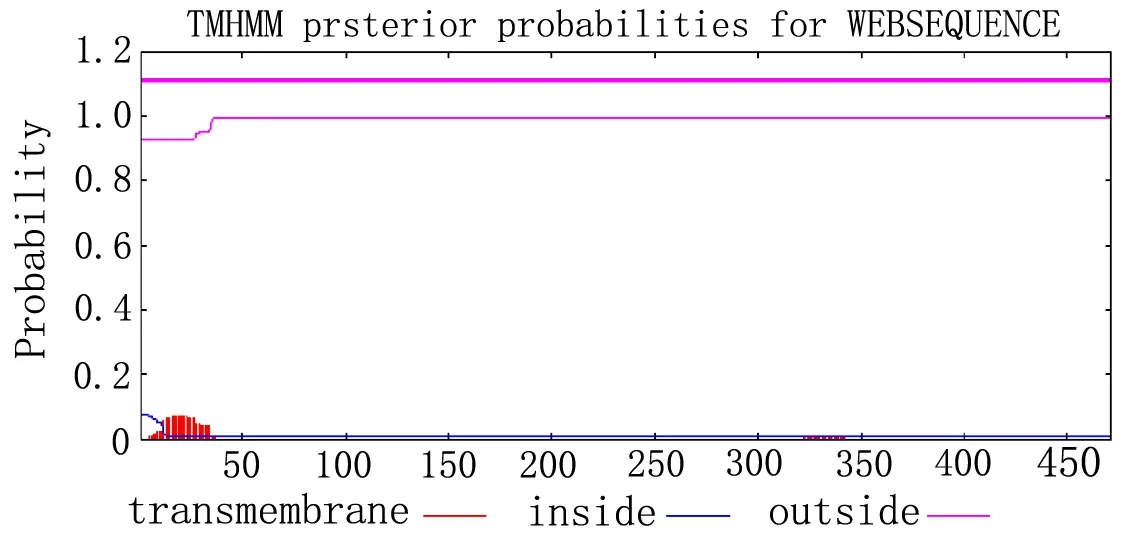
圖6 跨膜區域預測結果
2.2.7蛋白質二級結構預測與分析 使用GOR secondary structure prediction method version IV(GOR4)軟件對蛋白質二級結構進行預測與分析。
結果見圖7,可知其中無規則卷曲(random coil)的比例最高,為42.25%,其次是α螺旋(Alpha helix),占41.83%,而延伸鏈(extended strand)則只占15.92%。
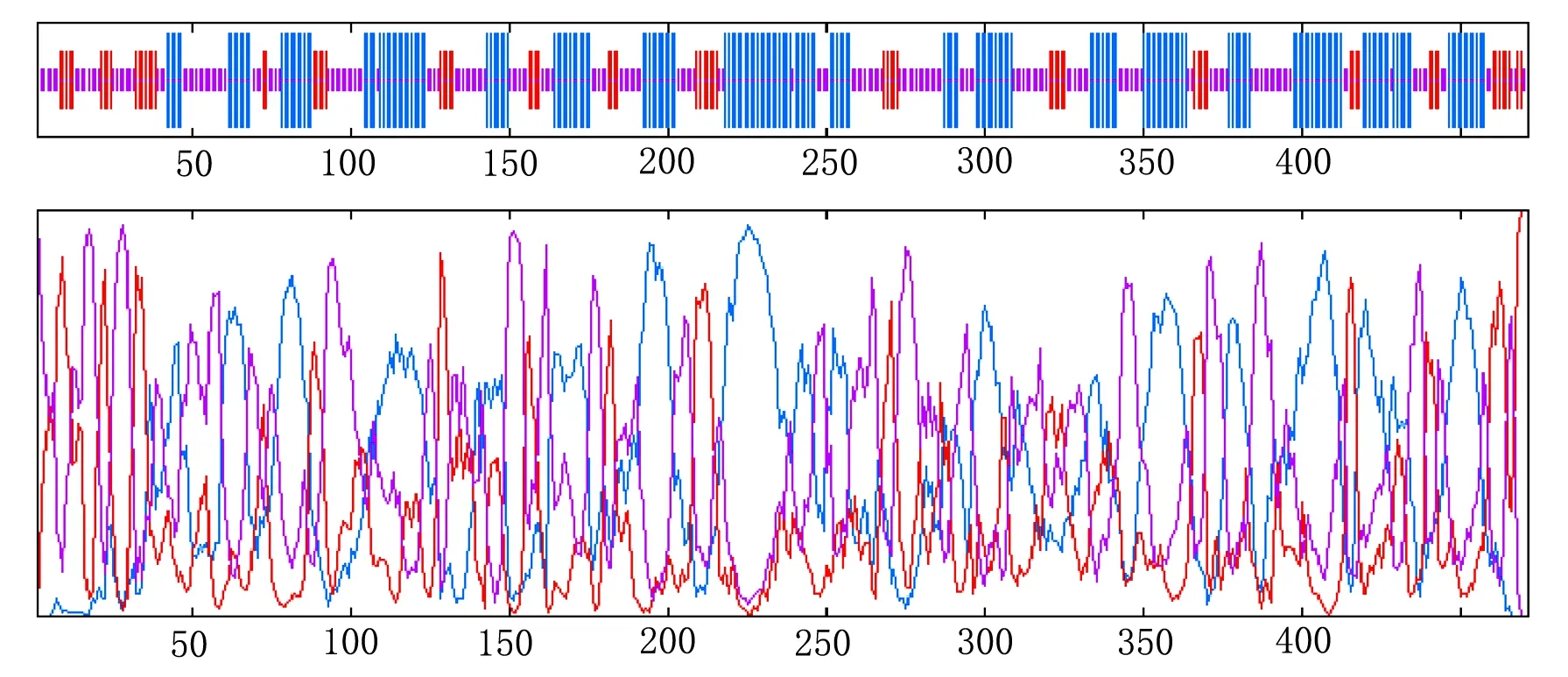
注:豎線從長到短依次為α螺旋、β折疊與轉角、隨機卷曲
2.2.8蛋白質三級結構預測與分析 采用SWISSMODEL 在線同源建模方法,對UDP-GlcDH蛋白進行分析,預測其三級結構,并利用3D Molecule Viewer 軟件查看該三維立體分子結構[5],見圖8,可知UDP-GlcDH蛋白的空間結構主要由無規則卷曲和α螺旋構成,延伸鏈數量比較少,這與二級結構所預測的結果相一致。
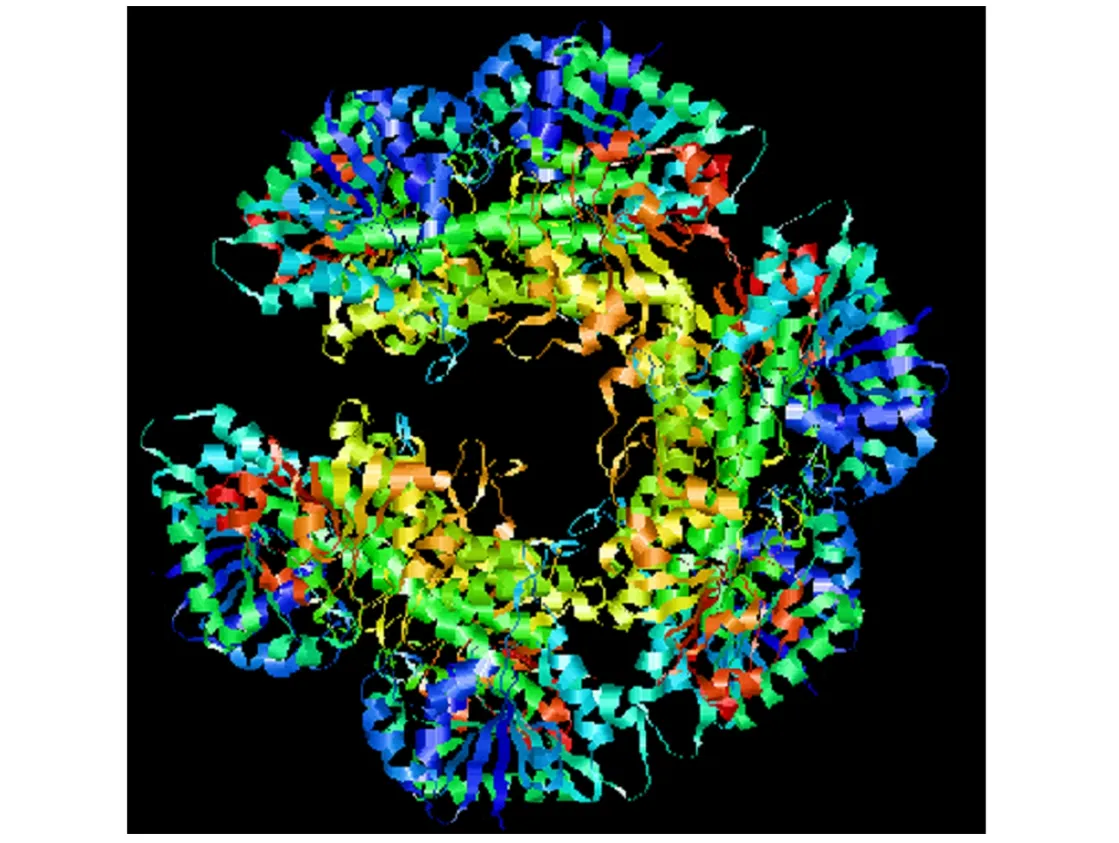
圖8 靈芝UDP-GlcDH蛋白的空間構象
2.2.9蛋白質進化樹分析 通過ORF finder數據庫BLAST出來的結果(圖9),選取同源性較高的15條序列,使用clustal X軟件和MEGA軟件進行靈芝UDP-GlcDH蛋白與15種高等真菌的系統進化樹分析,從圖9可知,本試驗拼接的UDP-GlcDH基因是靈芝UDP-GlcDH基因的家族成員,與污叉絲孔菌和云芝等真菌中的UDP-GlcDH基因編碼的氨基酸序列高度同源。

圖9 靈芝UDP-GlcDH蛋白與16種真菌的系統進化關系
3 結論
與傳統基因克隆方法相比,電子克隆具有高效、快速、針對性強、技術要求低等[6-7]。本研究使用的探針為黃曲霉的UDP-GlcDH序列,與靈芝的同源性較高,并且靈芝的ESTs序列比較豐富,目前已報道靈芝ESTs數量達到48 334條,本試驗采用電子克隆的可行性是很高的。
利用NCBI豐富的EST數據庫資源,以米黃霉的UDP-GlcDH蛋白質序列為探針,經BLAST相似性檢索和Bioedit軟件拼接得到靈芝UDP-GlcDH蛋白相應的基因序列,通過RT-PCR試驗進行驗證,其確實是靈芝的UDP-GlcDH序列。該cDNA序列長度為1 591 bp,其中包含能編碼471個氨基酸的序列,分子量為51.8 kD,PI為6.29,存在于內質網膜中,不屬于分泌蛋白,不存在跨膜區域,UDP-GlcDH蛋白的二級結構主要以無規則卷曲和α螺旋構成。系統進化樹分析可知,靈芝UDP-GlcDH基因的家族成員,與污叉絲孔菌和云芝等真菌中的UDP-GlcDH基因編碼的氨基酸序列高度同源,可見其在進化上相對比較保守,可能與該蛋白家族的功能有密切關系。本研究成功克隆了靈芝多糖合成途徑中關鍵酶之一的UDP-GlcDH基因序列,這為今后繼續研究靈芝多糖合成奠定了良好的基礎。

