胃癌組織高爾基體磷蛋白3蛋白表達與根治術后腫瘤復發的關系
劉中松
南陽南石醫院普外科,河南 南陽 473000
胃癌是指起源于胃黏膜上皮的消化道惡性腫瘤,在我國各種癌癥中發病率位居首位,死亡率已經超過世界平均水平的2倍[1]。調查指出[2],我國早期胃癌的占比僅為20%,5年總體生存率不足50%,嚴重威脅人們的生命。另有資料顯示[3],我國新診斷的實體瘤中根治術后1年復發率高達60%,而胃癌患者一旦復發,將會有80%的病例生存期不足5年。因此探討胃癌根治術后腫瘤復發的因素十分重要。高爾基體磷蛋白3(GOLPH-3)可激活細胞中雷帕霉素靶蛋白(mTOR)通路促進細胞增殖和生長,而mTOR通路的激活與胃癌等多種惡性腫瘤的發生密切相關[4]。據此推測GOLPH-3蛋白陽性表達很可能能夠參與胃癌的發生和發展,但其與根治術后腫瘤復發是否有關鮮見報道。基于此,本研究選取108例實施胃癌根治術的患者探討上述問題,旨在為胃癌根治術后復發的預防提供方向,現將結果報告如下。
1 資料與方法
1.1 一般資料
選取2018年2月—2019年10月南陽南石醫院收治的108例實施胃癌根治術的患者作為研究對象。納入標準:經活檢證實為胃癌患者;臨床病理特征明確,方便跟蹤隨訪,對本研究知情同意。排除標準:胃癌復發患者或其他部位惡性腫瘤轉移至胃部者;合并肝腎等嚴重器質性疾病者,有精神障礙者,不配合診療者;伴有嚴重外傷或急性感染性疾病者。108例患者中男81例,女27例;年齡34~80歲,平均年齡(59.58±10.25)歲;臨床分期:I期16例、II期70例、III期22例;分化程度:未/低分化42例,中/高分化66例;病理類型:腺癌48例、鱗癌29例、腺鱗癌19例、印戒細胞癌10例、未分化癌2例。
1.2 方法
GOLPH-3蛋白表達檢測:取手術切除的胃癌組織和邊緣正常組織采用免疫組化法檢測。將組織修剪為1mm3組織塊,置于中性福爾馬林溶液中固定,然后常規浸蠟、包埋、切片,脫蠟后以梯度濃度酒精水化并進行抗原熱修復。滴加一抗(購自Abcam中國公司),4℃過夜;滴加二抗(酶標記,購自Abcam中國公司),室溫30 min。滴加顯色劑,5 min后以自來水沖洗,蘇木素復染,3 min后以自來水沖洗,氨水反藍。脫水后二甲苯透明,封片后觀察。以無色、淡黃色、棕黃色、棕褐色分別評為0分、1分、2分、3分;以陽性細胞數<5%、≥5%且<25%、≥25%且<50%、≥50%且<75%、≥75%分別評分0分、1分、2分、3分、4分。計算二者乘積,結果≤1分記為GOLPH-3蛋白陰性表達,否則記為陽性表達[5]。
1.3 觀察指標
(1)對比胃癌組織和邊緣正常組織GOLPH-3蛋白陽性表達率。(2)對比復發和未復發患者胃癌組織GOLPH-3蛋白陽性表達率:隨訪1年,隨訪方式為門診或電話等。(3)分析胃癌組織GOLPH-3蛋白陽性表達與胃癌根治術后腫瘤復發的關系,可能影響后者的因素包括性別、年齡、臨床分期、分化程度、胃癌組織GOLPH-3蛋白陽性表達、術后規范放化療、中醫藥輔助治療等。
1.4 統計學方法
采用SPSS 24.0軟件進行統計分析。計量資料以均數±標準差(±s)表示,組間比較采用t檢驗。計數資料以例數和百分比(%)表示,組間比較采用χ2檢驗。采用COX模型分析胃癌根治術后腫瘤復發的危險因素。以P<0.05為差異有統計學意義。
2 結果
2.1 胃癌組織和邊緣正常組織GOLPH-3蛋白陽性表達率情況
108例胃癌患者有1例意外死亡,有2例主動放棄治療,有3例轉院,均剔除本研究。胃癌組織GOLPH-3蛋白陽性表達率為78.43%(80/102),高于邊緣正常組織的55.88%(57/102)(χ2=11.757,P=0.001),見表1。

表1 胃癌組織和邊緣正常組織GOLPH-3蛋白陽性表達率情況 例(%)
2.2 復發與未復發患者胃癌組織GOLPH-3蛋白陽性表達率情況
102例胃癌患者隨訪1年內共有39例復發,復發率為38.24%(39/102)。復發患者的胃癌組織GOLPH-3蛋白陽性表達率高于未復發患者,差異有統計學意義(P<0.05),見表2。

表2 復發與未復發患者胃癌組織GOLPH-3蛋白陽性表達率情況 例(%)
2.3 胃癌組織GOLPH-3蛋白陽性表達與胃癌根治術后腫瘤復發的關系分析
COX模型單因素和多因素分析結果均顯示,III期、未/低分化、胃癌組織GOLPH-3蛋白陽性表達均是胃癌根治術后腫瘤復發的獨立危險因素,差異有統計學意義(P<0.05),術后規范放化療、中醫藥輔助治療則是胃癌根治術后腫瘤復發的保護因素,差異有統計學意義(P<0.05),見表3、表4。

表3 單因素分析
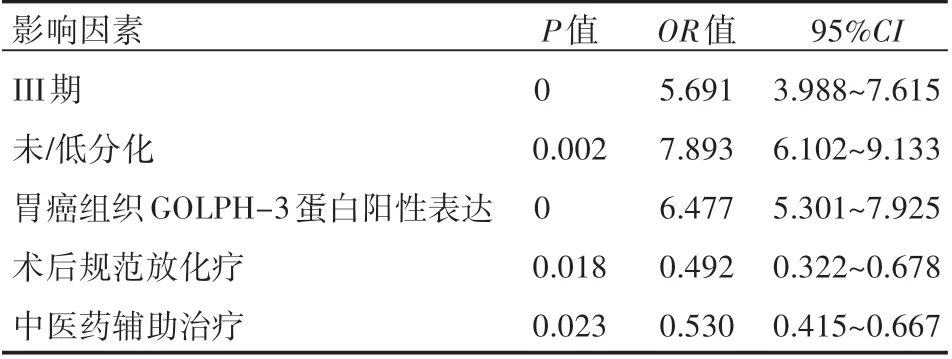
表4 多因素分析
3 討論
胃癌的發生與不健康飲食習慣、致癌物質接觸、幽門螺旋桿菌感染及遺傳因素等均有關。有研究顯示[6],基因突變和蛋白表達異常是胃癌發生和發展的病理基礎,尤其是參與細胞增殖、生長、分化、凋亡等調控的通路異常表達可促使細胞大量增殖而凋亡減少,還可增強細胞的侵襲和遷移能力,誘發胃癌并促使腫瘤浸潤和轉移。由此可知調控細胞生物學活性的蛋白表達異常可能參與胃癌預后效果不良。然而目前人們對胃癌發生和發展的機制認識尚不明確,影響胃癌根治術后腫瘤復發的分子機制也仍需要深入研究。
GOLPH-3屬于一種磷酸化高爾基體膜蛋白,可參與執行高爾基體的蛋白質分選。該蛋白是第一個被發現定位于反面高爾基網并被證實具有強大轉化能力的癌基因[7]。在既往相關報道中發現在胃癌、甲狀腺乳頭狀癌、膽囊癌等組織中GOLPH-3蛋白陽性表達率均高于癌旁組織[8-10],本研究中胃癌組織GOLPH-3蛋白陽性表達率也高于邊緣正常組織,與上述研究結果相符,推測GOLPH-3蛋白高表達很可能參與胃癌的發生。GOLPH-3與高爾基體反面的基質動態相連,可快速從反面高爾基體管網狀結構向細胞質移動,且在此過程中可參與蛋白糖基化,促進細胞生長和增殖,最終可打破細胞增殖和凋亡平衡,參與惡性腫瘤的發生。有研究[11]顯示,胃癌組織GOLPH-3蛋白表達與組織分化、臨床分期、淋巴結轉、浸潤程度均有關,且該蛋白陽性表達率越高,組織分化程度越低,臨床分期越高,淋巴結轉移的風險也越高,浸潤程度也越嚴重,因此可用高蛋白陽性表達率評價胃癌組織的惡性程度,推測預后不良的發生幾率。本研究中胃癌患者術后1年復發率38.24%,與既往報道的水平基本一致,證實胃癌根治術后復發的風險高;胃癌復發患者胃癌組織GOLPH-3蛋白陽性表達率高于未復發患者,提示胃癌組織GOLPH蛋白陽性表達可能與胃癌患者根治術后復發的風險有關。本研究單因素和多因素分結果均顯示胃癌組織GOLPH-3蛋白陽性表達是胃癌根治術后腫瘤復發的危險因素,提示蛋白陽性表達的確可增加胃癌腫瘤復發的風險。
本研究還發現,III期、未/低分化也均是胃癌根治術后腫瘤復發的獨立危險因素,術后規范放化療、中醫藥輔助治療則是其保護因素,與既往相關報道結果一致[12-13]。但也有報道[14]顯示,淋巴結轉移、腫瘤浸潤、病理類型是胃癌根治術后復發的影響因素,本研究未探討上述因素的影響,主要是因為淋巴結轉移、腫瘤浸潤與臨床分期不相互獨立,病理類型與腫瘤分化程度不相互獨立。根據上述研究結果,建議對III期、未/低分化的胃癌患者加強監控,對所有胃癌根治術后患者實施規范放化療,必要時配合中醫藥治療以降低胃癌根治術后復發的風險。
綜上所述,胃癌組織GOLPH-3蛋白陽性表達率高,根治術后腫瘤復發的風險也高,且胃癌根治術后腫瘤復發患者的胃癌組織GOLPH-3蛋白陽性表達率更高,III期、未/低分化、胃癌組織GOLPH-3蛋白陽性表達均是胃癌根治術后腫瘤復發的獨立危險因素,術后規范放化療、中醫藥輔助治療則是其保護因素,建議對有危險因素加強防控,并積極配合實施術后規范放化療、中醫藥輔助治療。另外GOLPH-3蛋白可能參與胃癌的發生和發展,而是否可作為臨床治療的新靶點仍待進一步研究探討。

