腫瘤壞死因子α對星形膠質細胞激活表型的影響
張丹陽,謝俊霞,王俊
(青島大學基礎醫學院生理學教研室,山東 青島 266071)
帕金森病(PD)是一種常見的神經退行性疾病[1]。有研究表明,神經炎癥在PD中發揮重要作用[2]。星形膠質細胞是哺乳動物腦內分布最廣泛的一類細胞[3]。生理狀態下,星形膠質細胞參與血-腦脊液屏障的生成和維持,分泌神經營養因子來調節突觸發生、神經元分化和神經元存活,通常以膠質纖維酸性蛋白(GFAP)作為活化標志物[4]。病理狀態下,星形膠質細胞可由靜息狀態轉變為激活狀態,加劇或減弱損傷[5-6]。根據作用的不同,可將星形膠質細胞分為具有促炎作用的A1型和具有抗炎作用的A2型[7]。補體成分3(C3)在A1型星形膠質細胞中高表達,可以作為A1型細胞的標志物,同理Pentraxin 3(PTX3)可以作為A2型細胞的標志物[7-9]。中樞神經系統存在包括腫瘤壞死因子α(TNF-α)在內的多種細胞因子,對星形膠質細胞具有復雜的影響。本實驗旨在研究經細胞因子TNF-α處理后星形膠質細胞的激活表型,探討TNF-α在星形膠質細胞激活中的作用。
1 材料和方法
1.1 實驗材料
原代培養的星形膠質細胞(從出生24 h以內的大鼠乳鼠中腦獲取),DMEM/F1基礎培養液、胰蛋白酶(美國Hyclone公司),胎牛血清(PBS,中國依科賽生物科技(太倉)有限公司),青霉素-鏈霉素溶液、CCK-8試劑盒(中國北京索萊寶科技有限公司),D-多聚賴氨酸、大鼠TNF-α(美國Sigma公司),大鼠GAPDH、C3、PTX3基因引物(Takara公司,引物序列見表1),一步法總RNA提取試劑Trizol(Invitrogen公司),逆轉錄試劑盒(美國賽默飛公司),熒光定量PCR試劑盒(德國QIAGEN公司)。
1.2 星形膠質細胞的原代培養
實驗前將實驗器具高壓滅菌。150 cm2細胞培養瓶用D-多聚賴氨酸處理過夜,再用高壓滅菌去離子水清洗3次備用。取兩個玻璃培養皿,每皿中加入10~15 mL基礎培養液,置于冰上。取出生24 h內大鼠乳鼠,用體積分數0.75醫用乙醇消毒,斷頸取頭,在解剖顯微鏡下用眼科剪和眼科鑷取中腦置培養皿中,先后使用1 000 μL和200 μL移液槍將組織塊輕輕吹打至消散,加3 mL胰蛋白酶吹打約10次,加3.5 mL完全培養液終止消化,將其吸至50 mL離心管中,以1 000 r/min離心5 min。棄上清,用完全培養液重懸沉淀,將其接種于培養瓶中,置37 ℃、含體積分數0.05 CO2的培養箱中培養。培養14 d后,將細胞培養瓶封口后固定于空氣浴恒溫搖床上,以220 r/min劇烈振蕩16 h。棄上清液,每個培養瓶中加入10 mL胰蛋白酶,置于37 ℃消化1 min,再加入等量完全培養液終止消化,使用一次性滅菌塑料吸管將培養瓶底部的細胞吹打下來,將培養液收集到離心管中,以1 000 r/min離心5 min。棄上清,加入完全培養液重懸沉淀,將細胞接種于孔板或培養瓶中。

表1 PCR引物序列
1.3 CCK-8法檢測TNF-α對星形膠質細胞活性的影響
TNF-α濃度梯度分別為0、5、10、20、40、80 μg/L,實驗操作與數據處理按照試劑盒說明書進行。
1.4 實驗分組及處理
實驗分為對照組和TNF-α處理組。將原代培養的星形膠質細胞接種于6孔板中,每孔2 mL細胞懸液;第2天分組處理細胞,將兩組細胞培養液均換成基礎培養液,TNF-α處理組用TNF-α(10 μg/L)處理,置于37 ℃、含體積分數0.05 CO2的培養箱中孵育24 h。
1.5 實時熒光定量PCR(qPCR)檢測C3和PTX3 mRNA表達
向6孔板每孔中加入1 mL Trizol,冰上靜置5 min,用1 mL槍頭吹打貼附在板底的星形膠質細胞,用移液槍移入預先標記好的1.5 mL脫酶EP管中,向每管中加入200 μL氯仿,劇烈振蕩混勻后,于冰上靜置5 min,在4 ℃下以12 000 r/min離心15 min。吸取400 μL上層水相,移至另一預先標記好的1.5 mL脫酶EP管中,向每管中加入400 μL異丙醇,輕輕顛倒混勻,冰上靜置10 min,在4 ℃下以12 000 r/min離心10 min。棄上清,加入DEPC水和無水乙醇配制的體積分數為0.75乙醇溶液1 mL,在4 ℃下以12 000 r/min離心10 min。棄上清,自然干燥沉淀,每孔加入10 μL DEPC水溶解RNA,置56 ℃干燥箱中10 min,于冰上靜置。測定RNA濃度與光密度(OD)值,OD260/OD280在1.8~2.0之間,表示樣品無污染。根據逆轉錄試劑盒說明進行逆轉錄,得到cDNA。再根據熒光定量PCR試劑盒說明進行qPCR。結果以2-△△ct值表示。
1.6 統計學處理
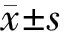
2 結 果
2.1 TNF-α對星形膠質細胞活性的影響
不同濃度(0、5、10、20、40、80 μg/L)的TNF-α作用于星形膠質細胞24 h以后,細胞活力分別為1.025±0.121、1.019±0.084、1.073±0.180、1.021±0.060、1.051±0.115、0.719±0.112(n=6),差異有統計學意義(F=11.69,P<0.001)。其中5、10、20、40 μg/L TNF-α處理組細胞活力與0 μg/L TNF-α處理組相比較無明顯變化(q=0.100~1.248,P>0.05);80 μg/L TNF-α作用于星形膠質細胞后,細胞活力下降明顯,與0 μg/L TNF-α處理組比較差異有統計學意義(q=7.932,P<0.001)。故本實驗采用10 μg/L濃度的TNF-α進行細胞處理。
2.2 TNF-α對星形膠質細胞C3 mRNA表達影響
TNF-α處理組和對照組細胞內C3mRNA表達水平分別為30.410±17.872和1.003±0.081(n=6),TNF-α處理組較對照組明顯升高,差異有統計學意義(t=3.679,P<0.01)。
2.3 TNF-α對星形膠質細胞PTX3表達影響
TNF-α處理組和對照組細胞內PTX3mRNA表達水平分別為0.476±0.261和1.010±0.140(n=6),TNF-α處理組較對照組明顯降低,差異有統計學意義(t=4.026,P<0.01)。
3 討 論
腦發生損傷和疾病后,反應性星形膠質細胞增多,形成膠質瘢痕[6,10]。在對各種神經退行性疾病病人的尸檢中,觀察到病灶腦區存在大量A1型星形膠質細胞[7]。既往有研究結果表明,A1型星形膠質細胞對神經元和少突膠質細胞具有殺傷作用,這種神經毒性與A1型星形膠質細胞分泌的脂蛋白有關[7,11]。A2型星形膠質細胞具有促進神經元存活與組織修復作用,常由缺血誘導,在正常生理條件下,處于靜息狀態的星形膠質細胞的表型更接近于A2型[12-13]。
PD是第二常見的神經退行性疾病[1]。研究表明,在脂多糖制備的炎癥模型中,小膠質細胞首先被激活,釋放多種細胞因子,其中TNF-α、白細胞介素1α和補體成分1q將星形膠質細胞激活為促炎的A1型[7]。在1-甲基-4-苯基-1,2,3,6-四氫吡啶制備的PD動物模型中,觀察到中樞神經系統處于長期炎癥狀態[14]。在PD病程中,神經炎癥持續存在,神經炎癥導致星形膠質細胞向A1型轉變,其產生的神經毒性可導致多巴胺能神經元死亡,而黑質多巴胺能神經元缺失是PD的主要病理特征之一。因此,推測神經炎癥在PD發病早期起重要作用。
體內環境中,存在多種細胞因子同時作用,其作用機制復雜,無法觀察到某一細胞因子的具體作用。本實驗以原代培養的星形膠質細胞作為實驗對象,用10 μg/L的TNF-α處理,觀察單一細胞因子對星形膠質細胞激活狀態的影響。TNF-α在中樞神經系統中主要由小膠質細胞和星形膠質細胞分泌,通過核因子κB引發細胞后續反應[15-17]。C3為A1型星形膠質細胞的標記物,其表達增加提示星形膠質細胞被激活為促炎狀態,而PTX3是A2型星形膠質細胞的標記物,其表達增加提示星形膠質細胞被激活為抗炎狀態。本實驗結果顯示,在TNF-α單獨作用下,原代培養的星形膠質細胞內C3表達較對照組明顯升高,而PTX3表達水平較對照組明顯降低,差異具有統計學意義。提示在TNF-α作用下,星形膠質細胞被激活為A1型。本研究結果為細胞因子在調控星形膠質細胞激活狀態中的作用提供了新的證據。

