α-突觸核蛋白高表達對PC12細胞ferroportin、鐵調節蛋白1和鐵調素表達的影響
王雪,宓曉晴,宋寧
(青島大學醫學部基礎醫學院生理學與病理生理學系,山東 青島 266071)
帕金森病(PD)是一種緩慢進展的神經退行性疾病,以運動障礙、肌僵直、靜止性震顫及姿勢反射障礙等為特征性表現,其主要病理學特征是黑質致密部多巴胺能神經元的丟失以及紋狀體多巴胺釋放減少[1-5]。PD病因涉及遺傳、環境和衰老等多種因素,但確切病因尚不完全清楚[6]。α-突觸核蛋白(α-Syn)聚集體構成的路易小體廣泛存在于PD受損的多巴胺能神經元中,被認為是PD發病機制的關鍵因素。α-Syn是由140個氨基酸組成的蛋白,以分子伴侶的形式參與多項生理功能,但其聚集體會導致線粒體功能障礙,誘發內質網應激,破壞內質網-高爾基體轉運等[7-10]。鐵是人體必需的微量元素之一,其缺乏會導致細胞死亡,但過量的鐵也具有細胞毒性[11-16]。鐵會隨著年齡的增加沉積于黑質等腦區,但是這種現象在PD中尤為嚴重。細胞內的鐵通過ferroportin(FPN)從細胞中轉出。FPN是一種跨膜的鐵轉出蛋白,是目前唯一已知的細胞內鐵釋放的通路,主要受鐵調節蛋白和鐵調素調節[17]。近年來大量研究表明,細胞內鐵沉積和α-Syn聚集存在緊密的相互作用,共同參與多巴胺能神經元損傷,并可能導致PD病理的惡性循環[18]。α-Syn調控鐵代謝的機制尚未闡明,本實驗旨在探究α-Syn高表達對PC12細胞FPN、鐵調節蛋白1(IRP1)蛋白表達和鐵調素mRNA水平的影響。
1 材料與方法
1.1 實驗細胞及主要試劑
PC12細胞由英國劍橋醫學研究所醫學遺傳系David C. Rubinsztein教授饋贈。該細胞攜帶人源野生型(WT)α-Syn基因,在NheⅠ/SalⅠ位點將該基因插入pTRE2hyg載體,并在該載體中插入調控轉基因表達的多西環素(DOX)開關。DMEM高糖培養液、胎牛血清和馬血清均購于美國Gibco公司,DOX購于美國Sigma公司;α-Syn抗體購于美國CST公司,FPN抗體購于以色列Alomonelabs公司,IRP1抗體購于英國Abcam公司,兔抗β-actin購于中國博奧森公司,羊抗兔IgG購于中國愛必信公司;TRIzol和PCR逆轉錄試劑盒購于美國Thermo Fisher公司,SYBR Green購于美國QIAGEN公司,鐵調素引物購于中國Takara公司。
1.2 細胞分組與處理
將PC12細胞用完全培養液(DMEM高糖培養液168.9 mL、胎牛血清10.0 mL、馬血清20.0 mL、潮霉素B 0.3 mL、G418 0.8 mL)重懸后,以3×108/L的密度接種于6孔板內,每孔2 mL,當細胞融合達到80%左右時將其分為對照組和DOX處理組,分別用基礎培養液(DMEM高糖培養液)和2 mg/L的DOX處理24 h。共進行3次獨立實驗。
1.3 免疫印跡法檢測α-Syn、FPN和IRP1蛋白的表達
藥物處理24 h后,使用RIPA裂解液提取蛋白,應用BCA試劑盒檢測提取蛋白的濃度,按照每孔20 μg計算上樣量,加入Loading Buffer,95 ℃加熱蛋白5 min,將蛋白樣本進行電泳(電壓為80 V和120 V),然后將蛋白轉移至PDVF膜上(電流為300 mA)。用50 g/L的牛血清清蛋白封閉2 h后分別加入α-Syn、FPN、IRP1、β-actin一抗,于4 ℃搖床上孵育過夜。用TBST洗30 min后加入二抗室溫孵育1 h,以TBST洗30 min后應用ECL發光液顯影。應用Image J軟件進行分析,α-Syn、FPN和IRP1蛋白表達水平以三者與β-actin灰度值之比來表示。
1.4 實時熒光定量PCR檢測鐵調素mRNA表達
每1 mL TRIzol試劑裂解的樣品中加入0.2 mL的氯仿室溫孵育2~3 min,于4 ℃下以12 000 r/min離心15 min。取上層水相并加入異丙醇,以上述同樣條件離心10 min,用體積分數0.75的乙醇清洗后,使用反轉錄試劑盒進行反轉錄合成cDNA。采用SYBR Green染料法定量檢測基因的表達。按照說明書進行PCR體系循環擴增,使用2-ΔΔCt法計算目的基因相對于內參照基因GAPDH的表達量。PCR引物序列見表1。
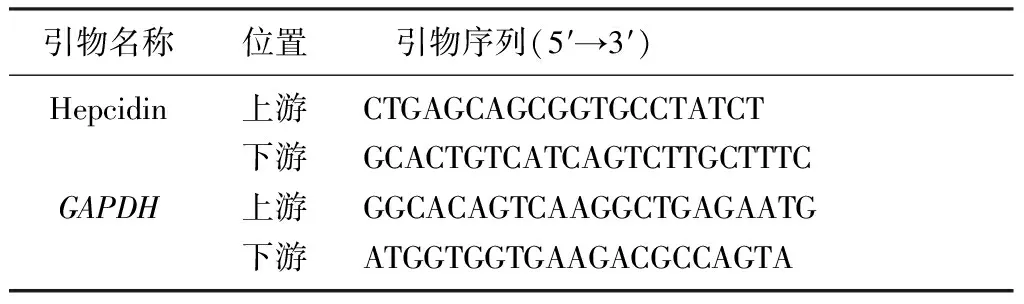
表1 PCR引物序列
1.5 統計學處理
2 結 果
2.1 DOX對PC12細胞α-Syn表達的影響
對照組和DOX處理組細胞內α-Syn蛋白表達水平分別為1.001±0.331和2.851±0.137(n=6),DOX處理組α-Syn蛋白表達水平是對照組的2.85倍,差異有統計學意義(t=5.245,P<0.05)。
2.2 α-Syn 高表達對PC12細胞FPN和IRP1蛋白表達的影響
對照組和DOX處理組細胞內FPN蛋白表達水平分別為1.000±0.032和0.993±0.063(n=6),IRP1蛋白表達水平分別為0.998±0.107和0.965±0.042(n=6),DOX處理組細胞內FPN蛋白表達水平是對照組的99.3%,IRP1蛋白表達水平是對照組的96.9%,DOX處理組FPN和IRP1蛋白表達水平與對照組比較沒有明顯變化,差異無顯著意義(t=0.092、0.268,P>0.05)。
2.3 α-Syn高表達對PC12細胞鐵調素mRNA水平的影響
對照組和DOX處理組細胞內鐵調素mRNA表達水平分別為1.003±0.044和1.365±0.069(n=5),DOX處理組鐵調素mRNA表達水平較對照組升高36.1%,差異有統計學意義(t=4.162,P<0.05)。
3 討 論
鐵是維持神經結構和功能所必需的微量元素之一。然而,在PD病人的黑質致密部觀察到鐵特異性地沉積,部分多巴胺能神經元觀察到鐵水平升高[17,19]。在生理條件下,鐵參與了多巴胺的合成;然而,過量的鐵誘導產生活性氧(ROS),會導致脂質、蛋白質和DNA的不可逆損傷[20]。在黑質致密帶幸存的多巴胺能神經元的路易小體中,鐵染色最為明顯,證明鐵與α-Syn的大量共同存在,提示鐵沉積和α-Syn聚集密切相關[21]。已有文獻報道了α-Syn對鐵代謝的影響,例如α-Syn可以結合三價鐵和二價鐵形成α-Syn-鐵絡合物[22]。此外,α-Syn具有鐵還原酶的作用,可催化三價鐵還原為二價鐵,過量的α-Syn導致細胞內鐵水平增加和三價鐵、二價鐵的比例失調[23]。最近有研究表明,在高表達α-Syn的SH-SY5Y細胞和A53Tα-Syn轉基因小鼠中,α-Syn可以上調鐵轉入蛋白二價金屬離子轉運體(DMT1)的表達且不依賴鐵反應元件(IRE)/IRP1系統,可能與泛素-蛋白酶體的降解異常有關,這可能導致了α-Syn高表達時細胞內鐵沉積[24]。目前,α-Syn對鐵轉出蛋白FPN的表達影響尚不清楚。本實驗觀察到,PC12細胞α-Syn高表達時其FPN表達沒有發生明顯變化,說明α-Syn高表達時出現的泛素-蛋白酶體降解異常并不足以調控FPN表達變化。
FPN的表達主要受到鐵調節蛋白和鐵調素的調控。FPNmRNA 5′端非編碼區含有一個IRE,在細胞內高鐵的情況下,IRE與鐵調節蛋白的結合減少,因此對FPNmRNA翻譯的抑制減弱,導致FPN蛋白表達增多[25-26]。與鐵調節蛋白2(IRP2)相比,IRP1與IRE的親和力更高[27]。本文研究結果顯示,PC12細胞內α-Syn高表達對FPN和IRP1蛋白的表達均沒有明顯影響。我們推測,在α-Syn高表達的細胞中,雖然文獻報道DMT1表達上調,但細胞外液中鐵水平較低,并沒有造成細胞內鐵沉積,因此也不會導致IRP1和FPN的表達變化。
鐵調素是一種由肝臟合成和分泌的小多肽,被認為是人體鐵穩態的主要調節者。鐵調素通過與細胞膜上的鐵轉出蛋白FPN結合誘導其泛素化從而導致FPN內化和降解,以此來控制FPN在膜上的表達和細胞的鐵釋放[28-29]。本研究結果顯示,高表達α-Syn的PC12細胞中鐵調素mRNA水平上調。有文獻報道,α-Syn可激活核因子κB(NF-κB)信號傳導通路釋放白細胞介素6,后者可以通過信號轉導和轉錄激活促進鐵調素的轉錄[30-31]。因此我們推測,鐵調素表達上調與細胞內α-Syn蓄積有關,但具體機制需進一步證實。雖然鐵調素表達上調,但本實驗并沒有觀察到FPN的表達變化,這與鐵調素的作用具有組織細胞特異性的報道相一致,例如在腸細胞中,鐵調素不會改變FPN水平但會降低DMT1的表達[24,32-33]。由于鐵調素分子量只有9 000,很難用常規免疫印跡方法檢測其蛋白水平,因此其蛋白水平是否發生變化尚無法確定。此外,DOX處理誘導α-Syn過表達雖然引起了鐵調素mRNA表達水平上調,但其時間(只有24 h)和表達量(約1.5倍)可能并不足以造成α-Syn異常聚集和調控FPN表達變化。
綜上所述,在PC12細胞中,高表達α-Syn 24 h對鐵轉出蛋白FPN和鐵調節蛋白IRP1表達均無明顯影響,但可顯著上調鐵調素的表達水平。本文結果為α-Syn調控細胞內鐵代謝提供了實驗依據。

