MPP+對N2a細胞中CDR1as基因表達的影響
張小琴,王友翠,謝俊霞
(青島大學基礎醫學院生理學與病理生理學系,山東 青島 266071)
帕金森病(PD)是僅次于阿爾茨海默病的第二大神經退行性疾病[1-9]。PD主要的病理特征是中腦黑質多巴胺(DA)能神經元大量變性丟失,導致紋狀體內DA含量減少,而變性丟失的 DA能神經元內均出現α-突觸核蛋白積聚[10-13]。環狀RNA是一類不具有5′末端帽子和3′末端 poly(A)尾巴、以共價鍵形成環形結構的RNA分子。由于呈閉合環狀結構,對核酸外切酶不敏感,因此環狀RNA比線性RNA更為穩定,且具有物種保守性、組織時序性及疾病表達特異性[14-20]。有文獻報道,環狀RNA小腦變性相關蛋白1反義轉錄物(CDR1as)可作為miR-7海綿調控miR-7靶基因的表達[21-22]。已有研究表明,α-突觸核蛋白基因的拷貝增加或點突變均可導致α-突觸核蛋白積聚,從而引發PD[23-24]。而miR-7可以與α-突觸核蛋白基因編碼 mRNA的3′UTR 區相互作用,從而抑制其翻譯[25-26]。這提示作為miR-7海綿的CDR1as基因可能參與了DA能神經元的變性丟失。因此,闡明CDR1as基因在PD中發揮的作用至關重要。本研究旨在探討經1-甲基-4-苯基吡啶離子(MPP+)處理的PD細胞模型中CDR1as基因的表達變化。
1 材料與方法
1.1 主要試劑及其來源
MPP+(M0896)由美國Sigma公司提供,用雙蒸水稀釋至10 mmol/L,分裝,-20 ℃避光保存;DMEM高糖基礎培養液(01-052-1ACS)購自BI公司;TRIzol購自ambion公司;PCR逆轉錄試劑盒(AG11711)和SYBR Green(AG11702)購自艾科瑞生物公司;胎牛血清(澳洲源,FND500)購自依科賽公司;青霉素和鏈霉素混合雙抗液(F1400)購自索萊寶公司。
1.2 細胞培養
小鼠神經母細胞瘤N2a細胞培養于含體積分數0.05胎牛血清、100 kU/L青霉素和100 mg/L鏈霉素混合雙抗的DMEM高糖培養液中,在37 ℃、體積分數0.05 CO2條件下培養。
1.3 四甲基偶氮唑鹽(MTT)法檢測細胞活力
將N2a細胞接種于96孔板中,每孔細胞懸液200 μL(細胞數為8×104個),培養24 h后,棄上清,對照組直接加入新鮮基礎培養液,MPP+組加入終濃度為100 μmol/L的MPP+,分別處理3、6、9和12 h。細胞處理結束后,每孔加入5 g/L的MTT 20 μL,培養4 h后取出培養板,棄上清,每孔加入100 μL的二甲基亞砜(DMSO),振蕩10 min。用酶標儀檢測波長570 nm處的吸光度(A)值,計算細胞存活率。
1.4 實時熒光定量PCR(RT-PCR)檢測CDR1as基因表達
將傳代N2a細胞接種于12孔板,分為對照組(A組)和100 μmol/L MPP+處理3、6、9、12 h組(B、C、D、E組)。采用TRIzol法冰上裂解各組細胞5 min。按照PCR逆轉錄試劑說明書操作,提取細胞總RNA。取1 μg的總RNA,加入1 μL gDNA Clean Reagent、2 μL 5×gDNA Clean Buffer,用RNA free water補至10 μL,42 ℃變性2 min;隨后向上述反應體系中加入Evo M-MLV RTase Enzyme Mix 1 μL、RT Primer Mix 1 μL、5×RTase Reaction Buffer Mix Ⅰ 4 μL、RNA free water 4 μL,37 ℃作用15 min,繼以85 ℃、5 s逆轉錄合成cDNA。采用SYBR Green染料法相對定量測定CDR1as基因的表達。RT-PCR 檢測所用引物及其序列見表1。應用2-ΔΔCt方法計算目的基因相對表達量。
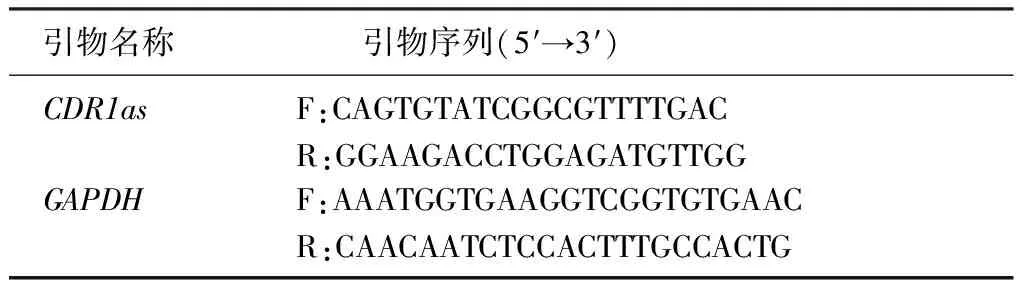
表1 RT-PCR檢測所用引物序列
1.5 統計學處理
2 結 果
2.1 MPP+作用不同時間對N2a細胞存活率影響
與對照組相比較,經100 μmol/L MPP+作用3、6、9和12 h的N2a細胞存活率均有明顯下降,差異具有統計學意義(t=2.283~11.430,P<0.05)。見表2。
表2 MPP+處理不同時間對N2a細胞存活率的影響
2.2 MPP+作用不同時間后N2a細胞中CDR1as基因的表達變化
RT-PCR檢測結果顯示,A、B、C、D、E組N2a細胞中CDR1as基因的表達水平分別為1.070±0.338、0.207±0.034、0.290±0.039、0.354±0.121和0.368±0.137(n=6)。與對照組比,經100 μmol/L MPP+作用3、6、9和12 h的N2a細胞CDR1as基因表達水平明顯降低,差異均具有顯著意義(F=10.010,q=7.003~8.609,P<0.05)。
3 討 論
PD是世界上第二大常見的神經退行性疾病,隨著人口老齡化加劇,發病人數逐年增加[1-9]。PD主要病理學特征是黑質區DA能神經元進行性丟失,紋狀體DA含量降低。臨床上主要表現為肌僵直、靜止性震顫、姿勢不穩、運動遲緩,影響了病人的生活質量[27]。左旋多巴是治療PD的常用藥物,但大多數病人長期服用左旋多巴后出現不自主運動、認知障礙、癡呆等副作用[28]。因此,尋找新的治療靶點具有重要的意義。近期研究發現,CDR1as參與PD的發病進程,但其確切的機制尚未闡明。
研究表明,CDR1as基因在人和小鼠腦組織中可有效地環化,而檢測不到線性CDR1as[29]。人源CDR1as基因序列含有74個miR-7結合位點,小鼠CDR1as基因序列含有130個miR-7結合位點,且在不同物種間高度保守[21-22,29]。CDR1as與miR-7共同高表達于腦組織神經元的胞體和突起,在小腦、中腦、海馬、嗅球神經元中均能檢測到CDR1as基因的表達[29-30]。研究發現,CDR1as基因在興奮性神經元中表達水平較高,CDR1as基因敲除小鼠表現出興奮性突觸誘發電位功能障礙[29]。在斑馬魚胚胎中過表達人源CDR1as會導致中腦體積縮小,其表型與miR-7缺失相似,且通過補充miR-7前體可部分恢復中腦體積,提示CDR1as可能是通過與miR-7相互作用,即作為miR-7海綿吸附miR-7而發揮作用[19]。有文獻報道,在PD病人和1-甲基-4-苯基-1,2,3,6-四氫吡啶誘導的PD小鼠的中腦黑質區,miR-7的表達均顯著降低,在小鼠中腦黑質區敲低miR-7,則會導致α-突觸核蛋白積聚并伴有DA能神經元的變性丟失,同時紋狀體內DA含量顯著下降,提示miR-7可能在α-突觸核蛋白的轉錄后調節中發揮重要作用[31-32]。此外,miR-7在調節PD發病進程中的神經炎癥和DA能神經元死亡中具有重要作用[33-36]。因此,CDR1as可能通過調節miR-7-α-突觸核蛋白軸調控PD的發展。本研究應用濃度為100 μmol/L的MPP+處理N2a細胞構建PD細胞模型,并檢測了CDR1as在不同時間點的變化,結果顯示,N2a細胞經過MPP+處理3、6、9和12 h后CDR1as表達顯著降低,提示CDR1as基因可能間接參與了PD的發病。
有研究顯示,在CDR1as基因敲除小鼠大腦中,miR-7的表達減少而不是增加,這表明還有其他機制參與了miR-7表達的調節[29]。采用CLIP-Seq技術對miR-7-target RNA-Ago2嵌合體中的靶序列進行分析和排序發現,無論是在人類還是小鼠大腦中,排在第1位的都是CDR1as基因,排在第2位的是長鏈非編碼RNACyrano,提示Cyrano在中樞神經系統中對miR-7具有重要的調控作用[29]。Cyrano高表達于腦神經元的胞體和突起,含有1個與miR-7幾乎完全配對(除第9/10位外)的結合位點,且該位點高度保守[37]。然而,Cyrano是否通過miR-7在PD發病中發揮作用還需進一步探究。
研究表明,在人類和小鼠腦中,CDR1as基因也存在miR-671的結合位點,miR-671可以近乎完全與CDR1as基因互補配對,隨后與Ago2蛋白結合,最終實現對CDR1as基因的有效降解,且此相互作用在物種間高度保守,提示這種特異性的相互作用可能具有重要生物學功能[29,38]。本研究中,N2a細胞經過MPP+處理3、6、9和12 h后CDR1as基因表達顯著降低,這一現象是否與miR-671有關還需進一步研究。
綜上所述,N2a細胞經過MPP+處理3、6、9和12 h后CDR1as基因表達水平顯著降低,本文結果為研究CDR1as基因在PD發病中的作用提供了實驗依據。

