NOX4-NLRP3信號通路在衰老小鼠腎臟纖維化中的激活研究
韓玉立,董夏男,楊 柳,李學望,李 艷,李衛平,李維祖
衰老是眾多疾病的潛在風險因素。腎臟是最易受到衰老影響的器官之一,而腎臟纖維化是腎臟衰老的結構變化之一[1]。在腎臟衰老的眾多機制中,氧化應激和炎癥備受關注。氧化應激是由于內源性活性氧(reactive oxygen species, ROS)的過度生成對細胞造成損傷的過程。有報道[2]稱,ROS的長期積累在腎臟纖維化中起著關鍵作用。NADPH氧化酶(NADPH oxidases, NOX)是細胞中產生ROS的重要酶系統[3]。NOX家族由NOX1~5等同源物的細胞膜蛋白組成,其中在腎臟中主要表達的是NOX4[4]。炎癥也被認為可能在衰老相關的腎臟損害中發揮重要作用。核苷酸結合寡聚化結構域蛋白樣受體蛋白家族(nucleotide-binding oligomerization domain-containing protein-like receptor protein, NLRP)是第一個被發現形成炎癥小體的傳感器蛋白家族[5]。NLRP3炎癥小體可能是慢性腎臟疾病、急性腎損傷和糖尿病腎病的發病機制[6]。然而,NLRP3的激活是否參與衰老相關的腎臟纖維化仍不清楚。本研究旨在探索NOX4-NLRP3信號通路的激活在衰老小鼠腎臟纖維化中的作用,對研究腎臟與年齡相關因素的關系具有重要意義。
1 材料與方法
1.1 實驗動物6月齡雄性、體質量(33~40)g昆明種小鼠購自安徽醫科大學實驗動物中心,SCXK(皖)2017-001。48只小鼠依據體質量被隨機化分為6、16、20和24月齡組(n=12)。小鼠飼養于溫度25 ℃,12 h/12 h明暗交替的環境中,小鼠可以自由進食飲水,各組小鼠飼養條件保持一致。6、16、20和24月齡組的小鼠分別飼養6、16、20和24個月后處死取材。其中20月齡組的1例小鼠死亡,24月齡組的2例小鼠死亡。
1.2 主要試劑血清尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)試劑盒(南京建成生物工程研究所);超氧化物陰離子熒光探針(dihydroethidium,DHE)和β-半乳糖苷酶(β-galactosidase,β-Gal)試劑盒(上海碧云天生物科技有限公司);Hoechst 33258(美國Sigma公司);兔抗膠原蛋白Ⅳ(collagen Ⅳ, COL4)抗體、兔抗NLRP3多克隆抗體、兔抗NOX4多克隆抗體、兔抗p47phox多克隆抗體和兔抗p22phox多克隆抗體(上海bioworld生物技術有限公司);兔抗胱天蛋白酶募集結構域的凋亡相關斑點樣蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)(北京博奧森生物技術有限公司);兔抗Caspase-1多克隆抗體、兔抗白介素-1β(interleukin-1β,IL-1β)多克隆抗體和兔抗轉化生長因子β1(transforming growth factor-β1, TGF-β1)多克隆抗體(美國abcam公司);小鼠抗β-actin、辣根酶標記山羊抗兔IgG(H+L)、辣根酶標記山羊抗小鼠IgG(H+L)和DAB染色劑(北京中杉金橋生物技術公司)。
1.3 主要方法
1.3.1BUN和SCr的測定 腹腔注射3%三溴乙醇將小鼠麻醉,并從心臟采集血樣,離心分離出血清。試劑盒檢測BUN和SCr的水平,以評估不同組別的腎功能。
1.3.2腎皮質中ROS水平檢測 小鼠尾靜脈注射DHE工作液(100 μmol/L,0.1 ml/10g),30 min后取出腎臟并嵌入OCT包埋劑。用冷凍切片機將腎臟切成10 μm的切片。然后用Hoechst 33258孵化切片5 min。使用熒光顯微鏡觀察切片。Image-Pro Plus 6.0對每個切片中腎皮質的5個隨機區域(×400)的DHE染色的平均熒光密度進行量化,以評估ROS的產生。
1.3.3測定衰老相關的β-Gal活性 冰凍切片使用試劑盒進行β-Gal染色。用光學顯微鏡拍照,Image-Pro Plus 6.0對每個切片中腎皮質的5個隨機區域(×400)的平均光密度進行量化,以評估β-Gal活性。
1.3.4腎臟組織學評價 小鼠的腎臟浸泡在4%多聚甲醛24 h后取出在石蠟中包埋,切片,脫蠟。進行蘇木精和伊紅(hematoxylin and eosin,HE)染色,高碘酸-希夫(periodic acid-Schiff , PAS)染色和Masson染色。在光學顯微鏡下觀察拍照,選取切片中的5個隨機區域(×400)的腎小球進行定量分析。Image J檢測PAS染色中腎小球的面積和直徑。Image-Pro Plus 6.0對PAS和Masson染色進行量化分析,用陽性區域的平均密度來評估腎臟組織學的變化。
1.3.5免疫組化 腎組織石蠟切片脫蠟,在3%的雙氧水中孵化10 min。將切片在微波爐中的檸檬酸鈉抗原修復液中沸騰7 min,并用正常的山羊血清封閉30 min。將切片與COL4、NLRP3抗體在4 ℃下孵育過夜。洗凈切片,二抗孵育1 h,然后用DAB染色,在顯微鏡下觀察拍照。每張切片選5個腎臟皮質區域(×400)進行定量分析,Image-Pro Plus 6.0測量陽性區域的平均密度,以評估COL4和NLRP3的表達。
1.3.6Western blot實驗 取腎皮質組織50 mg用RIPA法提取總蛋白。等量的蛋白質通過SDS-PAGE分離并轉移到PVDF膜上。室溫下封閉1 h,并在4 ℃下用以下抗體孵育過夜:NLRP3、ASC、Caspase-1、IL-1β、NOX4、p47phox、p22phox、TGF-β1和β-actin單克隆抗體(1 ∶1 000)。然后將PVDF膜與相應的二抗在室溫下孵育1 h。用Chemi-Doc MP、Bio-Rad成像系統對蛋白條帶進行拍照。Image J測量蛋白條帶的灰度值,并與相應的β-actin進行歸一化。

2 結果
2.1 衰老對小鼠SCr和BUN和腎臟組織形態學的影響與6月齡小鼠相比,老年小鼠的SCr和BUN水平增加(P<0.05,P<0.01),見圖1A、B。HE染色結果顯示,在20和24月齡小鼠中,腎小球和腎小管組織出現了損傷,許多腎小管上皮細胞空泡化、扁平和脫落,管腔腫脹、破裂和間質炎癥浸潤。腎小球基底膜增厚,系膜基質增加,細胞外基質沉積,系膜面積比升高,見圖1C。
2.2 衰老對小鼠腎皮質中β-半乳糖苷酶表達的影響β-Gal活性上調是衰老細胞的一個重要標志。結果顯示,隨著小鼠年齡的增長,β-Gal活性增加(P<0.05或P<0.01),見圖1D、E。

圖1 衰老對血清中腎功能參數,腎臟病理形態(HE ×400)和β-Gal活性的影響
2.3 衰老對小鼠腎臟酸性糖蛋白沉積的影響PAS染色結果顯示,與6月齡小鼠相比,20和24月齡小鼠腎小管上皮細胞和基質中沉積的酸性糖蛋白增加,腎小球酸性糖蛋白沉積的面積和水平增加,其紅色密度更高;進一步測量腎小球的直徑,與6月齡小鼠相比,20和24月齡的小鼠的腎小球直徑也增加(P<0.05或P<0.01),見圖2A~D。

圖2 衰老對小鼠腎小球和腎小管酸性糖蛋白沉積的影響 PAS染色 ×400
2.4 衰老對小鼠腎臟纖維化的影響Masson染色顯示,6月齡和16月齡小鼠的腎小球和間質沒有明顯的腎臟纖維化。在20和24月齡小鼠中,腎小球和腎間質纖維化增加(P<0.01),見圖3A、B。在20和24月齡小鼠中,COL4在腎小球和腎小管中的表達增加(P<0.01),見圖4A、B。16月齡小鼠TGF-β1在腎皮質中的表達增加,但差異無統計學意義。20和24月齡小鼠TGF-β1在腎皮質中的表達增加(P<0.01),見圖4C。
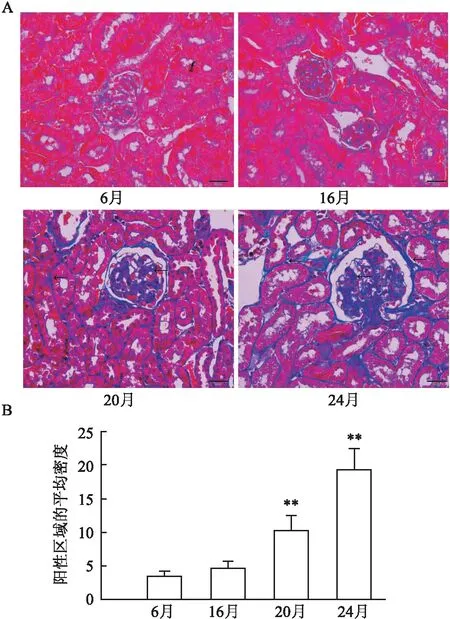
圖3 衰老對6、16、20和24月齡小鼠的腎臟膠原蛋白沉積的影響(n=4)

圖4 衰老對6、16、20和24月齡小鼠腎皮質中COL4和TGF-β1表達的影響(n=4)
2.5 衰老對小鼠腎皮質中ROS產生的影響DHE熒光染色結果顯示,與6月齡小鼠相比,16、20和24月齡小鼠腎皮質中的ROS產生增加(P<0.01),見圖5A、B。

圖5 衰老對6、16、20和24月齡小鼠腎皮質中ROS生成及NOX4、p22phox和p47phox表達的影響(n=3)
2.6 衰老對小鼠腎皮質中NOX4、p22phox和p47phox表達的影響蛋白免疫印跡結果顯示,與6月齡組小鼠相比,20和24月齡小鼠腎皮質中NOX4、p22phox和p47phox的表達增加(P<0.05或P<0.01),見圖5C~E。
2.7 衰老對小鼠腎皮質中NLRP3、ASC、Caspase-1和IL-1β表達的影響與6月齡小鼠相比,16、20和24月齡小鼠腎皮質中NLRP3、ASC、Caspase-1和IL-1β的表達增加(P<0.05或P<0.01),見圖6A~D。免疫組化法檢測NLRP3在腎皮質的表達。結果顯示,隨著年齡的增加,小鼠的腎小球中NLRP3的表達增加(P<0.05或P<0.01),見圖7A、B。

圖6 衰老對6、16、20和24月齡小鼠腎皮質中NLRP3、ASC、Caspase-1和IL-1β表達的影響(n=3)

圖7 衰老對6、16、20和24月齡小鼠腎皮質中NLRP3表達的影響(n=4)
3 討論
該研究探索了衰老小鼠的腎臟纖維化的變化及與NOX4-NLRP3信號通路的相關性。該研究表明,20和24月齡小鼠BUN和SCr水平、腎皮質β-Gal活性、ROS和IL-1β水平以及病理形態學和腎臟纖維化相關參數都增加(P<0.01)。與腎臟衰老的病理變化相一致,20和24月齡小鼠腎皮質中NOX4和NLRP3炎癥小體的表達增加(P<0.05)。這些結果表明,NOX4介導的NLRP3炎癥小體的激活可能在衰老相關的腎臟纖維化中發揮重要作用。
腎臟衰老是一個復雜的過程,其特點是腎臟功能逐漸退化和結構逐漸改變[7]。在衰老過程中,受損的細胞器和線粒體有明顯的積累,將導致腎功能不全[8]。當腎臟發生進行性和破壞性損傷時,BUN和SCr的產生將增加[9]。該研究結果也同樣證實了這一點。此外,衰老的腎臟表現出交聯的細胞外基質蛋白和纖維化的增加。TGF-β1是腎臟疾病最重要的促纖維化因子[10],其表達在20和24月齡小鼠增加。該研究數據表明,16月齡小鼠腎臟結構和功能開始出現輕微的改變,纖維化不明顯,但是促纖維化因子開始增加。而20和24月齡小鼠腎臟結構和功能都出現了改變,腎小管和腎小球出現纖維化。
各種機制參與了與衰老相關的腎臟老化損傷,如氧化應激、炎癥、線粒體功能障礙和鈣調節的改變等。氧化應激是細胞和組織中氧化和抗氧化之間的不平衡,是氧自由基和相關ROS過度生產的結果[11]。該研究中ROS的產生在20和24月齡小鼠中增加。NOX4是參與慢性腎臟疾病發展的ROS氧化應激的主要來源[12-13]。與ROS相似,6月齡小鼠腎皮質中NOX4、p22phox和p47phox的表達較低,而在20和24月齡小鼠中則增加。提示NOX4介導的ROS生成在衰老過程中對腎臟纖維化有重要作用。炎癥也在腎臟纖維化的發展中起著重要作用。由巨噬細胞移動抑制因子介導的炎癥反應是糖尿病腎病中腎臟纖維化發展的重要原因[14]。NADPH氧化酶激活過度產生的ROS與NLRP3炎癥小體的成熟密切相關[15]。在衰老小鼠腎臟NLRP3炎癥小體的激活過程中,NOX4的激活起到關鍵的促進作用。
總之,該研究發現20和24月齡小鼠腎皮質ROS和IL-1β水平升高,并伴有衰老相關的腎損傷和纖維化。在衰老過程中,腎臟中的NOX4和NLRP3炎癥小體被激活,提示NOX4介導的過量ROS的產生在腎皮質NLRP3炎癥小體的激活中起重要作用,與小鼠衰老相關的腎損傷和纖維化密切相關。但是NOX4和NLRP3炎癥小體參與衰老過程中腎臟纖維化的具體分子機制還有待進一步研究。

