刺葡萄錦葵色素酶促酰化反應條件的優化
蔡愛麗,黃名勇,王 政,咼亞波,趙 倩, ,鄧潔紅,
(1.湖南農業大學食品科技學院,湖南長沙 410128;2.湖南省天香生物科技有限責任公司,湖南邵陽 422000)
刺葡萄是葡萄科葡萄屬植物,木制藤本[1]。刺葡萄來源廣泛,價格低廉,但果粒小、種子多,不便鮮食,是優秀的加工原材料[2]。紫黑色的刺葡萄果皮中含有大量的純天然錦葵色素,為花色苷單體,具有保健功效和巨大的應用潛能[3-6]。花色苷作為一種水溶性色素,在日常環境中穩定性差,易分解變色[7],容易受溫度[8-9]、光照[10-11]、pH[12-13]等外界因素的影響,不能用于工業化大規模生產。錦葵色素屬于類黃酮化合物[14],分子結構上含有多個活潑羥基[15],使其穩定性受到影響。羥基數量越多,錦葵色素的穩定性越低。而酰化的花色苷的結構具有空間位阻效應,能減少水解反應和花色苷的分子內凸起,防止花色苷轉化成假堿和查爾酮結構,從而提高其穩定性[16-18]。
研究者一般通過化學法實現花色苷酰基化[19-20],改善花色苷穩定性和脂溶性。但由于花色苷結構中的活性羥基均能酰基化,化學法選擇性低,易與母核上的主要活性酚羥基結合或阻斷,導致削弱甚至喪失原有的抗氧化活性[21]。此外,采用化學法酰化時,產物難以分離純化;且反應較為劇烈且有毒,會造成環境污染等[22-23]。近年,有學者針對花色苷酶促酰化開展了研究[18,24],發現酶促酰化的反應條件比較溫和,酰化位點明確,酰化產物單一,純度較高,彌補了化學法酰化反應存在的缺陷[25]。同時,酶的高效性和選擇專一性,可大大提升底物酰化反應的酰化率。通過酰化反應,能提高花色苷的抗氧化性[26]、脂溶性[27]和穩定性[28-29]。
目前,花色苷酶促酰化的文獻大多采用矢車菊3-O-葡萄糖苷作為研究對象,錦葵色素的酶促酰化未見報道。研究表明,酰基供體和反應條件的選擇不當會導致轉化率相當低[30]。因此,探尋刺葡萄錦葵色素酰化反應的最適條件,對提高刺葡萄的利用率及其工業價值是非常重要的。本研究以刺葡萄為試驗原材料,刺葡萄中錦葵素-3,5-O-雙葡萄糖苷為反應底物,以酰化率作為評價指標,得到酶促酰化的反應時間、反應溫度、底物摩爾比的最佳反應條件區間;以此為基礎,設計響應面優化試驗,對建立的刺葡萄錦葵色素酶促酰化反應體系進行反應參數的優化,得到最佳反應條件,為錦葵色素的穩定化及工業利用提供借鑒。
1 材料與方法
1.1 材料與儀器
刺葡萄 從中方縣刺葡萄果園基地購回,用自來水沖洗干凈,晾干后剝皮,在-20 ℃冰箱中冷凍貯藏;錦葵啶-3,5-雙葡萄糖苷標準品 德國Phyto Lab公司;脂肪酶Candila Antarctica-B(CAL-B,Novozym 435) 諾維信生物技術有限公司;叔丁醇、月桂酸乙烯酯 分析純,上海阿拉丁生化科技股份有限公司;分子篩4A 型(工業級)、甲醇、乙醇、鹽酸、乙醚、乙酸乙酯 分析純,國藥集團化學試劑有限公司。
AEY-220 電子分析天平 湘儀儀器設備有限公司;HJ-4A 恒溫磁力攪拌器 上海比朗儀器有限公司;e2695 高效液相色譜儀 美國Waters 公司;RE-2000B 旋轉蒸發儀、SHZ-D 循環水式真空泵 予華儀器有限責任公司;THZ-92A 氣浴恒溫振蕩器、HH-8 恒溫水浴鍋 上海浦東物理光學儀器廠;真空冷凍干燥機 丹麥Heto 公司;TDZ5 離心機 湖南赫西儀器裝備有限公司。
1.2 實驗方法
1.2.1 刺葡萄錦葵色素單體的制備 參照課題組前期試驗成果[31],制備刺葡萄錦葵色素-3,5-O-雙葡萄糖苷(Malvidin-3,5-O-diglucoside)。
提取:刺葡萄果皮以1:4(g/mL)的料液比加入75%酸化乙醇(含0.03%鹽酸),在避光環境下,浸提24 h 真空濃縮后離心,經過2次無水乙酸乙酯和無水乙醚萃取,脫除有機溶劑,得到錦葵色素粗提液。
純化:HP-20 樹脂預處理后濕法裝柱,錦葵色素粗提液進樣至流出液的吸光度值為上樣液的1/10。首先用蒸餾水沖洗, 再用體積分數為80%、含0.05%鹽酸的酸化乙醇洗脫,收集洗脫液于40 ℃濃縮,真空凍干,再用甲醇溶解。
單體制備:通過半制備型高效液相制備,色譜條件:柱子:XCharge C18柱(20 mm×250 mm,10 μm);檢測波長:520 nm;流動相A:2%甲酸溶液;流動性B:甲醇;進樣量:1.2 mL;流速:15 mL/min;柱溫:30 ℃;洗脫程序:0 min:30% B,5 min:35% B,8 min:40%B,12 min:50% B,18 min:60% B,20 min:80% B。
參考文獻[31]進行結構鑒定,獲得3 種色素,經過超高效液相色譜三重四級桿飛行時間質譜聯用分析鑒定選取錦葵素-3,5-O-雙葡萄糖苷為試驗單體。
1.2.2 脂肪酶催化花色苷酰化反應
1.2.2.1 反應時間對刺葡萄錦葵色素酶促酰化反應的影響 將活化后的4A 型分子篩放入叔丁醇中進行干燥,在5 個帶塞小瓶中加入2 mL 脫水叔丁醇、0.01 mmol 錦葵素-3,5-O-雙葡萄糖苷、0.10 g 分子篩和0.15 mmol 月桂酸乙烯酯混合均勻,連續攪拌至完全溶解,加入40 mg 脂肪酶CAL-B,pH 為3.0 時在恒溫振蕩器(45 ℃,200 r/min)中分別反應24、30、36、42、48 h 后,5000 r/min 離心15 min 后取上清液,將濾液置于旋轉蒸發儀中,真空蒸餾后,溶解于10 mL 的甲醇中,攪拌至完全溶解后,12000 r/min離心10 min,取上清液。用體積分數為0.01%的甲酸甲醇溶液稀釋50 倍,液相色譜手動進樣20 μL 進行分析。酰化反應前后,試驗均在避光條件下進行。利用歸一法計算出峰面積,獲得反應的酰化率,探討反應時間對刺葡萄錦葵色素酶促酰化反應的影響。
1.2.2.2 反應溫度對刺葡萄錦葵色素酶促酰化反應的影響 按照1.2.2.1 的方法,將錦葵色素的酰化反應溫度分別設置為40、45、50、55、60 ℃,反應42 h后終止反應。經液相色譜分析后計算反應的酰化率,探討反應溫度對刺葡萄錦葵色素酶促酰化反應的影響。
1.2.2.3 底物摩爾比對刺葡萄錦葵色素酶促酰化反應的影響 按照1.2.2.1 的方法,在錦葵色素酰化反應過程中分別添加0.10、0.15、0.20、0.25、0.30 mmol的月桂酸乙烯酯,使底物的摩爾比分別為1:10、1:15、1:20、1:25、1:30,55 ℃下反應42 h。經液相色譜分析后計算反應的酰化率,探討底物摩爾比對刺葡萄錦葵色素酶促酰化反應的影響。
1.2.2.4 響應面優化試驗 以單因素實驗為基礎,反應時間、反應溫度、底物摩爾比為試驗因素,以酰化率為響應值,根據Box-Benhnken 原理,設計響應面優化試驗,因素水平表如表1所示。每組試驗重復三次,通過Design-Expert V8.0.6 軟件,通過數據分析得到試驗最優條件方案。
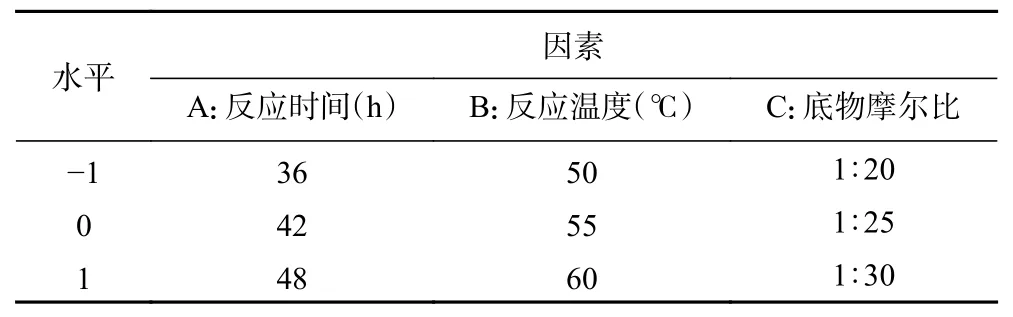
表1 響應面優化試驗因素水平設計Table 1 Design of factors and levels of response surface optimization test
1.2.3 酶促酰化反應酰化率的計算 酰化反應后,利用高效液相色譜儀進行分析。分析條件如下:
流動相A:1%甲酸溶液;流動相B:乙腈;流速:0.6 mL/min;柱溫:35 ℃;檢測器:PDA 紫外檢測器;檢測波長:520 nm;進樣量:20 μL。
低壓梯度洗脫條件:0 min:5% B,5 min:20% B,20 min:90% B,30 min:90% B,45 min:20% B。
花色苷的酰化率計算公式為:

式中:S1表示反應后酰化產物的峰面積;S0表示反應后未酰化花色苷的峰面積。
1.3 數據處理
試驗設重復實驗,以平均值±標準偏差表示結果。使用Origin 2017 64 Bit 軟件進行數據繪圖,用SPSS 21.0 軟件對試驗數據進行多重差異顯著性分析。
2 結果與分析
2.1 酰化反應前后的高效液相色譜分析
利用高效液相對酶促酰化反應前后的刺葡萄錦葵色素進行分析。從圖1A 可看出,未酰化花色苷單體在520 nm 檢測只有一個色譜峰,計算出制備的刺葡萄錦葵色素單體純度為98.76%。圖1B 為酰化反應后花色苷的液相色譜圖,在520 nm 可以檢測到兩個色譜峰,與未酰化的色譜圖相比,多了一個酰化產物峰。這說明刺葡萄錦葵色素酰化反應可能生成了單酰基產物,脂肪酶催化區域選擇性較高,只有一個酰化位點,能更好地分離純化出酰化花色苷單體。通過酰化產物的峰面積確定酶促酰化反應的酰化率,證明酶促酰化反應的轉化率。

圖1 酰化反應前后樣品的液相色譜圖Fig.1 Liquid chromatographic of the sample before and after the acylation reaction
2.2 反應條件對刺葡萄錦葵色素酶促酰化反應的影響
如圖2A所示,隨著酰化反應時間的增加,酰化率先提高后降低。酰化反應時間為24~42 h 時,錦葵色素中酰基供體的濃度較高,酰化產物濃度較低,促進反應向正方向進行,酰化率從29.8%提高到43.2%。但是,反應時間達到42 h 后,酰化反應基本達到平衡狀態,且刺葡萄錦葵色素及酰化產物長時間處于高溫下發生分解,酰化率降低。因此,選取反應時間36、42、48 h 為最優梯度。
酶促酰化反應容易受到溫度的影響。在一定溫度范圍內,升高溫度能增加底物分子能量和活化的底物分子,相應增加了單位時間內底物分子有效碰撞次數,從而促進反應的進行。如圖2B所示,反應溫度低于55 ℃時,脂肪酶CAL-B 的活性、底物的溶解度以及反應體系中底物有效碰撞次數都隨著反應溫度的提高而增多,酰化效率也隨之提高。在55 ℃時,錦葵色素的酰化率最高,繼續升高反應溫度,酰化效率開始降低。因為當溫度過高且在有機溶劑中時,肽鍵的水解和二硫鍵的破壞被加劇,脂肪酶的酶蛋白會發生變性最終失活[32-33]。同時,溫度過高導致了錦葵色素及其酰化產物的降解[34]。因此,選取反應溫度50、55、60 ℃為最優梯度。
刺葡萄錦葵色素酶促酰化體系屬于雙底物可逆反應,反應中同時存在酶促水解副反應[35]。在酰化反應體系中,加入過量的酰基供體,能夠提高反應體系中底物與脂肪酶之間的碰撞,從而提高反應的酰化率。同時提高雙底物中一種底物的濃度,有利于熱力學平衡向酰化反應的方向進行。因此,最佳摩爾比的確定,既能保證反應充分發生,同時也能節省試劑。底物摩爾比對酰化率的影響結果如圖2C所示,當刺葡萄錦葵色素與月桂酸乙烯酯的摩爾比從1:10~1:25時,刺葡萄錦葵色素的酰化率逐漸升高,繼續提高月桂酸乙烯酯的濃度,脂肪酶的活性受到影響,反應的酰化率開始降低。綜合考慮,選取底物摩爾比1:20、1:25 和1:30 為最優梯度。
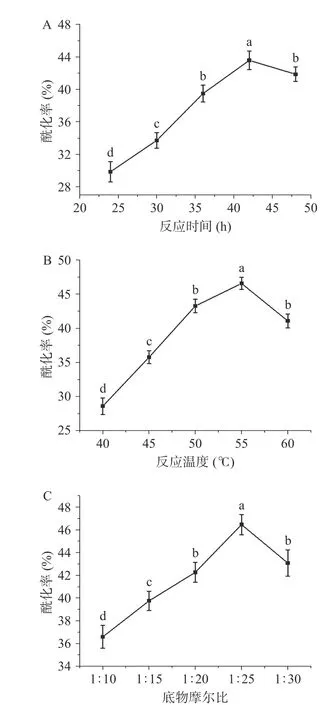
圖2 反應條件對刺葡萄錦葵色素酶促酰化反應的影響Fig.2 Effects of reaction conditions on the enzymatic acylation of malvidin
2.3 響應面優化試驗結果分析
對反應時間(A)、反應溫度(B)、底物摩爾比(C)三個因素進行反應條件優化,通過單因素實驗,選取每個因素的最優梯度,以酰化率為響應值進行三因素三水平的響應面優化試驗,共設計17 個試驗,每個試驗設三個平行,Box-Behnken 試驗設計與結果見表2。

表2 響應面優化試驗設計與結果Table 2 Design and results of response surface optimization test
2.4 回歸方程方差分析
通過Design-Expert V8.0.6 軟件對數據進行多元回歸擬合,得到刺葡萄錦葵色素酶促酰化反應酰化率Y(%)的二次多元回歸方程:
Y=49.96+0.3125A-0.9500B-0.4625C-1.65AB-1.48AC-0.2500BC-3.14A2-3.37B2-2.24C2。
以刺葡萄錦葵色素的酰化率為響應值,對三個因素(反應時間、反應溫度、底物摩爾比)的回歸方差分析結果如表3所示。該回歸方程模型回歸極顯著(P<0.0001),且失擬項不顯著,說明該模型擬合程度好。函數的決定系數R2=0.9818,說明該模型可以解釋大部分試驗數據,因此可以用該模型預測和分析不同反應時間,反應溫度和底物摩爾比對刺葡萄錦葵色素酶促酰化反應體系酰化率的影響。

表3 回歸方程方差分析結果Table 3 Regression equation analysis results
由P值可以看出,反應時間(A)和反應溫度(B)的影響極顯著(P<0.01),底物摩爾比(C)影響不顯著,二次項A2、B2、C2極顯著(P<0.01)。AB、AC的P值均小于0.01,說明反應時間與反應溫度、反應時間與底物摩爾比交互作用對酰化率的影響極顯著。
2.5 響應面因素交互作用分析
響應面等高線圖及響應圖,反映了試驗因素之間的交互作用,響應曲面越陡峭,因素對響應值的影響越顯著;而響應面投射出的等高線形狀,如果呈橢圓形則表示兩因素交互作用顯著,如果接近圓形則表示兩因素交互作用不顯著。
由圖3A可知,在底物摩爾比不變的情況下,反應時間在36~48 h,反應溫度在50~60 ℃范圍內,刺葡萄錦葵色素的酰化率先升高后降低,且等高線圖呈橢圓形,三維曲面圖較陡峭,說明兩者之間的相互影響顯著,得到的結果與回歸方程分析中AB 的P值一致。由圖3B可知,在反應溫度不變的情況下,反應時間在36~48 h,底物摩爾比在1:20~1:30 范圍內,刺葡萄錦葵色素的酰化率先升高后降低,且等高線圖呈橢圓形,三維曲面圖較陡峭,說明兩者之間的相互影響顯著,得到的結果與回歸方程分析中AC的P值一致。而圖3C 中,等高線圖呈圓形且三維曲面圖較平緩,說明反應溫度與底物摩爾比之間的相互影響不顯著。
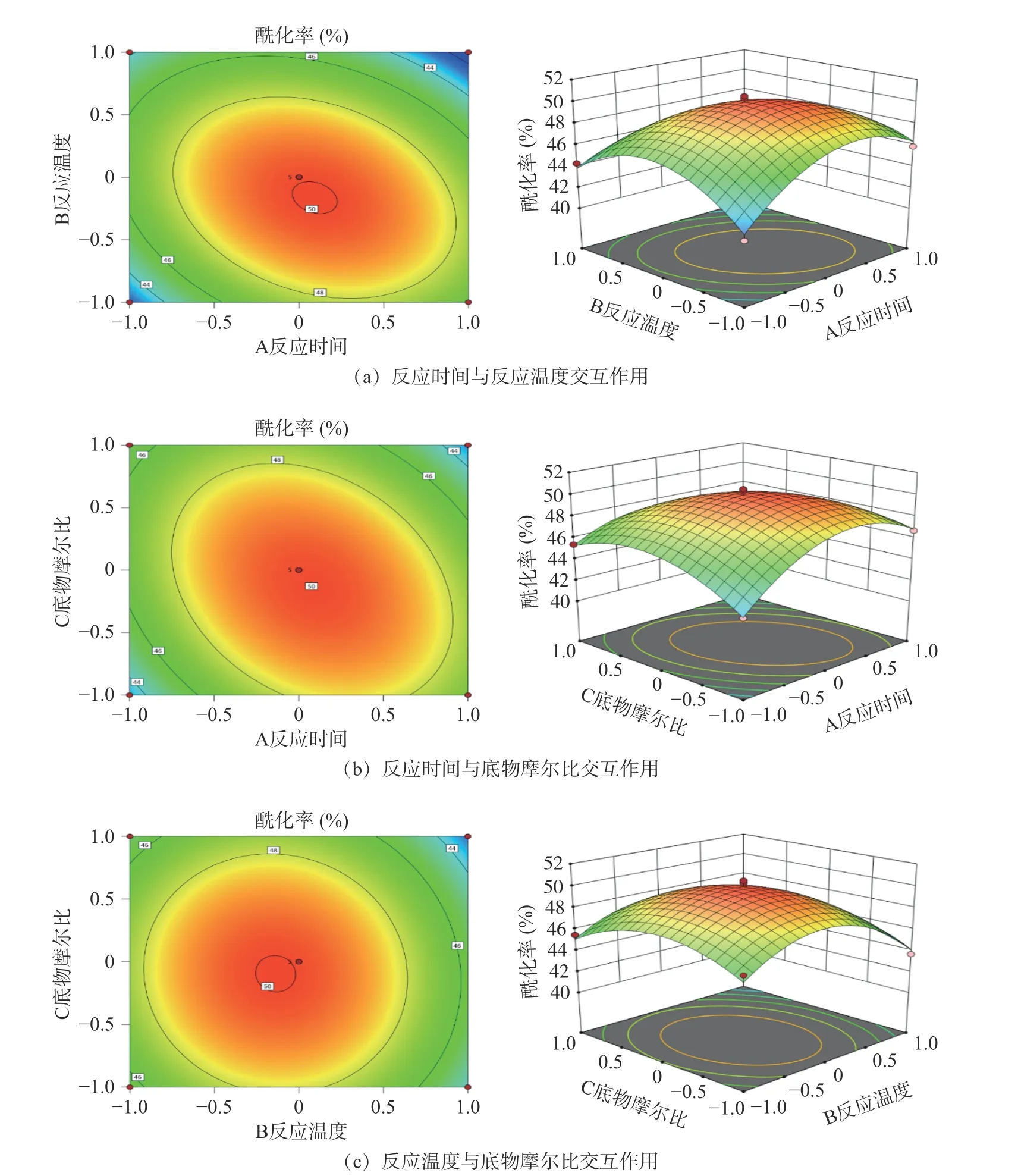
圖3 各因素交互作用的等高線圖及響應圖Fig.3 Contour diagram and response diagram of interaction of various factors
2.6 響應面最佳反應參數及驗證試驗
經Design Expert 優化后的刺葡萄錦葵色素酶促酰化反應的最佳反應條件為反應時間42.75 h、反應溫度54.16 ℃、底物摩爾比1:24.32,此條件下酰化率預測為50.09%,結合試驗可行性,將反應條件調整為反應時間43 h,反應溫度54 ℃,底物摩爾比1:24。該條件下進行三次重復驗證試驗試驗,得酰化率為49.92%±0.12%,與預測酰化率的相對誤差為0.12%。
3 結論
本文首先以刺葡萄錦葵色素的酰化率為指標,分別探討反應時間、反應溫度和底物摩爾比對酶促酰化反應的影響。其次通過響應面優化試驗,進行回歸方程方差分析,結果顯示回歸方程模型回歸極顯著(P<0.0001)。最終,根據所建立的數學模型進行參數最優分析,得到最佳反應條件,結合試驗可行性,確定最佳反應時間為43 h,反應溫度為54 ℃,底物摩爾比為1:24 時,刺葡萄錦葵色素的酶促酰化反應的酰化率為49.92%±0.12%,與模型預測值50.09%的相對誤差為0.12%,說明該反應條件合理可靠。本研究為天然花青素酰化研究提供了新的數據,為其在食品和保健品中的應用提供了依據。但是,酶促酰化反應位點對花色苷穩定性及抗氧化活性的影響還需要更加深入的探索。

