單寧酸和蛋白質相互作用機制及其對蛋白質理化及功能特性影響的研究進展
石長波,孫昕萌,趙鉅陽,袁惠萍
(哈爾濱商業大學旅游烹飪學院,黑龍江哈爾濱 150030)
多酚類物質是植物次生代謝產物,由于其潛在的保健作用,近幾十年來受到廣泛關注。多酚類化合物主要存在于綠茶和紅茶、葡萄酒(尤其是紅酒)、一些水果和谷類食品中[1]。據估計,人類每天約攝入1 g多酚,其中單寧的平均攝入量占50 %以上[2]。單寧酸(Tannic acid,TA)又名丹寧酸、鞣酸,它的化學式為C76H52O46,分子量在500 到3000 kDa 之間,是一類復雜的高分子多元酚類化合物[2]。單寧酸通常分為可水解單寧和縮合單寧。可水解單寧酸是結構簡單的酚類混合物,其中包括沒食子酸和鞣花酸[3],結構如圖1所示;縮合單寧也稱原花青素或類黃酮[4],是以黃烷-3-醇為基本結構的聚合物,結構如圖2所示。其用于合成各種次生代謝物,包括萜烯類、生物堿類和酚類化合物。

圖1 可水解單寧結構示意圖[4]Fig.1 Hydrolyzed tannin structure[4]
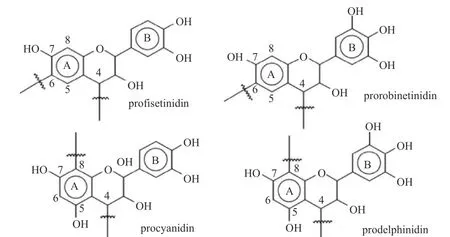
圖2 縮合單寧的主要結構[4]Fig.2 Four main structures of flavonoid tannins[4]
單寧酸因其生物和藥理活性而受到廣泛關注(圖3)。一方面,由于單寧具有抗菌、抗病毒和抗突變等活性,對人類慢性病的發展提供了保護作用[5]。另一方面,單寧酸作為抗氧化化合物,可以保護蛋白質、脂質和維生素等營養物質免受氧化[6]。單寧酸與食物中存在的碳水化合物、蛋白質或脂質等天然活性功能化合物的復合可改善許多聚合物的功能屬性,擴大其應用領域。蛋白質和單寧酸之間的相互作用會自發地在大多數食品系統中產生“蛋白質-單寧酸復合物”,并且會影響食品的感官、功能和營養特性。研究表明單寧酸和蛋白質的復合物有助于改變食物結構[4],例如增強小麥面筋的強度[7]以及減少葡萄糖代謝[8];單寧酸還可以與蛋白質結合形成保護層,用來制備生物膜,例如Picchio 等[9]使用與卵清蛋白共價交聯的單寧酸制備食品包裝膜;另一方面,在食品體系中,單寧酸由于與蛋白質的相互作用進而引發沉淀,導致食物澀味的產生[10];并且單寧酸與消化道中的膳食蛋白相結合,會降低蛋白質的營養價值;蛋白質多肽碳酰基與單寧酸中的烴基形成氫鍵,結合病原體的酶和毒性蛋白使其失活進而抑制酶活性。
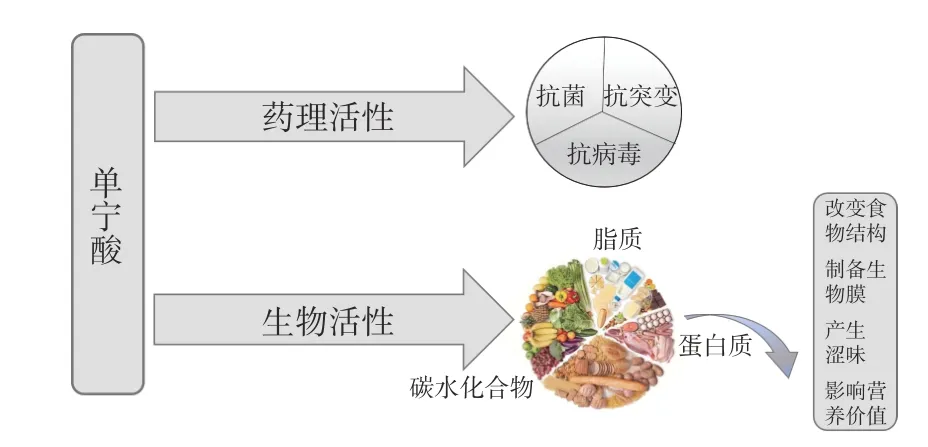
圖3 單寧酸的生物和藥理活性[11]Fig.3 Biological and pharmacological activities of tannic acid[11]
已知單寧酸和蛋白質的相互作用影響蛋白質的結構和功能特性等,更好地理解單寧酸與蛋白質的相互作用將有助于控制食品加工、運輸和儲存過程中蛋白質的功能特性。并且了解單寧酸和蛋白質之間的結合機制對于開發功能性食品配方和評估單寧酸的生物利用度是必不可少的。基于此,本文主要對單寧酸與蛋白質的相互作用進行闡述,包括單寧酸與蛋白質互作的機理、影響因素,以及單寧酸和蛋白質相互作用的應用,為開發單寧酸-蛋白質功能性產品提供理論依據。
1 單寧酸與蛋白質相互作用的機理
1.1 非共價相互作用
由于單寧酸含有眾多的羥基,可以與蛋白質形成強烈的非共價相互作用[12],其中主要結合方式包括氫鍵、疏水作用和范德華力[13-14],如圖4所示[15]。氫鍵產生于單寧酸的羥基和蛋白質的羰基和肽鍵之間[16]。在單寧酸與蛋白質結合的過程中,氫鍵是二者結合的主要驅動力。Jing 等[17]在pH6.0 下研究了TA 與牛乳鐵蛋白(Bovine lactoferrin,LF)的絡合。發現二者之間存在氫鍵相互作用,分子對接表明,TA 被殘基Arg654,Pro655,Pro409,Ser601,Arg323,Ser322,Leu385,Tyr319,Leu318,Gln249,Leu687,Cys405,Thr688 和Lys404 包圍(如圖5)。Simon 等[18]通過核磁共振和分子模擬研究表明,原花青素二聚體B3 與唾液14-a.a 肽IB7 通過氫鍵結合。Frazier等[5]發現在單寧與富含脯氨酸的唾液蛋白片段結合的過程中,脯氨酸羰基與苯酚或鄰苯二酚羥基基團之間通過氫鍵結合。疏水相互作用主要發生在多酚的苯環與蛋白質脂肪族、芳香族氨基酸之間[19],其中疏水性氨基酸,如亮氨酸,色氨酸等的蛋白質殘基與單寧酸多酚的非極性芳香環相互作用[20]。Ishtikhar 等[1]發現單寧酸的芳香雜環能夠與氨基酸殘基之間發生疏水相互作用,從而引起蛋白質構象的改變。單寧酸與蛋白質相互作用方式也可能是混合方式,比如同時存在氫鍵和疏水相互作用,Wang 等[21]研究了玉米醇溶蛋白水解物與單寧酸的膠體絡合,通過等溫滴定量熱法證實了二者之間的絡合是由疏水相互作用和氫鍵驅動的。此外,酚類化合物的苯環與蛋白質非極性氨基酸側鏈之間的疏水作用增強了范德華相互作用[22]。Cong 等[23]研究了單寧酸中的縮合單寧葡萄籽原花青素與動物源蛋白之間的相互作用,熒光結果表明二者主要作用力是范德華力、氫鍵和疏水作用。盡管形成的鍵可能是可逆的并且能量低,但是非共價蛋白-多酚相互作用可能在食品工業中對改善食品的功能和質量起重要作用。

圖4 單寧酸與蛋白質非共價作用機制[13]Fig.4 Mechanism of non-covalent interaction between tannic acid and proteins[13]

圖5 乳鐵蛋白與單寧酸分子對接圖[17]Fig.5 Molecular docking diagram of lactoferrin and tannic acid[17]
1.2 共價相互作用
單寧酸和蛋白質的非共價結合是可逆的,然而二者之間的共價結合是不可逆的。蛋白質和單寧酸通過共價鍵結合,共價鍵由蛋白質的親核基團,例如–NH2和–SH 與單寧酸氧化產生的醌基,如圖6所示[15];或由酸催化縮合單寧酸解聚產生的碳陽離子之間的反應產生[22]。單寧酸與蛋白質的共價結合可能發生在堿性、氧化酶存在以及高溫處理等條件下[23](圖7)。單寧酸可以在堿性pH 下被帶有側鏈氨基的分子氧化成奎寧,從而導致蛋白質交聯的形成[5],進而改變蛋白質的功能性和其他理化特性;在有氧及氧化酶存在條件下[24],單寧酸被氧化成醌,從而與蛋白親核加成;在高溫處理條件下,單寧酸會發生氧化和裂解,蛋白的二級結構也同時改變,氨基酸暴露程度增加[25]。

圖6 鄰醌與氨基、巰基的1, 4-親核加成反應示意圖[13]Fig.6 Schematic diagram of 1,4-nucleophilic addition reaction of o-quinone with amino and sulfhydryl groups[13]

圖7 堿處理形成蛋白質-單寧酸(沒食子酸為例)復合物的機理[13]Fig.7 Mechanism of formation of protein- tannic acid (gallic acid as an example) complex by alkali treatment[13]
Guo 等[25]研究發現在堿性條件下,單寧酸(TA)可與大豆分離蛋白(Soy protein isolate,SPI)的共價交聯,形成的SPI-TA 復合物可改善SPI 抗氧化活性和凝膠特性,且堿處理后,復合物中的色氨酸含量降低,共價結合率提高。Nie 等[26]發現在堿性和加熱條件下,單寧的摻入導致肌原纖維蛋白的聚合,并會產生具有較高拉伸強度和較低水蒸氣透過率的薄膜,此外,還發現氧化的單寧和肌原纖維蛋白之間的主要相互作用是形成非二硫鍵的共價鍵。Chen 等[27]發現在堿性及有氧條件下,氧化的單寧酸與豬血漿蛋白水解產物通過共價鍵發生相互作用。其中單寧酸的C–S 或C–N 鍵與多肽的巰基或氨基側鏈形成了二聚體或共價共軛物。目前,描述可逆相互作用的研究數量多于不可逆相互作用,主要是由于缺乏合適的方法來定量分子間共價鍵,因此單寧酸與蛋白質的共價相互作用機理探究將是未來的研究方向之一。
2 單寧酸與蛋白質相互作用的影響因素
單寧酸和蛋白質相互作用類型受條件的影響(圖8),進而影響蛋白質的功能特性以及單寧酸的活性。此外,單寧酸與蛋白質的相互作用很大程度上取決于蛋白質和單寧酸的構象或類型以及環境條件。不同種類的蛋白質氨基酸組成、疏水性和等電點均不同,這會影響蛋白質與多酚的結合能力[10]。根據Yildirim-Elikogl 等[28]的發現,未折疊的天然蛋白質對多酚的親和力比致密和球形的蛋白質強,這是因為氨基酸殘基與多酚相互作用的可能性更高。不同的酚類化合物在分子量,羥基化,甲基化,氫化和糖基化上有不同的變化,這強烈影響蛋白質與多酚的相互作用。此外,還包括一些環境因素,如溫度、酸堿度、離子強度和加工條件等。溫度會影響氫鍵并導致疏水鍵的形成;不同的pH 會改變蛋白質的構象以及蛋白質和多酚的電荷,從而影響蛋白質與多酚之間相互作用的程度和類型[23]。此外,蛋白質和單寧酸之間的親和力會隨離子強度的增加而增加。
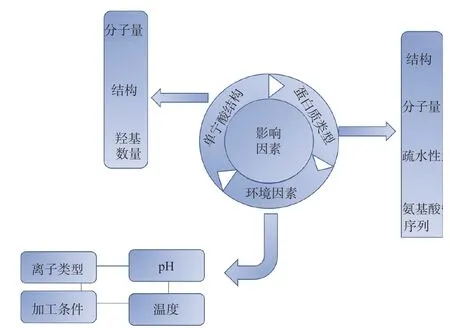
圖8 單寧酸與蛋白質相互作用影響因素圖Fig.8 Influence factors of tannic acid-protein interaction
2.1 蛋白質的類型
蛋白質的結構、分子量、疏水性和氨基酸序列強烈影響其與單寧酸的結合親和力[29]。不同結構的蛋白質與單寧酸的結合親和力不同。Xie 等[30]研究了牛血清白蛋白、β-乳球蛋白、卵清蛋白與單寧酸的復合,發現三種蛋白質對單寧酸的結合親和力為牛血清白蛋白>β-乳球蛋白>卵清蛋白,因為牛血清蛋白相比其他兩種蛋白質有更多的結合位點與單寧酸結合。具有靈活、無規則卷曲結構的蛋白質比球狀的蛋白質更容易與單寧酸結合[6]。Girard 等[31]研究表明谷蛋白由于具有較大分子量、開放的結構、脯氨酸含量較高更易與單寧酸相互作用。縮合單寧(原花青素)與疏水性不同的蛋白質相互作用時,表現出的相互作用強度不同。Prigent 等[32]發現牛血清白蛋白比α-乳清蛋白和溶菌酶更疏水,與原花青素的結合親和力更高[33]。另外,蛋白質表面上脯氨酸的含量還決定了蛋白質與多酚之間的結合能力,蛋白質中脯氨酰殘基的吡咯烷環能夠作為結合位點,與多酚的沒食子酸環結合[20]。序列中含有高比例脯氨酸殘基的蛋白質,例如唾液蛋白質,與單寧酸的結合能力更強[20]。
2.2 單寧酸的結構
多酚的分子量、結構以及羥基的數量在蛋白質與多酚的相互作用中起著重要作用。研究表明,高分子量的單寧酸能夠優先與蛋白質結合。Jakobek 等[34]發現聚合度和分子量較高的單寧酸沉淀蛋白質的能力會增強。Carvalho 等[35]研究發現縮合單寧比水解單寧結合蛋白質的能力更強。
單寧酸結構的靈活性也會影響單寧酸和蛋白質之間的相互作用。例如,沒食子單寧具有柔韌性,通過分子內旋轉,可以很容易地改變分子構象,能夠適應蛋白質的結合口袋結構[36]。此外,單寧酸與蛋白質結合的順序隨著分子上羥基數量的增加而增加[37]。Amoako 等[38]研究發現單寧酸可以通過其羥基和芳香環在蛋白質表面充當多齒配體,并且二者的結合程度隨著二者聚合度的增加而增加。
2.3 環境因素
2.3.1 溫度 溫度是影響酚類化合物與蛋白質結合親和力的重要環境因素。在蛋白質與多酚的體系中,溫度主要會影響氫鍵和疏水相互作用。當溫度升高時,會引起蛋白質構象的改變,并暴露先前埋藏的疏水位點,引發與酚類化合物上非極性基團的疏水相互作用,疏水相互作用力增強,氫鍵作用力減弱甚至消失[13]。Prigent 等[37]發現在5、25 和60 ℃條件下,5-O-咖啡酰奎寧酸對葵花籽11S 蛋白和牛血清白蛋白的結合親和力隨溫度升高而降低。
2.3.2 pH 另一個環境影響因素是pH。pH 直接影響單寧與蛋白質之間的相互作用,因為pH 會影響溶液離子化程度。通常,在低pH 和高pH 時,二者結合和沉淀的程度會降低,在接近等電點處,達到最大程度,此時蛋白質之間的靜電排斥最小[22]。Bourvellec等[36]發現球狀蛋白質,例如牛血清白蛋白在pH4.9時與TA 結合的親和力比在pH7.8 時更高。在接近蛋白質等電點的pH 下,觀察到蛋白質-單寧復合物的沉淀增加,因為這些復合物在該pH 下的溶解度較低[33]。粗單寧菜籽油提取物與牛血清白蛋白、胎球蛋白、明膠和溶菌酶結合后產生的沉淀,都在蛋白質的等電點附近觀察到[33]。研究表明單寧酸和唾液蛋白在pH 為3.5 時結合,比在pH 為7 時結合,產生的澀味更強[37]。這是因為相互作用的分子的電荷或氫鍵形成位點結構的變化,從而導致澀味的變化。Jauregi等[39]將乳清蛋白與單寧絡合,二者相互作用產生沉淀有效降低了澀味。
2.3.3 離子類型 離子類型也能夠影響單寧和蛋白質之間的相互作用。隨著離子強度的增加,蛋白質的疏水氨基酸殘基可以暴露出來,增加了蛋白質和單寧之間的親和力[40],此外離子濃度還會影響蛋白質的消化率。Elaine 等[33]觀察到二價陽離子能夠增加單寧酸和蛋白質的親和力并影響蛋白質的消化率。其中Mg2+和Ca2+能夠降低蛋白質消化率,而Mn2+使蛋白質的消化率增加了。Kaspchak 等[41]采用等溫滴定量熱法研究單寧酸與蛋白質的相互作用,結果表明在高離子強度條件下單寧酸和蛋白質的結合,降低了蛋白質的消化率。
2.3.4 加工條件 不同的加工條件對蛋白質和單寧酸復合物的影響效果依具體的反應條件而異。在不同的加工條件下,能夠改變單寧酸的化學結構,從而改變生物活性[42]。研究表明高壓處理能夠增強多酚和蛋白質分子間的氫鍵和疏水相互作用,從而形成粒徑更小、結構更緊密的復合物[43]。富含原花青素的葡萄籽提取物經高強度超聲純化后,原花青素的抗氧化活性顯著提高[42]。此外,一些非熱加工技術的使用,可以改善蛋白質的功能特性,有利于更好的應用在食品領域。經超聲和高壓均質處理后,蛋白質的溶解性、乳化性均有顯著提高[44]。目前,大多數研究集中在其他酚類化合物和蛋白質的預處理,對單寧酸和蛋白質復合物進行不同加工條件預處理的研究較少,未來可考慮通過調節加工條件來改善單寧酸和蛋白質復合,使其更好的應用于食品領域。
2.3.5 其他環境因素 單寧酸-蛋白質的相互作用也可能受到其他環境因素的影響,例如當復合物體系中存在其他物質時,通過改變溶液的極性或是改變體系的表面活性等,也會相應影響單寧酸-蛋白質間的相互作用。例如溶液中含有乙醇能夠改變溶液的極性。陳雨桐等[45]研究發現單寧酸與小麥醇溶蛋白溶解在乙醇-水溶劑中時,色氨酸的最大發射波長比在水溶液中有所偏移,這是由于乙醇的存在導致溶劑的極性降低,從而造成色氨酸最大發射波長藍移。此外,有些表面活性劑可與蛋白質相互作用,吸附在氣/水、油/水、乳狀液等界面[46],進而改變蛋白質的功能性質。鄒苑[47]通過制備玉米醇溶蛋白-單寧酸-十二烷基硫酸鈉(Sodium dodecyl sulfate, SDS)復合體系,發現SDS 加入改善了復合物的起泡性和起泡穩定性,因此也可以通過添加表面活性劑等人工分子伴侶,介導單寧酸-蛋白質相互作用,進而優化蛋白乳液性質。
3 單寧酸對蛋白質結構與特性的影響
單寧酸通過共價或者非共價與蛋白質進行相互作用,二者之間互作受多種因素影響,且不同種類蛋白質的結構和功能性變化不同,二者復合后對蛋白質的結構、功能特性以及對單寧酸的生物利用率均會產生顯著影響(圖9),進而影響復合物在食品領域中的應用。

圖9 單寧酸和蛋白質互作對蛋白質理化及功能特性影響概述Fig.9 Summary of the effects of tannic acid and protein interaction on physicochemical and functional properties of proteins
3.1 對蛋白質結構的影響
單寧與蛋白質相互作用對蛋白質結構性質的影響可以用熒光光譜、差示掃描量熱法、圓二色譜、傅里葉紅外變換光譜、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳等技術來研究。蛋白質游離氨基酸和巰基含量的變化可以反映蛋白質一級結構的變化。單寧酸含有大量的羥基,羥基轉化為具有交聯作用的醌,進而與巰基相互作用[48]。此外,羥基還可以與氨基相互作用,導致氨基含量的降低。有研究發現在魚肌原纖維蛋白中添加單寧酸,單寧酸與肌原纖維蛋白通過共價結合,結合后復合物中氨基和巰基含量顯著降低[49]。蛋白質二級結構的變化反映為α-螺旋、β-折疊、β-轉角和無序卷曲結構的百分比變化。Wang 等[50]研究了單寧對面筋蛋白結構性質的影響,傅里葉變換紅外光譜分析表明,添加單寧后面團中β-轉角和α-螺旋構象增加,而β-折疊構象減少,表明單寧酸能夠促進面筋蛋白的聚集從而改善面筋網絡的微觀結構。然而,有研究表明單寧的加入,會誘導蛋白質參與其他反應,因此不會改變或破壞大豆蛋白的二級結構[48]。Deng 等[51]發現原花青素與大豆鐵蛋白質的相互作用,不能引起大豆鐵蛋白質的二級結構的改變,這是因為原花青素與鐵蛋白的交聯,誘導蛋白與蛋白相互作用的發生,導致鐵蛋白質聚集體產生。單寧酸與蛋白質發生相互作用時,蛋白質三級結構的變化可以反映為色氨酸及酪氨酸殘基的極性變化。Xie 等[30]通過制備單寧酸-β-乳球蛋白復合物,發現β-乳球蛋白的熒光強度隨著單寧酸濃度的增加而降低,熒光峰波長發生紅移,表明Trp 殘基周圍極性增強,疏水性顯著降低。綜上所述,單寧酸與蛋白質互作會引起蛋白質結構發生不同程度的改變,具體的影響與蛋白質的種類有關。
3.2 對功能特性的影響
單寧酸和蛋白質復合會影響蛋白質的功能特性,如溶解性、起泡性、乳化性、抗氧化能力等,還可能會對產品感官品質以及貯藏特性產生影響。曹慧英等[52]將玉米黃粉蛋白(Corn Yellow Protein,CYP)與TA 復合,結果表明TA 的加入CYP 的溶解性和抗氧化活性顯著提高。Wang 等[53]利用玉米蛋白水解酸(Corn Protein Hydrolytic Acid,CPH)與TA 的復合物來改善CPH 本身的發泡特性,與純CPH 相比,CPH-TA 復合物保持了CPH 本身良好的發泡能力,且提高了其泡沫穩定性。用酚類化合物改性的蛋白質可用作食品體系中的乳化劑,以降低乳液穩定性并增加油滴的尺寸。單寧酸和蛋白質相互作用后可以使乳液具有良好的氧化穩定性,可用作乳化食品體系中的抗氧化劑和乳化劑。Li 等[54]將豌豆蛋白和單寧酸制成復合物,研究它們在亞麻籽水包油乳液中作為抗氧化劑和乳化劑的能力。結果表明,復合物能夠增強亞麻籽油輸送系統的氧化穩定性。Intarasirisawat等[55]研究發現氧化單寧酸與魚卵蛋白水解物結合后,可以增強乳液的穩定性和氧化穩定性。一些發現表明,由于蛋白質表面的活性以及單寧酸的抗氧化活性,單寧酸與肉制品中的蛋白質相互作用,可以提高蛋白質結構穩定性,并改善肉類產品的質量。Zhong等[56]在腌制豬肚中添加不同濃度的單寧酸,研究肌原纖維蛋白的水分分布和結構特性的變化。結果表明,添加濃度為0.50 g/kg 的單寧酸可以抑制腌制過程中水分流失,并保持肌原纖維蛋白的結構穩定性。
3.3 對營養特性和消化率的影響
食物蛋白質的營養價值取決于幾個因素,其中包括蛋白質來源、氨基酸組成、消化過程中對水解的敏感性等,單寧酸與蛋白質結合可能影響某些氨基酸的有效性,也可能改變蛋白質的結構,從而影響蛋白質的營養特性、消化率以及酶活性[37]。大豆蛋白與沒食子酸、咖啡酸、槲皮素等幾種酚類化合物作用后,賴氨酸、半胱氨酸、色氨酸含量降低[57]。高粱中縮合單寧與高粱中主要蛋白質發生絡合作用會導致高粱蛋白消化率下降。原花青素也可以導致蛋白質沉淀和消化酶的抑制,從而改變蛋白質的消化率。Jing 等[17]將TA 與LF 復合,通過蛋白水解消化實驗證明,TA 的加入降低了LF 的消化能力,根據這一特性可以改善生物復合物的消化穩定性,用于口服藥物的功能成分。
此外,單寧酸與蛋白質相互作用后還會影響單寧酸的相關性質,如改變單寧酸的生物利用率。單寧酸與人血清白蛋白(Humanserum albumin, HSA)結合會降低單寧酸的生物利用度。HSA 是血漿中含量較多的蛋白質,主要用于結合一些重要的生物化合物,如膽紅素。而當TA 進入人體代謝至血液中時,TA 和HSA 的相互作用能夠影響人血清白蛋白的化學結構和結合能力。另一方面,二者結合會導致單寧從血液中清除,最終降低單寧酸的生物利用率[39]。
4 總結與展望
對于單寧酸和蛋白質相互作用的研究日漸增多,這些相互作用可以是非共價的,例如疏水相互作用或氫鍵等;也可以在單寧轉變成醌或酚基形式后與蛋白質進行共價結合。二者之間互作受蛋白質的類型,酚類化合物的結構以及環境因素的影響,并會引起蛋白質理化及功能特性的改變,還會影響單寧酸的相關性質。更好地理解單寧酸與蛋白質的相互作用將有助于控制食品加工、運輸和儲存過程中蛋白質的功能特性,未來的研究應考慮對不同基質和不同加工條件下蛋白質與單寧酸的相互作用進行更深入的研究,以指導開發富含單寧酸的功能性食品,提高其營養和健康效益,進一步擴大其應用領域。

