不同提取工藝下牛骨膠原蛋白的結構特性
任戈一,馬雪蓮,潘 麗,齊海雯,冰瑪拉措,張書堯,顏海燕
(石河子大學食品學院,新疆石河子 832000)
我國是畜禽肉類生產和消費大國,2019 年我國畜禽肉總產量為7758.78 萬t[1],其中牛肉產量為667萬t。然而,在牛肉的生產消費過程中,牛骨作為主要副產物,約占牛總體重的20%~30%。膠原蛋白為牛骨中主要蛋白質,含量高達90%以上[2],膠原蛋白具有乳化、凝膠、起泡等功能特性,同時還具有促進新陳代謝,延緩衰老等生理功能。此外,其中含有多種人體必需氨基酸,含量為39.6 mg/100 g[3],能夠滿足不同人群對氨基酸的需求,因此骨膠原蛋白的提取及應用已經成為科研工作者的關注熱點。
目前,膠原蛋白提取的常用方法有:酸法、酶法、堿法、水熱法。酸法提取反應迅速、提取時間較短,且原料提取較徹底,得到的膠原蛋白結構較為完整,但由于酸具腐蝕性,設備易老化,設備費用增加;酶法提取是加入特定的蛋白酶以增進膠原蛋白非螺旋區段肽鍵降解,通常不會引起膠原蛋白三股螺旋結構變化[4],且能夠維持其特有的生物活性[5];堿法提取雖比較迅速,但堿性條件下會破壞膠原蛋白中的羥基和巰基并使得某些氨基酸消旋,蛋白質結構發生變化,最終影響其功能特性,產生“三致”毒害性[6],此方法逐漸被酸法或酶法所替代;熱水提取的膠原蛋白由于長時間在較高的溫度下浸提,破壞其部分結構,從而影響其功能特性。
現階段,有關膠原蛋白的提取主要集中于提取方法及其條件優化的研究,但不同提取方法得到的膠原蛋白結構差異的研究少有報道。膠原蛋白結構決定膠原蛋白功能特性,研究不同提取方法下膠原蛋白結構的差異,可為其后續的功能特性的研究提供基礎的理論依據。因此,本課題采用酸法及酶法提取工藝提取牛骨膠原蛋白,研究不同提取方法下膠原蛋白結構特性的差異并分析其中的原因,為有效利用牛骨資源和研究牛骨膠原蛋白的相關功能特性提供一定的理論依據。
1 材料與方法
1.1 材料與儀器
西門塔爾牛股骨 石河子市友好超市;胃蛋白酶(3000U/mg) 上海麥克林生化科技有限公司;三羥甲基氨基甲烷、MD10 透析袋(8~14 kDa) 北京索萊寶科技有限公司;考馬斯亮藍R-250、溴酚藍 德國Meker 公司;冰乙酸、檸檬酸、溴化鉀等 均為國產分析純。
PG-360 型強力碎骨機 廊坊市惠友機械有限公司;GNM-130AQ 型骨泥磨 廊坊市惠友機械有限公司;X7 型酶標儀 基因有限公司;T2A 型凝膠成像儀 美國Bio-Red 公司;FEI Quanta 200 型掃描電子顯微鏡 荷蘭FEI 公司;TENSOR 27 型傅里葉變換紅外光譜儀 瑞士Bruker 公司
1.2 實驗方法
1.2.1 脫脂脫鈣骨粉的制備
1.2.1.1 原料前處理 去除新鮮牛骨表面的碎肉、脂肪、軟骨等雜質,將其處理成為約10 cm×10 cm 大小碎塊,破骨機對牛骨塊破碎后用紗布吸水分并晾干,碎骨物料于骨泥機研磨,重復上述吸水步驟,真空包裝后于-20 ℃保存備用。
1.2.1.2 堿洗 根據公維潔等[7]的方法稍作改動。以料液比1:5 g/mL 加入并于4 ℃條件下震搖浸泡12 h,每隔6 h 更換一次溶液,目的是除去雜蛋白質,提高膠原蛋白純度。
1.2.1.3 脫脂處理 根據秦娜娜[8]的方法稍作改動。將堿洗所得的原料反復沖洗至中性,瀝干后以體積比1:5 加入并于4 ℃條件下震搖脫脂,每5 h 更換一次溶液,至溶液表面無明顯脂肪液滴。
1.2.1.4 脫鈣處理 采用南學敏[9]方法稍作改動。將脫脂所得原料反復沖洗至中性,瀝干后,于4 ℃條件下脫脂物料以體積比1:10 混合,每隔6 h 更換一次溶液,外液中鈣含量參照國標GB 5009.92-2016[10]的EDTA 滴定法測定,至溶液中無鈣含量則表明脫鈣完全。
1.2.2 膠原蛋白的提取
1.2.2.1 酸法提取 向骨樣中分別加入0.5 mol/L 乙酸溶液、0.5 mol/L 檸檬酸溶液,料液比為1:5 g/mL,震搖浸提24 h,收集上清液,調節上清液中NaCl 終濃度至0.9 mol/L,加入三羥甲基氨基甲烷(Tris)(6 g/L),調節pH7.5,攪拌均勻靜置過夜后,4 ℃、5000 r/min 離心15 min,沉淀物真空冷凍(-59.6 ℃,88~90 mT)干燥后得酸溶性膠原蛋白,分別記為ASC1、ASC2。
1.2.2.2 酶法提取 采用Shaik 等[11]方法稍作改動,向骨樣中分別加入0.5 mol/L 的乙酸溶液和胃蛋白酶,0.5 mol/L 的檸檬酸溶液和胃蛋白酶,胃蛋白酶添加量均為20 U/mg,料液比為1:5 g/mL,震搖浸提24 h。收集上清調節pH>8 滅酶,并調節溶液NaCl終濃度至0.9 mol/L,并加入Tris(6 g/L),pH 調至7.5,攪拌均勻靜置過夜后,4 ℃、5000 r/min 離心15 min,沉淀物真空冷凍(-59.6 ℃,88~90 mT)干燥后得酶溶性膠原蛋白,分別記為PSC1、PSC2。
1.2.2.3 膠原蛋白得率計算 對不同提取方法下得到的酸溶性膠原蛋白與酶溶性膠原蛋白的質量進行測定,并計算膠原蛋白得率。膠原蛋白得率計算公式如下:

1.2.3 膠原蛋白純化 參考劉麗莉等[12]的方法稍作改動。對所得膠原蛋白粗品用0.5 mol/L 冰醋酸再次溶解后裝入透析袋(8~14 kDa),先用0.1 mol/L 冰醋酸透析2 d,再用蒸餾水透析2 d,每隔12 h 換一次透析袋外液。透析結束后沉淀物冷凍(-59.6 ℃,88~90 mT)干燥即得相對較純的骨膠原蛋白,凱氏定氮法測定蛋白質含量,-20 ℃貯存備用。
1.2.4 膠原蛋白結構測定
1.2.4.1 紫外光譜分析 參考李秋雨等[13]方法并稍作修改。2 mg/mL 的膠原蛋白溶液。室溫條件下用紫外分光光度計于200~400 nm 波長范圍內進行掃描,波長間隔為1 nm,以蒸餾水為空白對照。
1.2.4.2 掃描電子顯微鏡分析 參考賈偉[14]方法并稍作改動。使用手術刀將適量凍干后的牛骨膠原蛋白切成約3×3×2 mm 的薄片均勻粘貼在雙面導電膠上,真空噴金后進行牛骨膠原蛋白微觀結構掃描觀察,放大倍數為500 倍,加速電壓為1.0 kV。
1.2.4.3 SDS-PAGE 分析 將蛋白質樣品溶液與2x 樣品緩沖液按照1:1 比例混合后,沸水浴5 min,冷卻后取上清液15 μL 上樣。濃縮膠10%,分離膠5%。采用直壓恒流電源,濃縮膠電壓120 V,分離膠電壓160 V,結束后,用考馬斯亮藍R-250 染色40 min,脫色至透明后,用凝膠成像儀觀察分析[15]。
1.2.4.4 傅里葉紅外色譜分析 參考蔡路昀等[16]的方法:取一定質量的牛骨膠原蛋白與等量的溴化鉀混合研磨壓片,置于多次衰減全反射附件上掃描,采用OMNIC 軟件記錄光譜圖,掃描波長范圍設置為4000~450 cm-1,分辨率為1 cm-1
1.2.4.5 蛋白質表面疏水性測定 1 mg/mL 蛋白樣品溶液取1 mL 加入100 μL 1 mg/mL 的溴酚藍(BPB),混合5 min 后,于4 ℃下,5000 r/min 離心15 min,取上清液在595 nm 下測定其吸光值,記作A。同時以磷酸鹽緩沖液作空白對照,記作A0[17],計算如下:

1.3 數據處理
每個指標至少平行測定三次,利用Excel 對數據進行整理,結果用Mean±SD 來表示,并采用SPSS軟件進行數據分析和差異顯著性分析(ANOVA)檢驗(P<0.05)。使用Origin 2018 進行數據分析、圖表繪制并進行結果分析。
2 結果與分析
2.1 膠原蛋白得率
不同提取方法下膠原蛋白得率如圖1所示。由圖1可知,ASC1,ASC2 膠原蛋白得率分別為2.23%、2.02%,PSC1,PSC2 膠原蛋白得率則可達到3.23%、3.01%。酶法提取膠原蛋白得率顯著高于酸法(P<0.05),且乙酸的提取效率略高于檸檬酸。酶法(PSC1和PSC2)膠原蛋白得率高于酸法(ASC1 和ASC2)的原因可能是在最適反應條件下,酶促反應的高效性和專一性使得膠原蛋白得率更高。ASC1 與ASC2相比,ASC1 的得率高于ASC2 的原因可能是相同摩爾濃度下(0.5 mol/L),H+的解離程度不同,使得最終溶液的pH 不同,因此,相同濃度下,檸檬酸的pH 高于乙酸,影響膠原蛋白的提取效果,最終造成ASC1的得率高于ASC2。王曉軍等[18]使用乙酸和胃蛋白酶提取牦牛骨膠原蛋白,其酸法和酶法提取膠原蛋白的得率分別為2.24%、3.32%。胡建平[19]采用胃蛋白酶在不同酸性環境下酶解魚鱗得到膠原蛋白,實驗結果表明乙酸的提取率高于檸檬酸和鹽酸,本研究結果為酶法膠原蛋白得率高于酸法,與上述結論相符。

圖1 不同提取方法下的膠原蛋白得率Fig.1 Collagen yield under different extraction methods
2.2 紫外光譜分析
由圖2可知,不同方法提取得到的牛骨膠原蛋白的紫外光譜分別位于228、231、233、231 nm 處。四種膠原蛋白的紫外光譜基本一致,這是由于膠原蛋白不含有色氨酸,且苯丙氨酸和酪氨酸含量極低,使得紫外掃描下膠原蛋白在280 nm 處基本不出現吸收峰,而在230 nm 波長附近出現最大吸收峰,這可能由于膠原蛋白中的羰基、羧基和酰胺基團共同作用所致[20]。酸法和酶法提取得到的膠原蛋白紫外吸收峰不一致,可能是酶法提取過程中蛋白質的特定切割位點使最終得到的氨基酸組成和種類存在部分差異。ASC1 和ASC2 紫外最大吸收峰差異可能是由于提取膠原蛋白的酸種類及pH 不同影響其特定氨基酸的比例的大小,從而使得提取得到的膠原蛋白于230 nm 處發生向左或向右的偏移。何蘭[21]利用酸法、酶法提取長骨中膠原蛋白在223、219 nm 處有最大紫外吸收值,Madhuri[22]報道的魚皮膠原蛋白在230 nm 波長附近具有最大紫外吸收值,與本實驗結果一致。

圖2 不同提取方法下的膠原蛋白紫外光譜Fig.2 Ultraviolet spectra of collagen under different extraction methods
2.3 SDS-PAGE 凝膠電泳分析
對不同提取方法下得到的牛骨膠原蛋白進行聚丙烯酰胺凝膠電泳分析,如圖3所示。由圖3可知,不同提取方法制得的膠原蛋白均具有β(約250 kDa)、α1(約135 kDa)、α2(約130 kDa)三條顯著條帶。ASC1、ASC2 的β鏈條帶細、顏色淺,而PSC1、PSC2 的β鏈條帶較為明顯,這可能是由于胃蛋白酶的存在促使膠原蛋白中γ鏈降解為β鏈而造成PSC1、PSC2 的β鏈條帶較深。ASC1、ASC2 的α1、α2肽鏈含量略低于相應的PSC1、PSC2 的兩條α肽鏈,這可能是胃蛋白酶的作用使部分膠原蛋白降解成小分子,使PSC1 和PSC2 的兩條α肽鏈含量增多。β二聚體為兩條α鏈形成的膠原分子,β鏈的存在是膠原蛋白高度交聯的表現,由此可判斷出所得到的膠原蛋白符合Ⅰ型膠原蛋白的特征;與上述紫外光譜結果一致。本研究結果與海蜇[23]、紅鼓魚鱗[24]、尼羅羅非魚鱗[25]等其他來源的Ⅰ型膠原蛋白電泳圖相似。此外,與酸溶性膠原蛋白相比,酶溶性膠原蛋白在100 kDa 附近存在淺細的條帶,其原因可能是酶法提取過程中酶的作用使膠原蛋白酶解為其他小分子[26]。
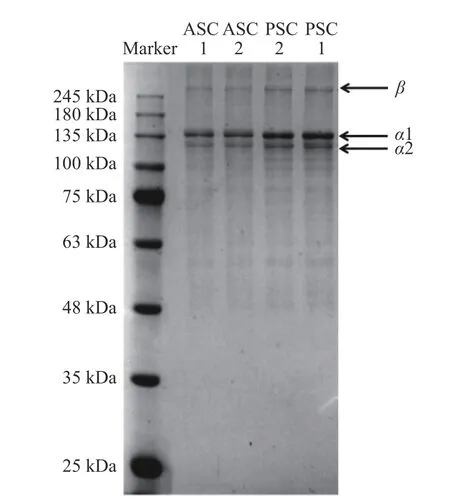
圖3 不同提取方法下膠原蛋白的SDS-PAGEFig.3 SDS-PAGE of collagen under different extraction methods
2.4 表面疏水性分析
研究發現,蛋白質疏水性在其構象和溶解性、乳化性等功能特性方面發揮著關鍵作用,因此對疏水性進行測定可以評價蛋白質三級結構的改變。本研究通過測定并計算結合態溴酚藍的量來表征膠原蛋白的疏水性[27]。對不同提取工藝下牛骨膠原蛋白的表面疏水性進行測定,結果如圖4所示。由圖4可知,PSC1 膠原蛋白的表面疏水性可達5.49 μg,ASC2 膠原蛋白的表面疏水性低至2.64 μg。且ASC2、PSC1、PSC2 表面疏水性差異顯著(P<0.05),但ASC1 和PSC2 差異不顯著。酶法提取的膠原蛋白疏水性較高可能是由于在提取過程中,胃蛋白酶切割牛骨蛋白的非螺旋區段,使所得膠原蛋白疏水性大幅增大;此外,胃蛋白酶特定的酶切位點使膠原蛋白的疏水性基團暴露,特別是疏水性氨基酸含量增多,表面疏水性增加。ASC1 顯著(P<0.05)高于ASC2 的原因可能是乙酸的pH 較低,在此條件下提取的膠原蛋白的表面疏水基團(如色氨酸、苯丙氨酸、纈氨酸、亮氨酸、異亮氨酸、丙氨酸、脯氨酸和蛋氨酸等疏水性氨基酸)暴露更多,因此ASC1 較ASC2 的表面疏水性大。

圖4 不同提取方法下牛骨膠原蛋白的表面疏水性Fig.4 Surface hydrophobicity of bovine collagen under different extraction methods
王立宇等[28]采用酸酶法提取了室溫下堿發的毛肚中膠原蛋白并利用溴酚藍法測定其表面疏水性,其值達到72~75 μg。與上述研究結果對比,本實驗測得膠原蛋白的表面疏水性較小,可能是由于膠原蛋白的來源、提取方法等因素的差異,使得疏水性氨基酸被包裹在內部,游離的疏水性氨基酸較少,造成牛骨膠原蛋白表面疏水性小。
2.5 紅外光譜分析
圖5為采用酸法(ASC1、ASC1)及酶法(PSC1和PSC2)提取工藝下牛骨膠原蛋白在波數4000~450 cm-1紅外吸收譜圖。如圖5所示,從下而上的四種膠原蛋白的紅外光譜特征吸收峰相似,酸溶性膠原蛋白與酶溶性膠原蛋白在3400 cm-1附近均出現明顯的吸收峰,其為酰胺A 帶,這是由于N-H 收縮振動引起,說明肽鏈之間存在氫鍵,且其為蛋白質的特殊吸收峰;圖中四種膠原蛋白酰胺Ⅰ帶吸收峰分別為1551.75、1605.75、1618.18、1581.54 cm-1,這是由于C-O 伸縮振動會引起酰胺Ⅰ帶(1550~1660 cm-1)出現吸收峰,其與蛋白質的二級結構密切相關;四種膠原蛋白分別在1421.45、1558.39、1504.39、1492.82 cm-1處出現吸收峰,其值在酰胺Ⅱ帶的特征吸收峰1400~1600 cm-1范圍內,酰胺Ⅱ帶與蛋白質的C-N 收縮振動和N-H 彎曲振動有關;此外,還與甘氨酸骨鏈及脯氨酸側鏈的-CH2 擺動引起的振動有關[3],從而使得膠原蛋白在1400~1500 cm-1存在復雜的吸收峰;四種膠原蛋白分別在1317.30、1300.82、1213.12、1323.09cm-1出現酰胺Ⅲ帶的特征吸收峰,可能是側鏈基團會出現多種類型的變形振動造成的。因此,紅外光譜表明四種膠原蛋白二級結構保留完整,間接說明了所提的膠原蛋白保留完整。本研究結果與Gao 等[29]對羊骨膠原蛋白結構,Maria等[30]對羅非魚皮,Ali 等[31]對金魚皮的研究結果一致,酶法和酸法提取均可以保留膠原蛋白的三股螺旋結構。牛骨膠原蛋白的吸收峰由酰胺A、B 和酰胺Ⅰ、Ⅱ、Ⅲ組成。

圖5 不同提取方法下膠原蛋白的紅外光譜Fig.5 Infrared Spectra of collagen under different extraction methods
2.6 掃描電鏡分析
不同提取方法下得到牛骨膠原蛋白掃描電鏡結果如圖6。由圖6可知,提取方法顯著影響膠原蛋白的結構(P<0.05)。酸溶性膠原蛋白較為松散,呈現出纖維狀纏繞狀態。ASC1、ASC2 分布均勻,具有多孔的網絡結構。膠原蛋白在提取過程中,通過氫鍵和疏水作用等形成纖維狀[32],不同的作用力導致膠原蛋白之間孔徑大小不同,外部特征等都存在一定的差異。酸法提取過程中膠原蛋白本身的空間結構沒有被破壞,而PSC1、PSC2 的掃描電鏡結果表明酶對膠原蛋白的結構有一定的影響,但其網狀結構仍然得到保留,纖維化相較明顯。王杉杉等[33]采用不同的提取方法提取牦牛皮膠原蛋白并進行電鏡掃描發現,膠原蛋白的結構和形貌存在顯著差異,Li 等[34]對中華絨鱉甲殼組織膠原蛋白電鏡掃描后,結果表明酸法提取的膠原蛋白表現出更松散更多孔的網狀結構,本研究結果與上述研究一致。通過對ASC1、ASC2 和PSC1、PSC2 的電鏡掃描結果進行分析可知,膠原蛋白的提取方法不同,其形狀結構也截然不同。綜合紫外可見光譜、紅外光譜、SDS-PAGE 和掃描電子顯微鏡結果表明,酸法和酶法所提取的蛋白質均保留了其特有的結構。

圖6 不同提取方法下膠原蛋白的掃描電鏡圖Fig.6 Scanning electron microscope images of collagen under different extraction methods
3 結論
本研究以牛骨為研究對象,采用不同提取方法分別得到膠原蛋白ASC1、ASC1、PSC1 和PSC2,并對其性質進行比較分析,結果表明PSC1(乙酸和胃蛋白酶)得率可達3.23%,四種膠原蛋白均由β(約250 kDa)、α1(約135 kDa)、α2(約130 kDa)三種亞基構成,為典型的Ⅰ型膠原蛋白,空間結構也均保留完整;然而,酸法制備的膠原蛋白表現出更松散、更多孔的網狀結構,而酶法提取的膠原蛋白的網狀結構保留更完整,纖維化更明顯。本研究為牛骨膠原蛋白的結構特性研究提供了一定的理論基礎,為牛骨膠原蛋白的高值化利用提供了理論依據。但大規模、短時間提取和生產牛骨膠原蛋白的最佳工藝和過程控制條件仍需繼續探討,牛骨膠原蛋白的工業化制備及應用仍需深入探究。

