葫蘆茶苷通過調控Nrf2/HO-1信號通路抑制肝星狀細胞增殖活化的作用▲
韋璐瑩 盧清華 甘昌鑫 謝冬梅 唐愛存
(廣西中醫藥大學第一附屬醫院宣傳辦公室,南寧市 530023,電子郵箱:wly24312@163.com)
肝星狀細胞(hepatic stellate cell,HSC)增殖活化是肝纖維化進展的主要特征。HSC是細胞外基質(extracellular matrix,ECM)的主要合成細胞,正常情況下HSC處于靜止狀態,但在肝臟不斷受到慢性損傷的刺激后HSC被激活,其表型由靜止型轉變為激活型[1-2]。HSC活化后轉化為肌成纖維細胞,肌成纖維細胞通過旁分泌與自分泌作用使HSC增殖,并合成大量的ECM,同時ECM的降解減少,以致其在肝內大量沉積,肝纖維化逐漸形成。因此,HSC的活化是肝纖維化的細胞學基礎,是肝纖維化發生、發展的中心環節[3-4]。目前,越來越多的學者選擇HSC作為治療的靶標研發抗肝纖維化藥物。
葫蘆茶苷是從壯藥葫蘆茶中提取分離得到的活性化合物。本課題組前期研究表明,葫蘆茶苷具有顯著的保肝和抗肝纖維化作用,其保肝作用機制可能與其抗氧自由基、抑制脂質過氧化作用和下調Caspase-3和Caspase-8的活性有關[5-6];其抗肝纖維化機制可能是通過清除自由基和抑制炎性反應,抑制膠原合成與沉積,減輕HSC的活化[7-8]。但葫蘆茶苷抗肝纖維化的具體作用及對相關信號通路的調節機制尚未完全清楚。核因子E2相關因子2(nuclear factor erythroid 2-related factor 2, Nrf2)/血紅素加氧酶1(heme oxygenase 1, HO-1)信號通路參與肝臟的氧化應激反應,可以抑制NLRP3炎性小體活性,減輕氧化應激與炎癥反應,從而抑制肝星狀細胞活化。本實驗使用LX-2細胞建立體外HSC活化模型, 并基于Nrf2/HO-1信號通路進一步探討葫蘆茶苷抗肝纖維化的作用及其機制,以期為葫蘆茶的臨床應用提供理論基礎和實驗依據。
1 材料與方法
1.1 藥品與試劑 葫蘆茶苷樣品(純度>98.0%)由本課題組從葫蘆茶中分離而得,先采用水提正丁醇萃取,再分別采用硅膠柱色譜法、凝膠柱色譜、反相高效液相半制備色譜法得到葫蘆茶苷樣品。采用無血清高糖杜氏改良伊戈爾培養基(Dulbecco′s modified Eagle medium,DMEM)配成濃度為500 μg/mL的母液,-4 ℃保存備用。高糖DMEM由美國Gibco公司生產(批號:8118290);胎牛血清由AusGeneX公司生產(批號:FBS00819-1);胰蛋白酶由美國Amresco公司生產(批號:0761);轉化生長因子β1(transforming growth factor β1,TGF-β1)培養液、MTT由美國Sigma公司生產(批號分別為GF346、M2003);TRIzol試劑由美國Invitrogen公司生產(批號:15596026),反轉錄試劑由德國 Thermo公司生產(批號:K1622);瓊脂糖由西班牙Biowest公司生產(批號:11860);PBS由福州邁新生物技術開發有限公司生產(批號:8120140);SYBR熒光定量PCR試劑盒由日本TaKaRa公司生產(批號:C-19864);RIPA裂解液(含1%蛋白酶抑制劑)、SDS-PAGE蛋白上樣緩沖液、Western電泳液、Western 轉膜液均由上海碧云天生物技術有限公司生產(批號分別為P0013B、P0015、P0015、P0021A);Ⅰ型膠原蛋白(collagen type Ⅰ,ColⅠ)、Ⅲ型膠原蛋白(collagen type Ⅲ,ColⅢ)和α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)ELISA檢測試劑盒均購自南京建成生物工程研究所(批號分別為20201210、20201210、20200705),其他試劑均為分析純;α-SMA、ColⅠ、Nrf2、HO-1多克隆抗體由武漢三鷹生物技術有限公司生產(批號分別為00075696、00066288、00032518、00075847);山羊抗兔IgG二抗由美國Abbkine公司生產(批號:ATSMR2201);ECL化學發光顯影液由上海愛必信生物科技有限公司生產(批號:EL0419004)。
1.2 主要儀器 Model 311型CO2孵箱由美國Thermo Fisher Scientific生產;ACB-4A1細胞超凈臺由新加坡藝思高科技有限公司生產;CKX-41型熒光倒置顯微鏡由日本奧林巴斯株式會社生產;Model 450型自動酶標儀、ABI 9700型實時熒光定量PCR儀、HD-4N型核酸蛋白測定儀、Micro 17R低溫高速離心機均由美國Bio-Rad公司生產;EM10-7-10型水平電泳儀由美國 Major Science公司生產;LI-COR Odyssey CLx型雙色紅外熒光掃描成像系統由美國 LI-COR公司生產;722型可見分光光度計由上海精密科學儀器有限公司生產。
1.3 細胞株來源和細胞培養 LX-2 細胞購自中國科學院細胞庫,本實驗室自行培養傳代。采用高糖DMEM將凍存的LX-2細胞復蘇,并采用含青霉素(10萬單位)、鏈霉素(10萬單位)及10 %胎牛血清的高糖DMEM作為培養液,將LX-2細胞置于37 ℃、5% CO2的恒溫培養箱中培養,每天觀察細胞生長情況,每兩天更換一次細胞培養液,待細胞貼壁并長滿后,采用0.25 %胰酶消化并傳代,取對數生長期的細胞進行后續試驗。
1.4 MTT法檢測葫蘆茶苷對LX-2細胞增殖的影響 將對數生長期的LX-2細胞調整為5×103個/mL的細胞懸液,并接種于96孔培養板中,每孔100 μL,分為空白對照組、模型組、不同濃度(10、20、40、80、160 μg/mL)葫蘆茶苷組進行實驗,每組6個復孔。將各組細胞置于37 ℃、5% CO2的恒溫培養箱中培養,待細胞密度達至60%左右,棄去舊培養液,加入新培養液,除空白對照組外,其余各組加入終濃度為5 μg/L的TGF-β1刺激細胞增殖活化;刺激24 h后,葫蘆茶苷各劑量組給予相應濃度的藥物(給藥體積為100 μL)干預,空白對照組和模型組加入等體積的含10 %胎牛血清的高糖DMEM培養。繼續培養24 h后,棄去各孔中的培養基,加入20 μL終濃度為5 mg/mL的MTT溶液,置于37 ℃、5% CO2的恒溫培養箱中孵育4 h,棄去上清液,每孔加入200 μL的二甲基亞砜溶液,振搖10 min,采用全自動酶標儀在波長為490 nm處檢測各組光密度A490值。細胞抑制率(%) = (給藥組A490值-空白組A490值)/(陰性對照組A490值-空白組A490值)×100%。實驗重復6次。
1.5 ELISA檢測細胞上清液ColⅠ、ColⅢ和α-SMA的表達水平 將對數生長期的LX-2細胞調整濃度為5×103個/mL的細胞懸液,并接種于96孔培養板中,每孔200 μL,分為空白對照組、模型組、葫蘆茶苷低中高劑量組(20、40、80 μg/mL)進行實驗,每組6個復孔。將各組細胞置于37 ℃、5% CO2的恒溫培養箱中培養,待細胞密度達60%左右,除空白對照組外,其余各組加入終濃度為5 μg/L的TGF-β1刺激細胞增殖活化;刺激24 h后,葫蘆茶苷各劑量組給予相應濃度的藥物(給藥體積為100 μL)干預,空白對照組和模型組加入等體積的含10 %胎牛血清的高糖DMEM培養。繼續培養24 h后,收集各組細胞上清液,分別按照試劑盒說明書,采用ELISA測定細胞上清液中ColⅠ、ColⅢ和α-SMA的表達水平。實驗重復6次。
1.6 定量PCR法檢測細胞中α-SMA、ColⅠ、Nrf2、HO-1 mRNA的表達水平 按照1.5步驟中的方法進行細胞分組和給藥干預,培養24 h后,棄去細胞上清液,收集各組細胞,嚴格按照TRIzol試劑盒說明書提取細胞總RNA,并采用微量核酸檢測儀測定RNA純度和濃度,再將RNA反轉錄成cDNA,然后進行定量PCR檢測。PCR的反應體系:SYBR Green Master Mix 10 μL,上下游引物各1 μL,cDNA模板1 μL,ddH2O補足至20 μL。反應條件:95 ℃預變性10 min;95 ℃變性15 s,55 ℃退火60 s,72 ℃延伸30 s,共40個循環。以GAPDH為內參基因。本實驗中α-SMA、ColⅠ、Nrf2、HO-1 GAPDH基因的引物設計、合成及驗證均由大連TaKaRa寶生物工程有限公司完成。PCR擴增實驗操作嚴格按照TaKaRa公司試劑盒說明書進行,采用2-△△Ct法分析各基因在細胞中的相對表達水平。各基因引物序列見表1。實驗重復6次。
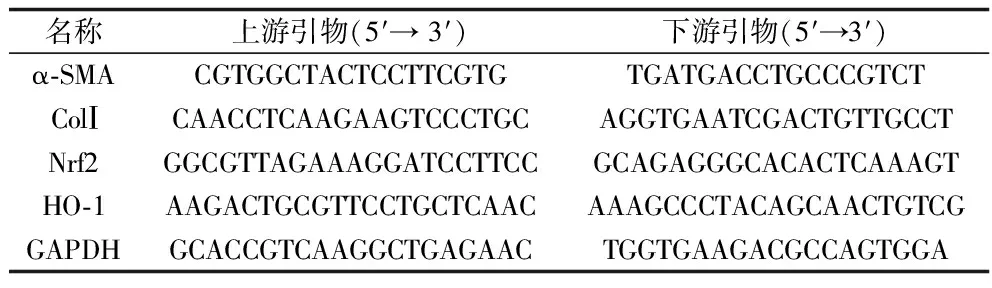
表1 基因引物序列表
1.7 Western blot檢測細胞中α-SMA、ColⅠ、Nrf2、HO-1蛋白的表達水平 按照1.5步驟中的方法進行細胞分組與給藥干預,連續培養24 h后,棄去細胞上清液,收集各組細胞,用RIPA裂解細胞獲得總蛋白,使用微量核酸檢測儀檢測細胞總蛋白的濃度,以蛋白裂解液空白調零。采用10%SDS-PAGE進行蛋白質的電泳分離,再進行轉膜將蛋白轉移到聚偏氟乙烯膜上,然后用5%脫脂奶粉封閉液封閉膜1 h,以TBST緩沖液洗膜3次(5 min/次)后,再分別加入均為1 ∶1 000稀釋的α-SMA、ColⅠ、Nrf2、HO-1、GAPDH多克隆抗體,4 ℃孵育過夜,TBST緩沖液洗膜3次,然后加入1 ∶1 000稀釋的山羊抗兔IgG二抗室溫孵育2 h后,再用TBST 緩沖液清洗,最后以ECL化學發光顯影液顯影,采用ImageJ 2×軟件檢測蛋白條帶的灰度值,以目標蛋白與內參蛋白(GAPDH)灰度值的比值作為目的蛋白的相對表達水平。實驗重復6次。
1.8 統計學分析 采用SPSS 22.0軟件對數據進行統計處理。計量資料以(x±s)表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1 葫蘆茶苷對LX-2 細胞增殖的影響 與空白對照組比較,模型組細胞增殖明顯(P<0.05);與模型組比較,葫蘆茶苷各劑量組LX-2 細胞的增殖均受到抑制(均P<0.05),且隨著葫蘆茶苷藥物劑量的增加,抑制效果越明顯(均P<0.05),見表2。10 μg/mL葫蘆茶苷抑制率偏低,而160 μg/mL葫蘆茶苷抑制率過高,故選取抑制率適宜的劑量20、40、80 μg/mL進行后續實驗。
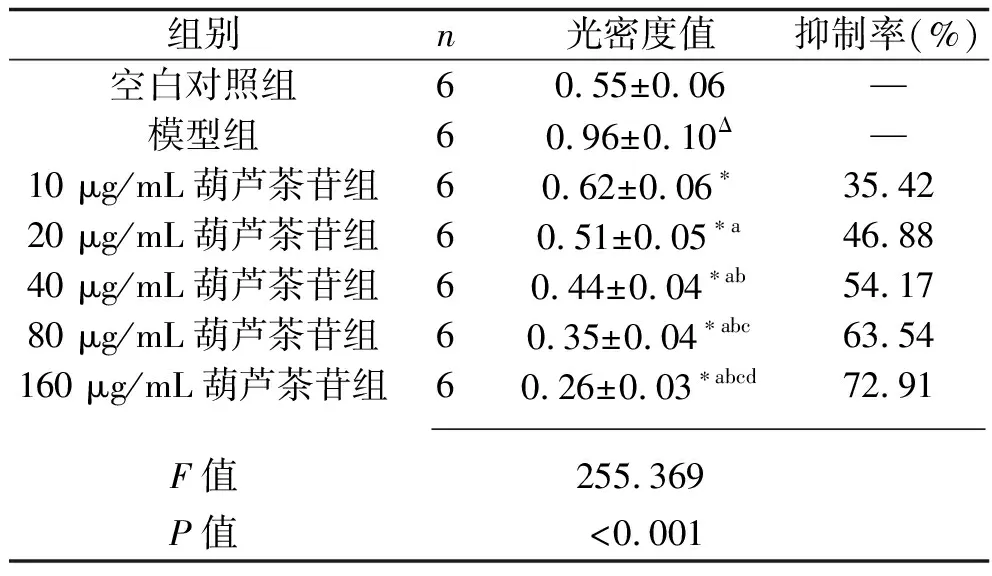
表2 7組LX-2細胞的增殖情況比較(x±s)
2.2 葫蘆茶苷對LX-2細胞上清液ColⅠ、ColⅢ和α-SMA表達水平的影響 與空白對照組比較,模型組中ColⅠ、ColⅢ和α-SMA表達水平升高(均P<0.05);與模型組比較,葫蘆茶苷各劑量組細胞上清液中ColⅠ、ColⅢ和α-SMA表達水平降低(均P<0.05)。葫蘆茶苷低、中、高劑量組中的ColⅠ、α-SMA表達水平依次降低(均P<0.05);而葫蘆茶苷中、高劑量組中ColⅢ表達水平均低于葫蘆茶苷低劑量組(均P<0.05),但這兩組比較差異無統計學意義(P>0.05)。見表3。

表3 5組LX-2細胞上清液ColⅠ、ColⅢ和α-SMA表達水平的比較(x±s,ng/mL)
2.3 葫蘆茶苷對LX-2細胞α-SMA、ColⅠ、Nrf2、HO-1 mRNA表達水平的影響 與空白對照組比較,模型組中α-SMA和ColⅠ的mRNA表達水平升高(均P<0.05), 而Nrf2和HO-1的mRNA表達水平降低(均P<0.05);與模型組比較,各劑量葫蘆茶苷組細胞中α-SMA、ColⅠ 的mRNA表達水平降低,同時Nrf2、HO-1 的mRNA表達水平上調(均P<0.05)。而葫蘆茶苷中、高劑量組α-SMA mRNA表達水平均低于葫蘆茶苷低劑量組(均P<0.05),但這兩組比較差異無統計學意義(P>0.05);葫蘆茶苷低、中、高劑量組ColⅠ的mRNA表達水平依次降低(均P<0.05);葫蘆茶苷高劑量組Nrf2、HO-1 的mRNA表達水平均高于其他低劑量組(均P<0.05),而葫蘆茶苷低、中劑量組之間差異無統計學意義(均P>0.05)。見表4。
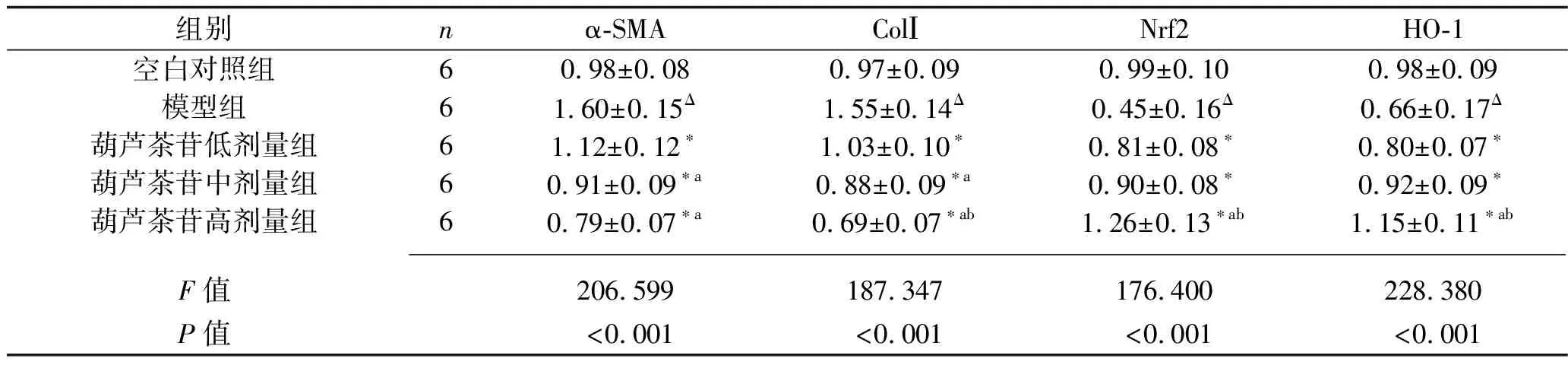
表4 5組細胞α-SMA、ColⅠ、Nrf2、HO-1 mRNA相對表達水平的比較(x±s)
2.4 葫蘆茶苷對LX-2細胞α-SMA、ColⅠ、Nrf2、HO-1蛋白表達水平的影響 與空白對照組比較,模型組中α-SMA和ColⅠ蛋白表達水平升高,而Nrf2和HO-1 蛋白表達水平降低(均P<0.05);與模型組比較,葫蘆茶苷各劑量組α-SMA、ColⅠ蛋白表達水平降低,Nrf2、HO-1 蛋白表達水平升高(均P<0.05)。葫蘆茶苷中、高劑量組中α-SMA、ColⅠ的蛋白表達水平均低于葫蘆茶苷低劑量組(均P<0.05),而中、高劑量組之間差異無統計學意義(均P>0.05);葫蘆茶苷低、中、高劑量組中Nrf2、HO-1 的蛋白表達水平依次升高(均P<0.05)。見表5。
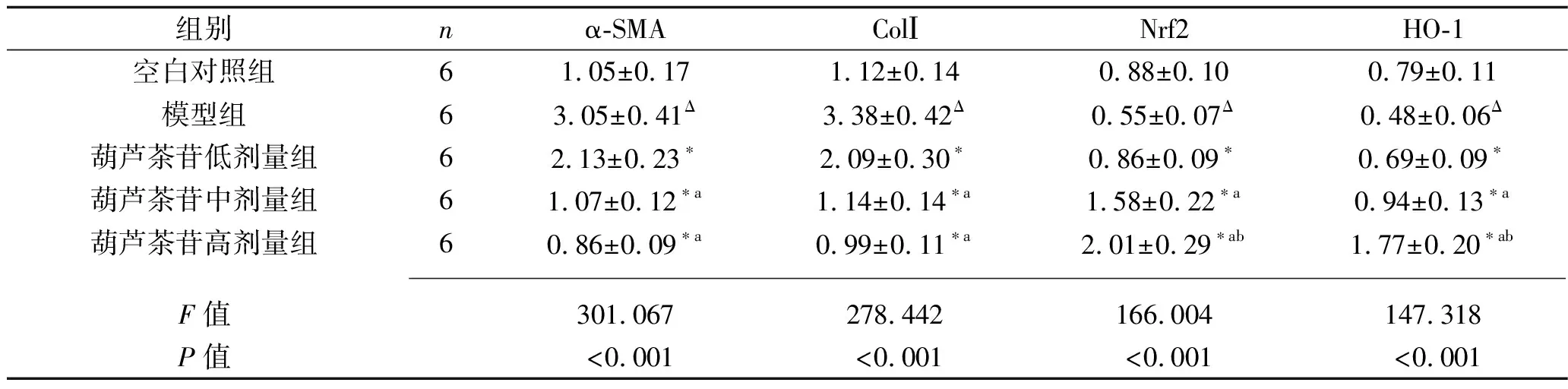
表5 5組細胞α-SMA、ColⅠ、Nrf2、HO-1 蛋白相對表達水平的比較(x±s)
3 討 論
在肝臟受到病毒、炎癥等致病因素刺激后,HSC被激活并轉化為肌成纖維細胞,導致肝細胞內α-SMA表達增多,以及ColⅠ、ColⅢ等ECM成分過度沉積,從而引起肝細胞內膠原蛋白合成和降解失衡,肝內膠原纖維大量增加,肝臟纖維結締組織結構發生異常改變,最終導致肝纖維化的發生[9]。而肝纖維化的持續存在,伴隨著正常肝實質細胞的壞死和凋亡,以及ECM的不斷合成與沉積,這導致肝組織結構的破壞與重建,肝實質逐漸被ECM形成的瘢痕組織所取代,最終引起肝硬化,甚至肝癌[10]。TGF-β1是介導肝損傷及纖維化的最關鍵細胞因子,在細胞外、胞質及胞核內均有表達,研究證實TGF-β1對HSC的激活、轉化、分化及調節具有極其重要的作用,是最強的促HSC纖維化生成因子[11]。本研究結果顯示,經TGF-β1刺激后模型組細胞增殖明顯,且細胞上清液ColⅠ、ColⅢ和α-SMA表達水平升高,細胞中的α-SMA、ColⅠ mRNA和蛋白表達水平亦升高(P<0.05),提示成功建立體外HSC活化模型;在給予葫蘆茶苷干預后,細胞增殖受到抑制,細胞上清液中ColⅠ、ColⅢ和α-SMA表達水平降低,同時細胞中的α-SMA、ColⅠ mRNA和蛋白表達水平亦下調,提示葫蘆茶苷具有明顯的抗肝纖維化作用。此外,隨著葫蘆茶苷干預劑量的增加,細胞增殖的抑制效果越明顯,細胞上清液ColⅠ和α-SMA表達水平、細胞中ColⅠ蛋白表達水平呈下降趨勢(P<0.05),提示該藥物在抑制HSC增殖和抗纖維化作用方面具有一定的劑量依賴性。
Nrf2/HO-1氧化應激信號途徑參與了肝臟的氧化應激損傷,在氧化損傷保護中發揮著重要作用[12]。Nrf2是調節抗氧化應激的重要轉錄因子,在調節肝臟炎癥及纖維化過程中起著重要的作用,其作為HO-1激活的主要轉錄因子,靜息狀態下可在細胞質內與Kelch樣環氧氯丙烷相關蛋白1結合,后者能夠促使Nrf2發生泛素化且被蛋白酶體降解,使得Nrf2的活性受到抑制;但是當體內發生氧化應激時,Nrf2發生磷酸化并與Kelch樣環氧氯丙烷相關蛋白1解離,進而轉移到細胞核上并與抗氧化反應元件序列結合,啟動靶基因轉錄,上調Ⅱ相解毒酶和抗氧化蛋白HO-1的表達,進而發揮抗肝纖維化作用[13]。本研究結果顯示,給予TGF-β1誘導刺激后,模型組中Nrf2、HO-1 mRNA和蛋白的表達水平顯著下降,提示Nrf2/HO-1信號通路與HSC活化存在關聯;在給予一定的葫蘆茶苷藥物干預后,細胞中Nrf2、HO-1 mRNA和蛋白的表達水平上調(P<0.05),提示葫蘆茶苷抑制HSC的增殖活化可能與調控Nrf2、HO-1表達有關。
綜上所述,葫蘆茶苷能抑制TGF-β1誘導的LX-2細胞活化與增殖,具有抗肝纖維化作用,且中/高劑量干預時效果更佳,其機制可能是通過調節Nrf2/HO-1信號途徑而發揮作用。本研究結果或可為進一步深入研究葫蘆茶苷抗肝纖維化作用機制及開發高效的抗肝纖維化新藥奠定基礎。

