枇杷葉粉對植物乳桿菌生長特性的影響
沈智峰,潘虹,胡鋼亮,姜荷,肖舒珺,袁海娜,肖功年*
(1.浙江科技學院 生物與化學工程學院,浙江 杭州 310023;2.浙江省食品工業協會,浙江 杭州 310009;3.杭州千島湖康諾邦健康產品有限公司,浙江 杭州 311705;4.杭州市食品藥品檢驗研究院 浙江省市場局乳及乳制品監管重點實驗室,浙江 杭州 310052)
近年來,關于乳酸菌的研究主要集中在乳酸菌的篩選和功能探究方面,植物乳桿菌(Lactobacillusplantarum)是一類典型的乳酸菌,屬于乳桿菌科乳桿菌屬,革蘭氏陽性菌、兼性厭氧菌。環境適應能力較強,能在10 ℃環境下生長,但溫度到達45 ℃不生長,最適生長溫度為30~35 ℃。耐酸堿性強,在pH 4.5~9.5環境下均能生長,最適pH為6.5左右。植物乳桿菌呈短桿狀,少數呈鏈狀,不產生芽孢,在MRS瓊脂培養基中呈乳白色不透明、中間凸起、光滑、細小密集的菌落,屬于同型發酵菌,能利用葡萄糖、蔗糖、麥芽糖、乳糖等多種糖類產酸。該類菌的活菌數較其他乳酸菌高,在繁殖過程中能產生特有的乳酸桿菌素[1]。
目前關于功能性固體飲料開發的企業越來越多,也有部分企業開始關注乳酸菌與一些枇杷葉、抹茶粉、麥苗粉等新食品原料相結合,開發具有地方特色的新產品。枇杷葉[2]為薔薇科植物枇杷(Eriobotryajaponica)的葉子,又名巴葉、蘆桔葉,含有三萜酸、黃酮、多酚、多糖等成分,具有清肺止咳、和胃利尿、止渴、降血糖、降血脂、抗氧化、抗炎等功效,是衛生部公告批準的新資源食品[3]。枇杷葉粉為枇杷葉干燥研磨后的產物,呈棕黃色粉末狀,能溶于水[4-5]。本文以植物乳桿菌(LactobacillusplantarumKCTC3104)為研究對象,分析枇杷葉粉對其生長特性的影響,探索碳源、氮源的生物轉化,以期為開發相關產品奠定基礎。
1 材料與方法
1.1 材料
菌種為植物乳桿菌(LactobacillusplantarumKCTC3104),為本實驗室自篩。
MRS肉湯、MRS瓊脂購自杭州百思生物技術有限公司;瓊脂購自北京奧博星生物技術有限公司;枇杷葉粉購自杭州千島湖康諾邦健康產品有限公司;蔗糖(分析純AR)購自上海展云化工有限公司;脲(尿素)(分析純AR)購自國藥集團化學試劑有限公司;胰蛋白和大豆蛋白購自上海博微生物試劑有限公司;酵母浸膏購自杭州微生物試劑有限公司
1.2 主要儀器與設備
YXQ-LS-50SII立式壓力蒸汽滅菌器,上海博迅實業有限公司醫療設備廠;潔凈工作臺、HWS型恒溫恒濕器,寧波東南儀器有限公司;FA2004N電子天平,上海菁海儀器有限公司;HH-6數顯恒溫水浴鍋,國華電器有限公司;UV-5200PC紫外可見分光光度計,上海元析儀器有限公司;尼康YS100電子顯微鏡,上海澤仕光電科技有限公司。
1.3 方法
1.3.1 菌落特性觀察
將去離子水滴在干凈的載玻片中間,用灼燒后冷卻的接種環挑取菌落至載玻片上,在室溫下待水分自然蒸發后,用革蘭氏染色法對裝片進行染色。
將染色完成后的裝片放置在電子顯微鏡下先用低倍鏡尋找菌落,后旋轉物鏡調至高倍鏡,調節細準焦螺旋至圖像清晰,確保能看清相應觀察目標后對單個細菌進行觀察。
1.3.2 單菌落分離試驗
稱取MRS肉湯5.2 g至錐形瓶中,加入0.1 L水,振蕩搖勻,使其完全溶解,分裝到若干試管中,塞上橡膠塞裹上牛皮紙滅菌,待滅菌完成后的培養基冷卻后,在超凈臺上用灼燒后冷卻的接種環蘸取菌液至試管中,將接種的試管放置在35 ℃恒溫培養箱中培養12 h[6-7]。
稱取MRS瓊脂6.4 g和相應量的枇杷葉粉于裝有0.1 L水的錐形瓶中,塞上橡膠塞、振蕩搖勻后放入高壓蒸汽滅菌鍋121 ℃滅菌15 min。滅菌完畢取出冷卻至45 ℃左右,在超凈工作臺倒平板,待培養基冷卻凝固后倒置。梯度濃度枇杷葉粉MRS瓊脂培養基配料見表1。
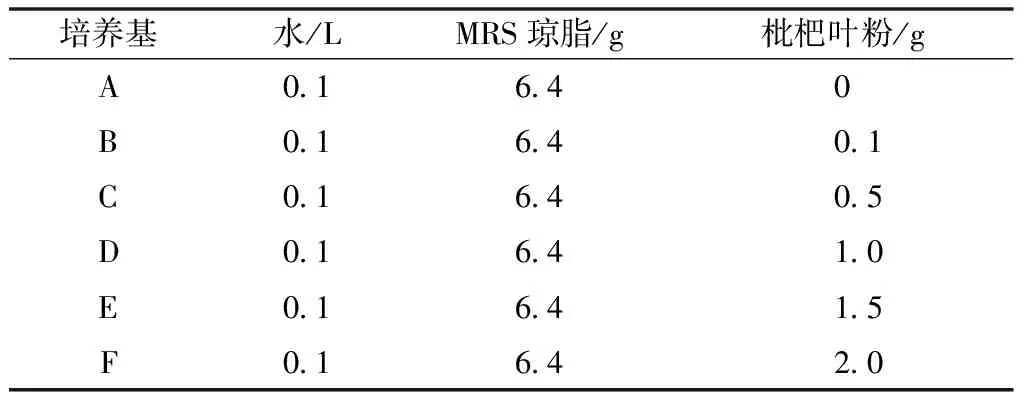
表1 梯度濃度枇杷葉粉MRS固體培養基配料
用移液槍移取1 mL菌液于9 mL無菌水中進行梯度稀釋,共稀釋10-1、10-2、10-3、10-44個梯度進行涂布分離,稀釋后各取0.5 mL菌液至含有不同濃度枇杷葉粉的平板上,用滅菌過的涂布器將菌液均勻涂抹開,倒置后放入35 ℃恒溫培養箱培養,12 h后觀察單菌落形態并記錄。
1.3.3 生長動力試驗
在超凈臺用灼燒后冷卻的穿刺針蘸取菌液后垂直穿入MRS半固體培養基進行接種,并置于35 ℃恒溫培養箱培養。12 h后觀察試管內植入乳桿菌的生長情況并記錄。培養基的配置如表2所示。

表2 梯度濃度枇杷葉粉MRS液體培養基配料
1.3.4 生長曲線初步測定
用接種環蘸取菌液接種到各個試管中,并設置不接種菌液的培養基為對照組,接種完后用無枇杷葉粉的培養基作為對照組對分光光度計(D595)進行調零,對各濃度試管進行吸光值的測量,每隔2~4 h測量1次。
1.3.5 枇杷葉粉濃度對植物乳桿菌生長的影響
重復1.3.4中步驟用接種環蘸取菌液接種到各個試管中,每個梯度濃度均設置一組對照組,每組測量均用對應的對照組進行調零后進行吸光值測量,繪制菌種進行0~12 h的生長曲線(測量時間取接種后0、4、8、12 h)。
1.3.6 額外碳、氮源作用下枇杷葉粉對植物乳桿菌生長的影響
配置MRS液體培養基于錐形瓶,待完全溶解后分裝到若干試管中,標注A~F,加塞后放入高壓蒸汽滅菌鍋,121 ℃滅菌15 min[8],滅菌完畢后置于試管架上冷卻后接種。添加枇杷葉粉和額外碳、氮源的MRS液體培養基配料見表3。試驗步驟參考Fatmawati等[9-10]。
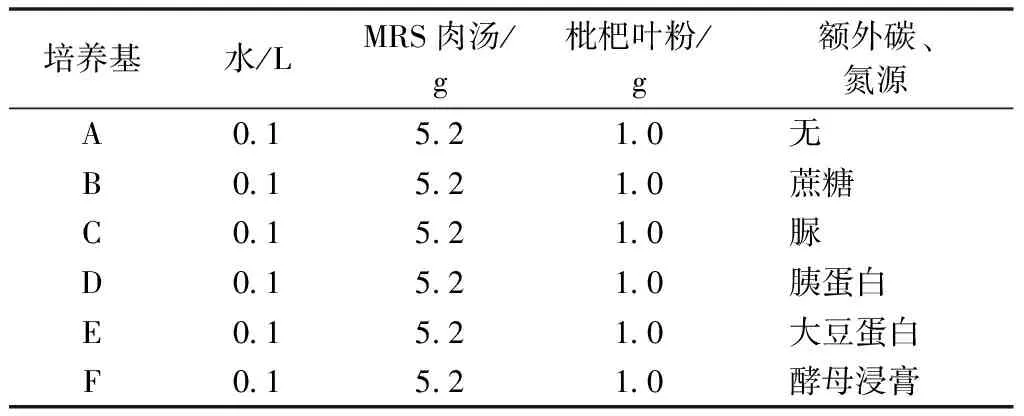
表3 梯度濃度枇杷葉粉MRS液體培養基
1.4 數據處理
采用Origin 2021對試驗數據進行繪圖分析。
2 結果與分析
2.1 菌落特性
植物乳桿菌菌種為直或稍有彎曲的桿狀,單個、偶有成對或成鏈狀,無鞭毛,革蘭氏陽性菌。對菌落進行顯微觀察,目標菌種以直桿狀為主,少數呈彎桿狀,偶有成對和成鏈狀菌,菌種四周光滑,無鞭毛等結構;通過革蘭氏染色法染色后,菌種在顯微鏡(×100油鏡)下呈現藍色或藍紫色(圖1),是明顯的革蘭氏陽性性狀。
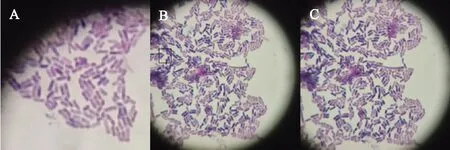
圖1 電子顯微鏡下的植物乳桿菌
對電子顯微鏡下菌種形態對比分析可見,圖1中A菌種呈紫色、桿狀,特性明顯,個體清晰,菌種邊緣光滑,無鞭毛等器官;圖1中B和C菌種呈紫色,少數呈藍紫色,桿狀,形態明顯,個體較為清晰,菌種邊緣光滑,無鞭毛,少數有桿狀連續個體。綜合圖1中A、B、C,此菌種性狀符合植物乳桿菌菌種形態特征,確定為本試驗所需菌種。
2.2 植物乳桿菌的菌落形態
植物乳桿菌單菌落形態為凸起,呈圓形,表面光滑、細密、色白,偶有淺黃或深黃色。對目標菌進行單菌落分離試驗,目標菌單菌落呈現白色圓形凸起狀,偶有淡黃色,菌落表面光滑,周圍光滑無明顯鋸齒,細密。綜合所觀察到的單菌落特點,符合植物乳桿菌單菌落形態特征(圖2~4)。
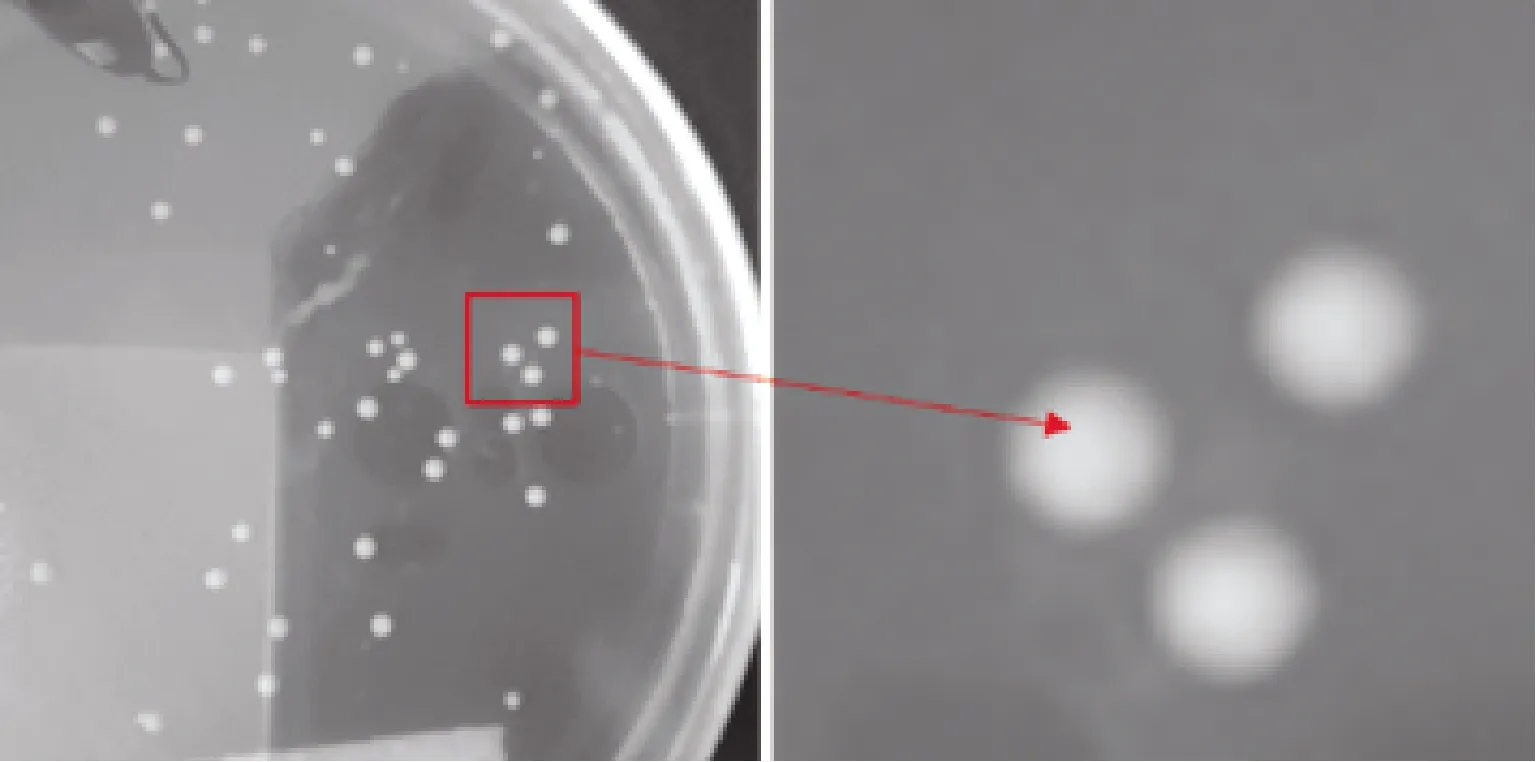
圖2 植物乳桿菌單菌落形態
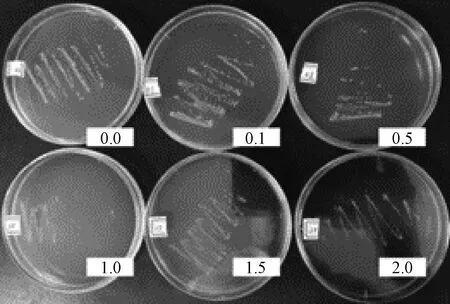
圖3 劃線分離
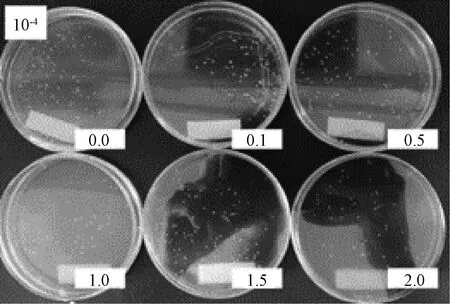
圖4 涂布分離
2.3 涂布分離單菌落
植物乳桿菌單菌落分離實驗通過改變培養基所含枇杷葉粉濃度,用控制變量法探究枇杷葉粉對植物乳桿菌菌落形成的影響。如圖5在0~20.0 g·L-1枇杷葉粉下,培養基上均生長出一定數量的單菌落,當不添加枇杷葉粉時,植物乳桿菌單菌落分離狀況最佳,菌落分布均勻且菌落間區分明顯,計數清晰便捷。當枇杷葉粉濃度提高,相同濃度的菌液所分離出的單菌落少于同等濃度下不加枇杷葉粉的組別。所以植物乳桿菌能在含有枇杷葉粉的環境下進行正常的生長繁殖,但是會受到枇杷葉粉的抑制作用,且枇杷葉粉濃度越高抑制作用越顯著。
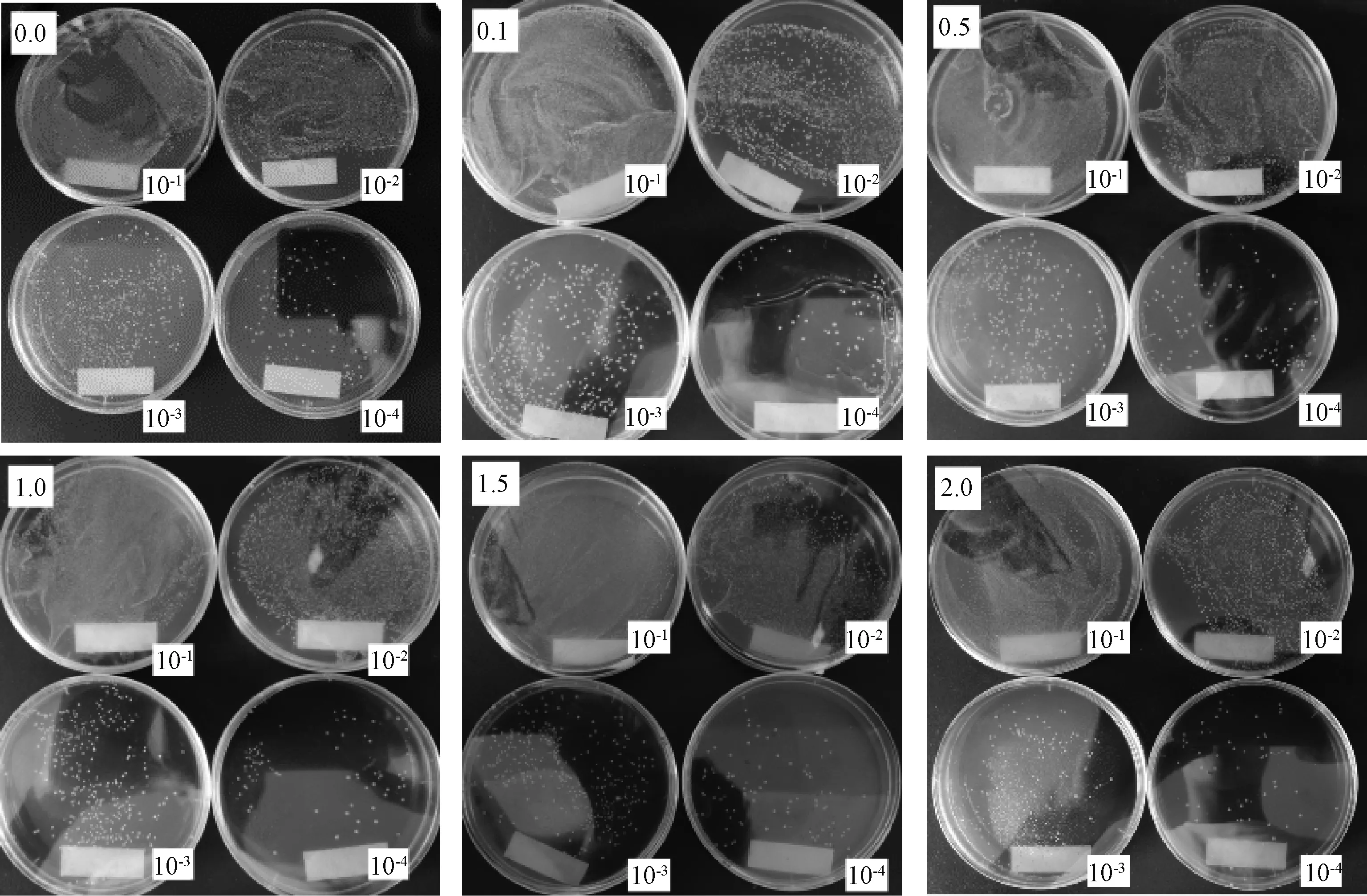
圖5 枇杷葉粉濃度梯度涂布分離
2.4 生長動力試驗結果
植物乳桿菌生長動力采用半固體培養基細菌穿刺試驗開展,試驗結果見表4。試驗兩組在不同濃度的枇杷葉粉環境下,半固體培養基內接種的植物乳桿菌均呈現出沿穿刺路徑生長,并未向四周生長開來的現象,生長路徑整體呈現由粗至細的針狀,粗細變化較小。該現象說明,植物乳桿菌在枇杷葉粉條件下細菌運動性能較差[11-12]。
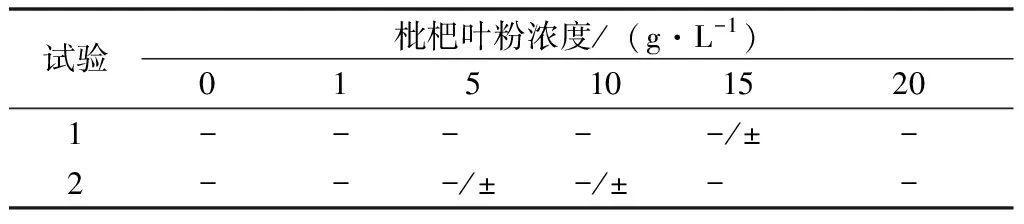
表4 枇杷葉粉濃度對植物乳桿菌生長動力的影響
2.5 生長曲線
以枇杷葉粉為培養基配料,探索不同濃度枇杷葉粉對植物乳桿菌生長特性的影響,試驗結果見圖6。從圖中可以看出,添加枇杷葉粉的植物乳桿菌與未添加枇杷葉粉的植物乳桿菌相比生長情況較慢,說明枇杷葉粉對植物乳桿菌的生長有一定的抑制作用,當添加量為20.0 g·L-1時,植物乳桿菌基本上呈平緩曲線上升,而不添加枇杷葉粉時,植物乳桿菌基本呈陡直線上升,不添加枇杷葉粉在培養10 h后繁殖較快,快于5.0、10.0 g·L-1和20.0 g·L-1組,這可能是由于培養基中含有的枇杷葉粉對植物乳桿菌的生長繁殖或代謝活動產生了抑制作用,并且隨著枇杷葉粉濃度的上升,抑制作用也更加顯著。
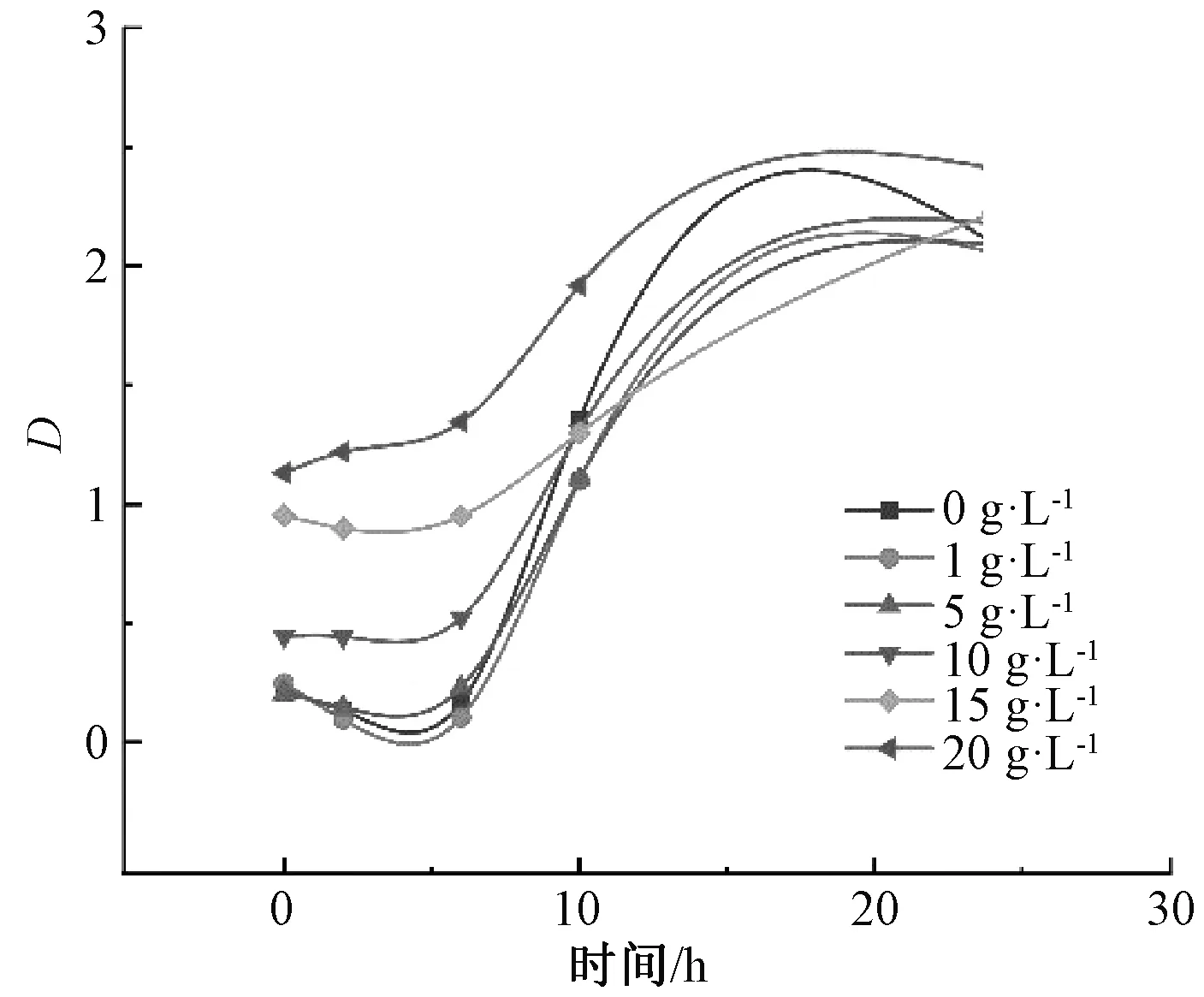
圖6 不同枇杷葉粉濃度對植物乳桿菌生長曲線的影響
2.6 額外碳、氮源對植物乳桿菌生長曲線的影響
在添加了額外碳、氮源后植物乳桿菌的生長特性曲線如圖7。從中可知,在10 h后不添加額外碳、氮源的實驗組吸光值低于添加額外碳、氮源的組別,生長速率也在10 h后低于其他組,說明額外的碳、氮源能夠促進植物乳桿菌的生長繁殖[13]。

圖7 額外碳源、氮源作用下0~12 h植物乳桿菌生長曲線
同時添加額外碳、氮源與枇杷葉粉,探究在添加枇杷葉粉后額外碳、氮源對植物乳桿菌生長特性的影響。如圖8,試驗各組生長速率差距較小,在10 h后,植物乳桿菌的生長趨于平穩,并將逐漸到達穩定,添加枇杷葉粉后植物乳桿菌更快進入穩定期,細菌的生長繁殖速率和衰亡速率趨于相等,說明添加枇杷葉粉后的微生物環境容量降低,枇杷葉粉對于植物乳桿菌的生長繁殖起到了抑制作用。此外,添加枇杷葉粉后各組別吸光值差異較小,額外碳、氮源對于植物乳桿菌的促進作用不顯著,說明在添加枇杷葉粉后,植物乳桿菌的生長繁殖受到抑制。
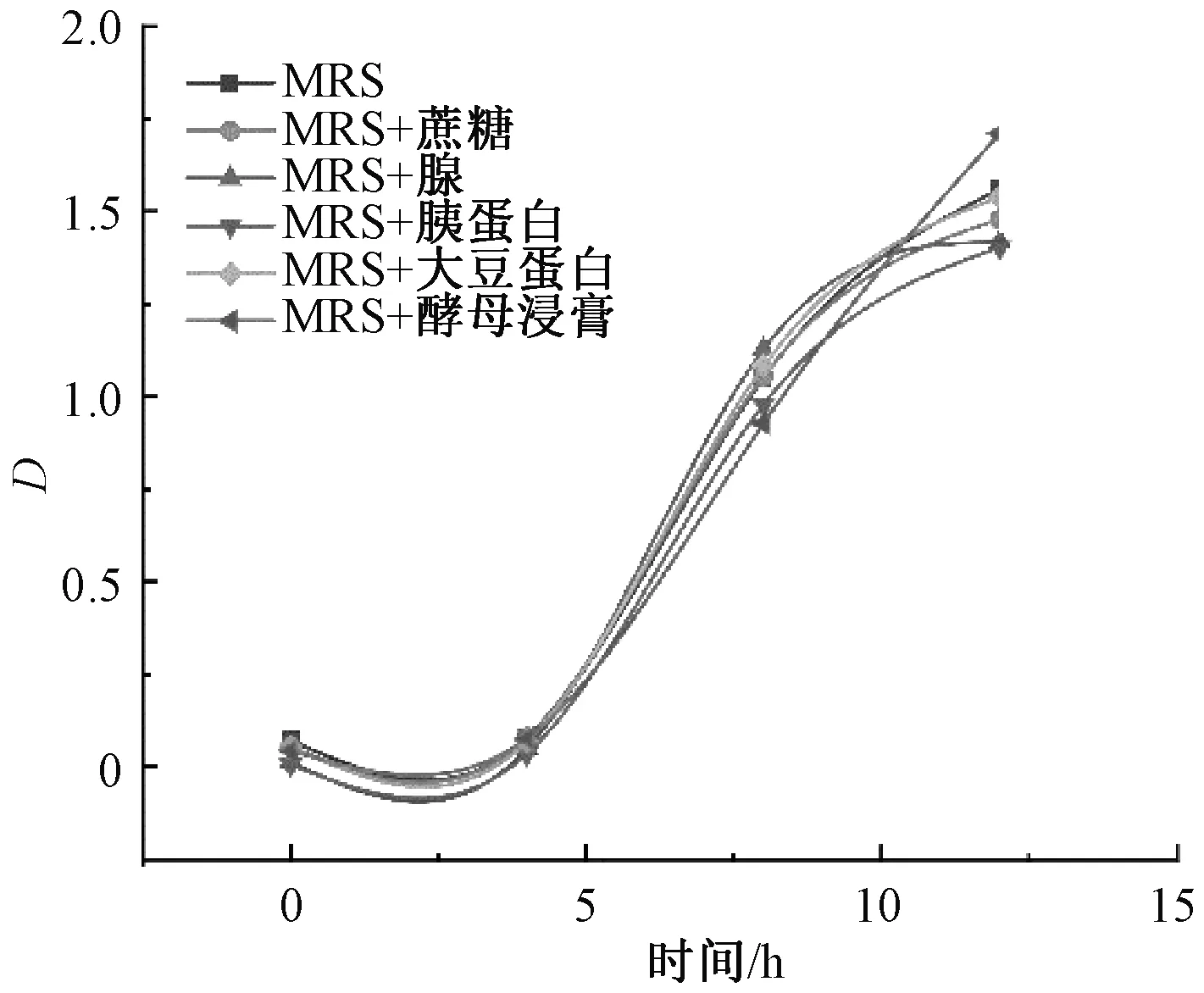
圖8 梯度濃度枇杷葉粉環境中額外碳、氮源作用下0~12 h植物乳桿菌生長曲線
3 小結
本文以植物乳桿菌(LactobacillusplantarumKCTC3104)為研究對象,研究表明,植物乳桿菌能夠在有枇杷葉粉的環境下進行生長繁殖,并且植物乳桿菌的分裂周期不受到影響,但枇杷葉粉的環境會抑制植物乳桿菌生長活性,使菌種的生長速率和最大環境容量降低,并且在試驗所用濃度梯度下,枇杷葉粉濃度越高抑制作用越顯著,并在試驗所設計濃度20.0 g·L-1時抑制作用最強,添加外源的蔗糖、脲、胰蛋白、大豆蛋白、酵母浸膏等碳、氮源物質可促進其生長。

