廣藿香PcHAD基因克隆及其參與廣藿香醇生物合成功能分析
吳帶娣,黃慧玲,單耀楷,鄒 璇,龔麗珍,詹若挺, 3,陳立凱, 3*
? 藥材與資源 ?
廣藿香基因克隆及其參與廣藿香醇生物合成功能分析
吳帶娣1, 2,黃慧玲1, 2,單耀楷1, 2,鄒 璇1, 2,龔麗珍1, 2,詹若挺1, 2, 3,陳立凱1, 2, 3*
1. 廣州中醫(yī)藥大學(xué)中藥學(xué)院,廣東 廣州 510006 2. 嶺南中藥資源教育部重點實驗室(廣州中醫(yī)藥大學(xué)),廣東 廣州 510006 3. 嶺南現(xiàn)代農(nóng)業(yè)科學(xué)與技術(shù)廣東省實驗室茂名分中心,廣東 茂名 525000
從廣藿香中克隆HAD(haloacid dehalogenase)超級家族蛋白水解酶基因,驗證其編碼蛋白與廣藿香醇合酶(patchoulol synthase,PcPTS)蛋白互作,探究其參與調(diào)控廣藿香醇生物合成的作用。從廣藿香轉(zhuǎn)錄組數(shù)據(jù)中,篩選出一條具有完整編碼區(qū)并且包含HAD-like結(jié)構(gòu)域的基因序列(),并對該基因進(jìn)行克隆和生物信息學(xué)分析。利用qRT-PCR對的表達(dá)模式進(jìn)行分析。利用酵母雙雜交實驗進(jìn)一步驗證PcHAD與廣藿香PcPTS蛋白的互作情況。通過瞬時過表達(dá),分析其對廣藿香醇甲羥戊酸合成途徑(mevalonate pathway,MVA)相關(guān)基因的表達(dá)以及對廣藿香醇含量的影響。從廣藿香中克隆得到HAD-like基因,其開放閱讀框為1149 bp,編碼蛋白長度為382個氨基酸,蛋白相對分子質(zhì)量為43 000,且為不穩(wěn)定的親水性蛋白,亞細(xì)胞定位結(jié)果表明該蛋白定位于葉綠體。酵母雙雜交實驗結(jié)果表明PcHAD完整蛋白能與PcPTS完整蛋白互作,且PcHADN與PcPTSN互作。與對照組相比,瞬時過表達(dá)廣藿香葉中的廣藿香醇含量提高了30%,MVA途徑基因包含、和在內(nèi)表達(dá)量均顯著上調(diào)。從廣藿香中克隆得到1個與廣藿香醇合酶PcPTS互作的基因,該基因在瞬時過表達(dá)后上調(diào)和MVA途徑多個基因的表達(dá)量,且能夠顯著提高廣藿香醇的含量,表明該基因可能在廣藿香醇生物合成中發(fā)揮正向調(diào)控作用,為進(jìn)一步揭示廣藿香中HAD-PTS復(fù)合體的功能提供科學(xué)依據(jù)。
廣藿香;廣藿香醇;HAD;蛋白互作;合成調(diào)控;功能分析
廣藿香(Blanco) Benth為唇形科刺蕊草屬植物,其干燥地上部分為藥用部分。廣藿香作為芳香化濕藥的代表之一,具有芳香化濁、開胃止嘔、發(fā)表解暑的功效[1]。廣藿香不僅是中成藥的主要原料,也是抗病毒口服液、藿香正氣水、藿香鼻炎膠囊等中成藥的重要組成部分。廣藿香油是廣藿香提取的揮發(fā)性成分,是廣藿香諸多藥效的主要成分。廣藿香油除了作為藥用,還廣泛用于輕化工業(yè),可作為配制各種殺蟲劑、定香劑和化妝護(hù)膚品等的重要原料[2-4],市場需求大,具有廣闊的應(yīng)用前景。雖然廣藿香已在亞洲熱帶和亞熱帶地區(qū)廣泛種植,如印度、馬來西亞、中國和越南,但從廣藿香植物中提取的廣藿香油含量低(干質(zhì)量比為0.54%~5.20%)且不穩(wěn)定,難以滿足全球市場對廣藿香藥材的巨大需求[5-6]。因此需要系統(tǒng)研究其合成積累機(jī)制,采用新的技術(shù)手段調(diào)控廣藿香油含量,而利用自身代謝途徑是提高廣藿香油產(chǎn)量的有效途徑。
廣藿香醇(patchoulol)是廣藿香油的主要成分,是1種三環(huán)倍半萜類的次生代謝化合物,是我國歷版藥典中用于評價廣藿香藥材及廣藿香油質(zhì)量的指標(biāo)成分。在廣藿香中廣藿香醇主要是在甲羥戊酸途徑(mevalonate pathway,MVA)進(jìn)行合成,其合成主要分為3個階段,第1個階段是異戊烯基二磷酸酯(isopentenyl diphosphate,IPP)和二甲基烯丙基二磷酸(dimethylallyl pyrophosphate,DMAPP)的合成;在前體IPP的合成中,6種酶參與反應(yīng),包括乙酰乙酰輔酶A硫解酶(acetoacetyl-CoA thiolase,AACT)、羥基-3-甲基戊二酰輔酶A合酶(hydroxymethylglutaryl-CoA synthase,HMGS)、3-羥基-3-甲基戊二酰輔酶A還原酶(hydroxymethylglutaryl-CoA reductase,HMGR)、甲羥戊酸激酶(mevalonate kinase,MVK)、磷酸甲羥戊酸激酶(phosphomevalonate kinase,PMK)和甲羥戊酸二磷酸脫羧酶(mevalonate pyrophosphate decarboxylase,MPD),IPP和DMAPP在異戊烯基異構(gòu)酶的作用下可以相互轉(zhuǎn)換;第2階段,廣藿香醇直接前體的生成,法尼基焦磷酸合酶(farnesyl diphosphate synthase,F(xiàn)PPS)縮合IPP和DMAPP以形成法尼基焦磷酸;第3階段,廣藿香醇合酶(patchoulol synthase,PcPTS)催化法尼基焦磷酸生成廣藿香醇[7-8]。根據(jù)廣藿香醇的生物合成途徑可知,PcPTS能直接催化法呢基焦磷酸生成倍半萜類終產(chǎn)物廣藿香醇,是調(diào)控廣藿香醇生物合成的關(guān)鍵,因此PcPTS功能受到了不少研究者的關(guān)注。6-丙酮酰四氫蝶呤合酶基因的克隆[9]、表達(dá)規(guī)律[10]和酶活功能[11]等已有不少報道。另外關(guān)于調(diào)控廣藿香醇合酶的轉(zhuǎn)錄因子的研究已也取得新進(jìn)展,如陳秀珍等[12]找到了調(diào)控的6個轉(zhuǎn)錄因子PatDREB、PatERF061和PatSWC4等,并對其功能進(jìn)行了分析。黃偉展等[13]成功構(gòu)建pRI101-PTS過表達(dá)載體,獲得了遺傳過表達(dá)廣藿香植株,這些研究為探討廣藿香醇生物合成的分子調(diào)控研究奠定了基礎(chǔ)。
絕大多數(shù)蛋白質(zhì)通過配體或者以復(fù)合體的形式參與調(diào)節(jié)細(xì)胞活動,在轉(zhuǎn)錄、翻譯、信號傳遞等方面發(fā)揮了關(guān)鍵作用,因此研究蛋白互作對理解分子調(diào)控網(wǎng)絡(luò)至關(guān)重要。酵母雙雜交是研究植物蛋白間互作非常有用的系統(tǒng),是篩選和發(fā)現(xiàn)新互作蛋白的一項首選技術(shù)[14]。在高通量篩選和嚴(yán)格篩選壓力的基礎(chǔ)上,許多研究通過雙雜交方法獲得了候選獵物蛋白,如小麥[15]、擬南芥[16]、水稻[17]等。也有許多研究通過雙雜驗證2個蛋白之間的互作并明確互作結(jié)構(gòu)域,如小麥[18]、番茄[19]、水稻[20]等。目前對PcPTS在萜類化合物合成途徑中涉及到的蛋白尚不清楚。因此,為了進(jìn)一步解析廣藿香醇生物合成的分子機(jī)制,課題組前期構(gòu)建了廣藿香cDNA酵母文庫,以PcPTS為誘餌,篩選到候選互作蛋白HAD-like蛋白PcHAD。本實驗對基因進(jìn)行克隆和生物信息學(xué)分析、亞細(xì)胞定位分析以及組織表達(dá)模式分析。通過酵母雙雜交技術(shù)驗證PcHAD蛋白與PcPTS蛋白互作,進(jìn)一步利用瞬時過表達(dá)和RT-qPCR分析PcHAD蛋白對廣藿香醇生物合成的調(diào)控作用。本研究揭示PcHAD參與調(diào)控廣藿香醇的生物合成的分子機(jī)制,為藥用植物次生代謝合成調(diào)控提供新的思路。
1 材料、試劑及儀器
1.1 材料
本研究材料廣藿香采集于廣州中醫(yī)藥大學(xué)時珍山,經(jīng)廣州中醫(yī)藥大學(xué)詹若挺研究員鑒定為唇形科刺蕊草屬植物廣藿香(Blanco) Benth.。繁育廣藿香植物在嶺南中藥資源教育部重點實驗室光照培養(yǎng)箱培養(yǎng)。
1.2 試劑
pLB零背景快速克隆試劑盒購自天根生化科技(北京)有限公司植物。總RNA提取試劑盒購自于上海美吉生物醫(yī)藥科技有限公司。反轉(zhuǎn)錄試劑盒、DNA膠回收試劑盒、實時熒光定量PCR試劑盒、PCR酶2×Phanta Master Mix,2×Taq Plus Master Mix II(Dye Plus)、均購自南京諾唯贊生物科技有限公司。DH5α Chemically Competent Cell,GV3101(pSoup-p19),Y2HGold Chemically Competent Cell均購自上海唯地生物科技有限公司。金擔(dān)子素A(aureobasidin A,AbA)、5-溴-4-氯-3-吲哚-α--吡喃半乳糖苷(X-α-Gal)均購自上海翊圣生物科技有限公司。引物合成和基因測序由廣州天一輝遠(yuǎn)基因科技有限公司完成。
1.3 儀器
電泳儀(北京六一生物科技有限公司);凝膠成像儀分析系統(tǒng)(廣州博鷺騰儀器儀表有限公司);CFX960熒光定量PCR儀(美國Bio-Rad公司);PCR儀(杭州博日科技有限公司);激光共聚焦顯微鏡(蔡司ZEISS);Q Exactive mass spectrometer質(zhì)譜儀(Thermo fisher公司)。
2 方法
2.1 PcHAD基因的克隆
課題組前期進(jìn)行酵母雙雜文庫篩選得到候選互作蛋白并利用Uniprot數(shù)據(jù)庫對候選互作蛋白進(jìn)行注釋分析,發(fā)現(xiàn)包含1個含HAD-like結(jié)構(gòu)域的蛋白。為了進(jìn)一步驗證廣藿香中的含HAD-like結(jié)構(gòu)域的蛋白與PcPTS的蛋白互作關(guān)系,本試驗利用其GenBank蛋白序列號下載蛋白氨基酸序列,利用本地Blast方法與廣藿香全長轉(zhuǎn)錄組數(shù)據(jù)庫(NCBI:PRJNA528262)進(jìn)行blastp比對,選取比對分?jǐn)?shù)最高(567),e值為0并具有完整編碼框的基因。根據(jù)獲得的候選基因序列,設(shè)計引物(表1)擴(kuò)增完整編碼區(qū)。
表1 基因克隆及載體構(gòu)建引物序列
Table 1 Primers used for gene cloning and vector construction
基因名引物序列 (5’→3’)用途 PcHADF: ATGGTGGATTCAATTGCTGC基因克隆 R: TCACCAGAATCCATCATCATAAA PcHADF: CATGGAGGCCAGTGAATTCATGGTGGATTCAATTGCTGCAACPGADT7載體 R: GCTCGAGCTCGATGGATCCTCACCAGAATCCATCATCATAAACACCTACT PcHADNF: CATGGAGGCCAGTGAATTCATGGTGGATTCAATTGCTGCAACPGADT7載體 R: CAGCTCGAGCTCGATGGATCCACCTAACCACCCACAACCCAT PcHADCF: GCCATGGAGGCCAGTGAATTCGCTGTATTTGAGTGGGAAGGTGTPGADT7載體 R: GCTCGAGCTCGATGGATCCTCACCAGAATCCATCATCATAAACACCTACT PcPTSF: TCAGAGGAGGACCTGCATATGATGGAGTTGTATGCCCAAAGTGTTPGBKT7載體 R: GCTAGTTATGCGGCCGCTTAATATGGAACAGGGTGAAGGTACAACT PcPTSNF: TCAGAGGAGGACCTGCATATGATGGAGTTGTATGCCCAAAGTGTTPGBKT7載體 R: GGTTATGCTAGTTATGCGGCCGCGTGATGAGATGCGTATTGCTCGTAG PcPTSCF: CAGAGGAGGACCTGCATATGAAAGGCTTGCTCAAACTTGCTPGBKT7載體 R: TATGCTAGTTATGCGGCCGCAACAGGGTGAAGGTACAACTGC PcHADF: AGGACAGCCCAGATCACTAGTATGGTGGATTCAATTGCTGCA亞細(xì)胞定位載體 R: GCCCTTGCTCACCATGGATCCCCAGAATCCATCATCATAAACACC PcHADF: TTCGTGTTCTTGTCATTAATTAAATGGTGGATTCAATTGCTGCA過表達(dá)載體 R: TCAAGTTGCAGGACCGCGGCCGCTCACCAGAATCCATCATCATAAACA
提取廣藿香葉片的總RNA,并反轉(zhuǎn)錄獲得cDNA作模板,利用Vazyme高保真酶對基因進(jìn)行PCR擴(kuò)增。反應(yīng)程序為:95 ℃、3 min;95 ℃變性15 s,56 ℃復(fù)性15 s,72 ℃延伸,33個循環(huán);72 ℃,5 min。PCR產(chǎn)物利用瓊脂糖凝膠電泳檢測,確定擴(kuò)增所得片段與預(yù)期大小一致之后,將目的基因片段純化回收并連接到克隆載體,轉(zhuǎn)化大腸桿菌DH5α,經(jīng)菌落PCR鑒定后挑取陽性菌液,由廣州天一輝遠(yuǎn)基因科技有限公司完成測序。
2.2 生物信息學(xué)分析
首先使用SnapGene軟件將獲得測序序列與原序列進(jìn)行對比初步確認(rèn)所獲序列的正確性,然后使用生物信息分析軟件和在線工具進(jìn)行分析。用ORFfinder預(yù)測其編碼的蛋白,利用ExPASy-ProtParam tool在工具預(yù)測編碼蛋白質(zhì)的理化性質(zhì),分別用SOPMA和SWISSMODEL對PcHAD蛋白的二級結(jié)構(gòu)和三級結(jié)構(gòu)進(jìn)行預(yù)測和分析;采用Uniprot上的BLAST軟件進(jìn)行序列對比分析,下載序列相似性比較高的氨基酸序列利用DNA MAN進(jìn)行同源對比分析。
2.3 亞細(xì)胞定位分析
采用無縫克隆的方法將去除密碼子的片段克隆至載體pAN580綠色熒光蛋白(GFP)標(biāo)簽的N端。通過制備擬南芥原生質(zhì)體,利用聚乙二醇(polyethlene glycol,PEG)介導(dǎo)的方法轉(zhuǎn)化擬南芥原生質(zhì)體[21],在激發(fā)光為470 nm的條件下使用激光共聚焦顯微鏡觀察GFP熒光信號,分析目標(biāo)蛋白的亞細(xì)胞定位情況。
2.4 表達(dá)模式分析
分別提取廣藿香不同組織部位的總RNA,反轉(zhuǎn)錄合成cDNA,使用NCBI設(shè)計基因特異性引物(表2),進(jìn)行qRT-PCR實驗。以為內(nèi)參,基因相對表達(dá)量以2-ΔΔCt進(jìn)行計算。每個樣品包含3個生物學(xué)重復(fù)和2個技術(shù)重復(fù),利用統(tǒng)計學(xué)軟件SPSS 20對數(shù)據(jù)進(jìn)行顯著性分析。
2.5 酵母雙雜驗證
擴(kuò)增帶有coRI和amHI酶切位點的和片段,分別連接至酵母表達(dá)載體pGADT7,構(gòu)建重組質(zhì)粒。將含有deI和otI酶切位點的和片段分別插入pGBKT7載體,獲得重組質(zhì)粒。將pGBKT7-PTS按照說明書方法轉(zhuǎn)化Y2HGold感受態(tài)細(xì)胞,在SD/-Trp缺陷培養(yǎng)基生長2 d得到陽性克隆,將單克隆用100 μL ddH2O混勻,按10倍梯度再稀釋3個濃度,分別點涂于SD/-Trp、SD/-Trp+X-α-Gal、SD/-Trp+X-α-Gal+AbA缺陷培養(yǎng)基上觀察菌斑生長情況。隨后分別將誘餌質(zhì)粒和捕獲質(zhì)粒質(zhì)粒共轉(zhuǎn)化Y2HGold感受態(tài)細(xì)胞,待長出陽性菌落后,挑取單克隆稀釋3個10倍梯度濃度點涂于SD/-Trp-Leu(DDO)、SD/-Trp-Leu-Ade-His(QDO)、SD/-Trp-Leu- Ade-His+X-α-Gal(QDO/X)、SD/-Trp-Leu-Ade- His+X-α-Gal+AbA(QDO/X/A)缺陷培養(yǎng)基上,30 ℃倒置培養(yǎng)3 d,待顯菌斑。
表2 qRT-PCR引物序列
Table 2 Primer used for qRT-PCR
基因名引物序列(5’→3’)用途 Pc18SF: TCGCCGTTCGGACCAAATAA內(nèi)參基因 R: CGATGGTTCACGGGATTCTGC PcHADF: CCAGAGACTTTCGGCATGGTqRT-PCR R: CCACCCACAACCCATCCTTT PcPTSF: TGGGTGCTGCTTCTCGTCCTCqRT-PCR R: TGCGTTGTGGACTTGTTTCG PcFPPSF: TGCCACTTCACCGTCGTATTqRT-PCR R: TTTCAGGCTCACCGAAGCAA PcIPPIF: AAATACGTGAATCGTGACGAGqRT-PCR R: CTTGTTTCAAAGTCCCATTC PcMVDF: AGACACCCACCAACAAGCGqRT-PCR R: CTCCTTTCCGTTGAGCCACA PcPMKF: TCGAAAGGCACCTCAAGACCqRT-PCR R: AAGCATAGCATCTCTGGCCC PcMVKF: ATGAGGTCGCTTCCATCATCqRT-PCR R: TTTCGATTGTAGCATGGCTG PcHMGRF: CACCGTCTTCTTCACGCTCTqRT-PCR R: GCGGGGAATAATGAGCGACT PcHMGSF: ACGGAGCAAGCAAAGGGAAAqRT-PCR R: TTCCAACTTCAAGGCGACCA PcAACTF: TGTGCCTCTGGAATGAAAGCAqRT-PCR R: CAGCATTCCATCAACCAGCG
2.6 在廣藿香葉片中瞬時過表達(dá)PcHAD基因
采用無縫克隆的方法將克隆至pJL-TRBO載體的acⅠ和otI之間,構(gòu)建煙草花葉病毒RNA介導(dǎo)的(Tabacco Mosaic Virus RNA-Based)植物過表達(dá)載體。以空載pJL-TRBO作為陰性對照,將構(gòu)建好的pJL-HAD質(zhì)粒和空載質(zhì)粒轉(zhuǎn)化GV3101(pSoup-p19)菌株,通過農(nóng)桿菌注射法侵染廣藿香葉片。注射后第3天,取侵染后的葉片進(jìn)行基因表達(dá)變化(引物見表2)及揮發(fā)性成分含量的檢測。每組實驗進(jìn)行3次重復(fù)。
2.7 廣藿香揮發(fā)性成分提取與檢測
取瞬時過表達(dá)后廣藿香葉片在液氮下研磨成細(xì)粉,然后用正己烷提取,用氣相色譜-質(zhì)譜聯(lián)用(GC-MS)測定廣藿香揮發(fā)性成分含量[22]。
3 結(jié)果與分析
3.1 廣藿香PcHAD基因的克隆和生物信息學(xué)分析
提取廣藿香葉片總RNA,以反轉(zhuǎn)錄得到的cDNA為模板,以獲得的HAD序列為模板設(shè)計引物,進(jìn)行PCR擴(kuò)增,獲得了長度約為1100 bp的條帶,測序結(jié)果表明其為1149 bp(圖1-A)。利用Uniprot數(shù)據(jù)庫BLAST對比分析,結(jié)果顯示該序列與黃花蒿L(fēng).和紫花風(fēng)鈴木L.含HAD-like結(jié)構(gòu)蛋白的氨基酸序列一致性性分別為80.3%和74.9%。下載一致性較高的氨基酸序列利用DNA MAN進(jìn)行同源對比分析(圖1-C),結(jié)果顯示它們均含有1個HAD-like結(jié)構(gòu)域,故將其命名為
預(yù)測編碼1個包含382 aa的蛋白,相對分子質(zhì)量為43 000,理論等電點(pI)為8.15,不穩(wěn)定指數(shù)為46.09。編碼的氨基酸序列中具有多個明顯的親水區(qū)域,大部分氨基酸屬于親水氨基酸,其合成的蛋白屬于不穩(wěn)定的親水性蛋白(圖1-B)。PcHAD蛋白質(zhì)二級結(jié)構(gòu)由4種形式組成,其中無規(guī)則卷曲(random coil)所占比例最高,為43.19%,α-螺旋(alpha helix)和延伸鏈(exstened strand)分別為39.53%、12.04%,β-轉(zhuǎn)角占5.24%(圖1-D)。以c3iruA為模體對PcHAD蛋白進(jìn)行三維結(jié)構(gòu)模型構(gòu)建(圖1-E),模型覆蓋范圍為132~336 aa,相似性為21%。
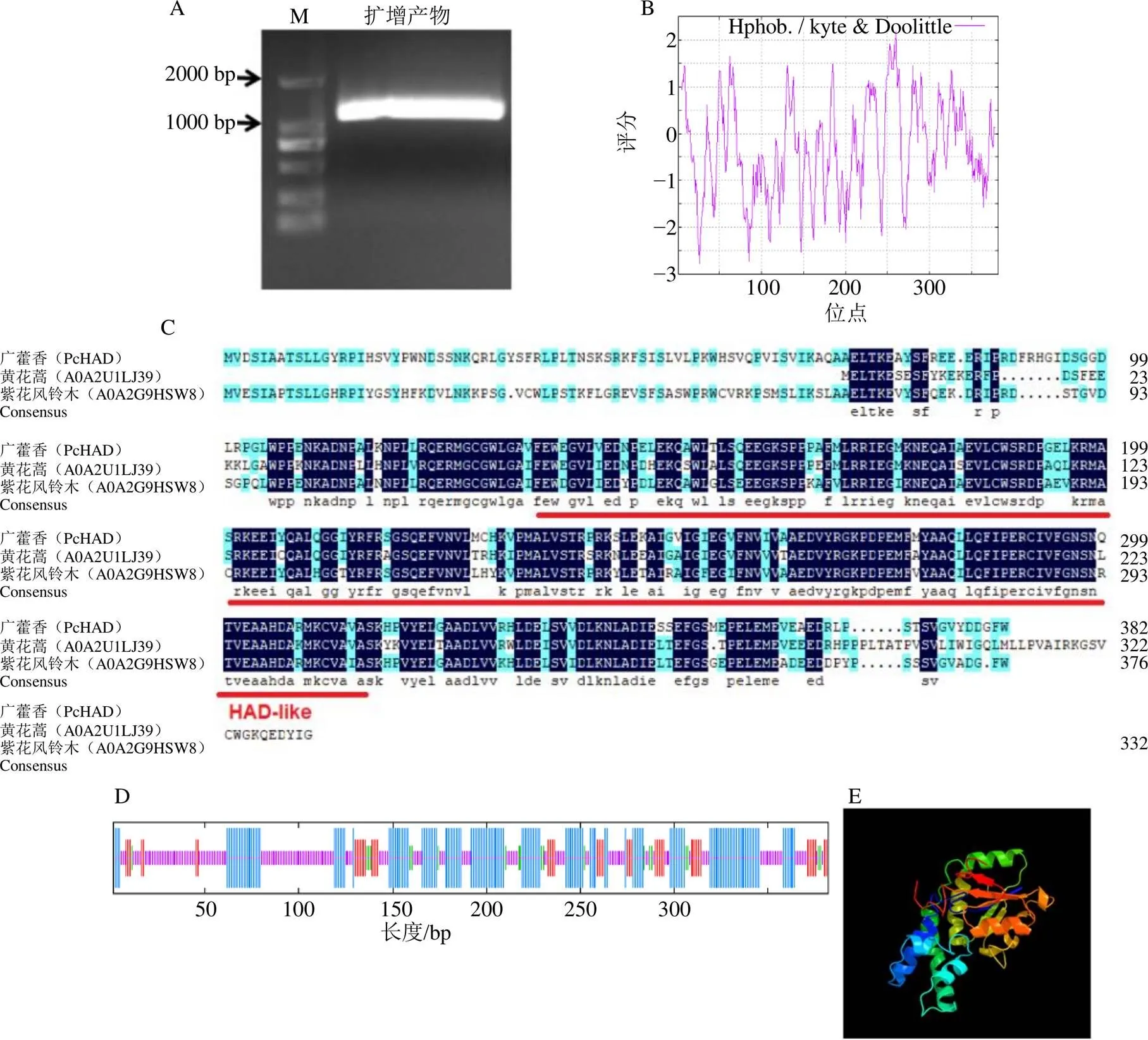
A-PcHAD的PCR擴(kuò)增結(jié)果 B-PcHAD的親疏水性預(yù)測 C-PcHAD與其他植物HAD-like蛋白的多序列比對分析 D-PcHAD的二級結(jié)構(gòu)預(yù)測 E- PcHAD的三維結(jié)構(gòu)預(yù)測
3.2 廣藿香PcHAD的亞細(xì)胞定位分析
將空載pAN580和構(gòu)建好的PcHAD-EGFP融合表達(dá)載體通過PEG介導(dǎo)的方法轉(zhuǎn)化到擬南芥原生質(zhì)體中,通過激光共聚焦顯微鏡觀察到陽性對照(EGFP)在整個細(xì)胞中表達(dá),而PcHAD-EGFP在葉綠體中呈現(xiàn)綠色熒光。以上結(jié)果表明PcHAD蛋白定位在葉綠體中(圖2)。
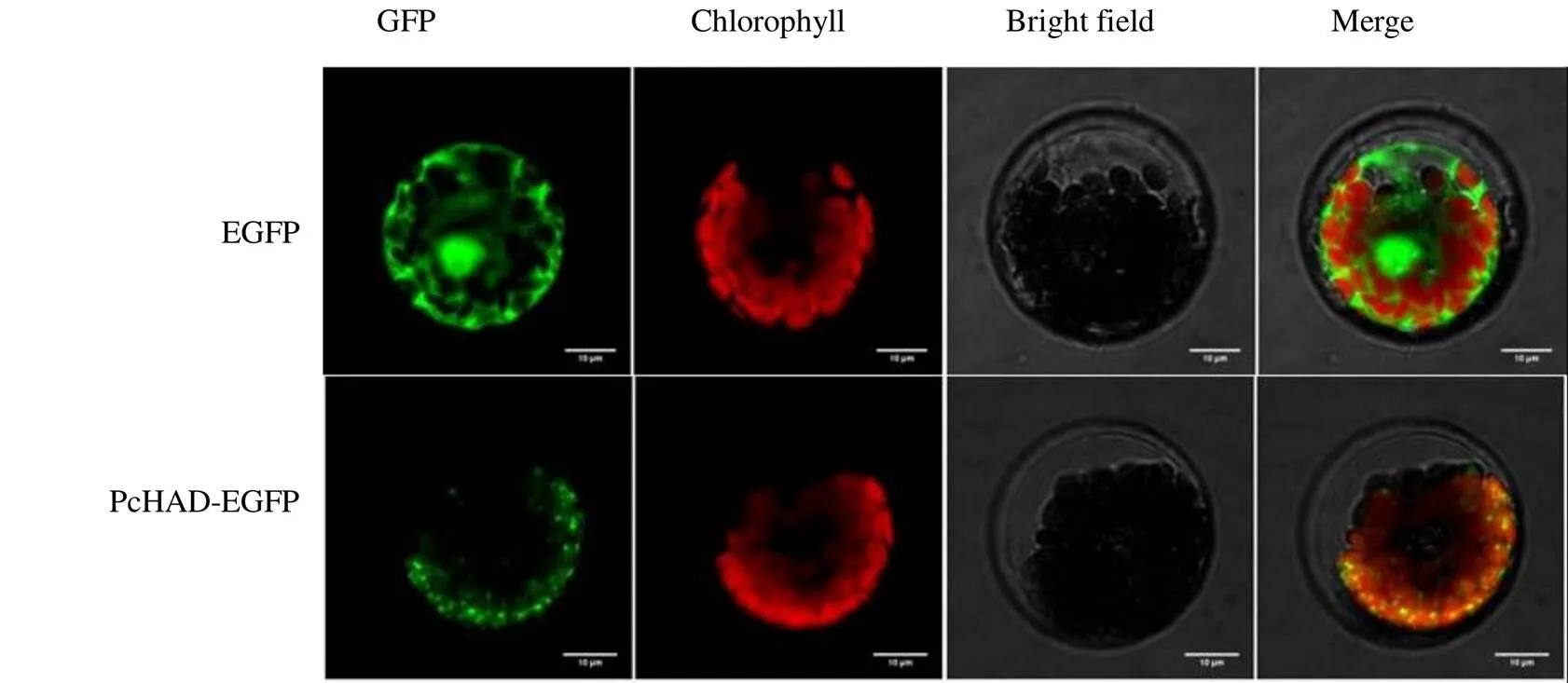
EGFP-pAN580空載 GFP-綠色熒光蛋白 Chlorophyll-葉綠體自發(fā)熒光 Bright field-明場 Merge-葉綠體自發(fā)熒光、綠色熒光蛋白和明場疊加
3.3 PcHAD基因表達(dá)模式分析
利用qRT-PCR技術(shù)分析基因在廣藿香葉、莖、根不同組織的表達(dá)水平。結(jié)果顯示,以根為對照,在葉、莖和根中都有表達(dá),在葉片中的表達(dá)量最高,且顯著高于莖和根,表明該基因具有組織表達(dá)差異性(圖3)。
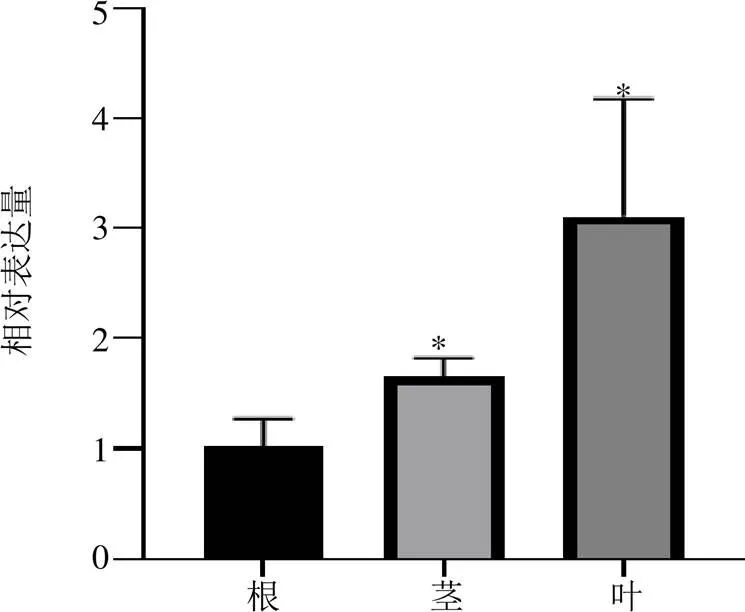
*表示差異在P<0.05水平上顯著
3.4 PcHAD與PcPTS的互作分析
將捕獲質(zhì)粒與BD-PTS共轉(zhuǎn)至Y2HGold感受態(tài)細(xì)胞中,進(jìn)行酵母雙雜點對點驗證。經(jīng)檢測BD-PTS無自激活活性(圖4-C)。陽性對照、pGBKT7-PTS和pGADT7-HAD能在SD/-Leu/-Trp/-His/-Ade/AbA篩選平板上生長且變藍(lán)色,而陰性對照(BD-PTS+ pGADT7)不能正常生長且變藍(lán)色,表明PcHAD完整蛋白能與PcPTS完整蛋白結(jié)合(圖4-D)。
通過Pfam網(wǎng)站預(yù)測結(jié)構(gòu)域,發(fā)現(xiàn)PcHAD的HAD2_like結(jié)構(gòu)域分布在134~314個氨基酸,PcPTS的Terpene_synth結(jié)構(gòu)域為25~197個氨基酸,Terpene_synth_C為229~495個氨基酸。為進(jìn)一步分析PcHAD與PcPTS的互作域,將PcHAD和PcPTS根據(jù)結(jié)構(gòu)域進(jìn)行截短(圖4-D),PcHAD截短為PcHADN(1~133 aa)和PcHADC(134~382 aa,該段被預(yù)測包含HAD2-like結(jié)構(gòu)域)。PcPTS截短為PcPTSN(25~225 aa)和PcPTSC(226~550 aa)2個片段,然后將PcHAD的截短蛋白分別和pGADT7連接PcPTS的截短蛋白分別和pGBKT7連接,利用酵母雙雜點對點驗證PcHAD截短蛋白和PcPTS截短蛋白的互作。結(jié)果表明,PcHADN與PcPTSN互作,而PcHADC與PcPTSN不互作(圖4-D)
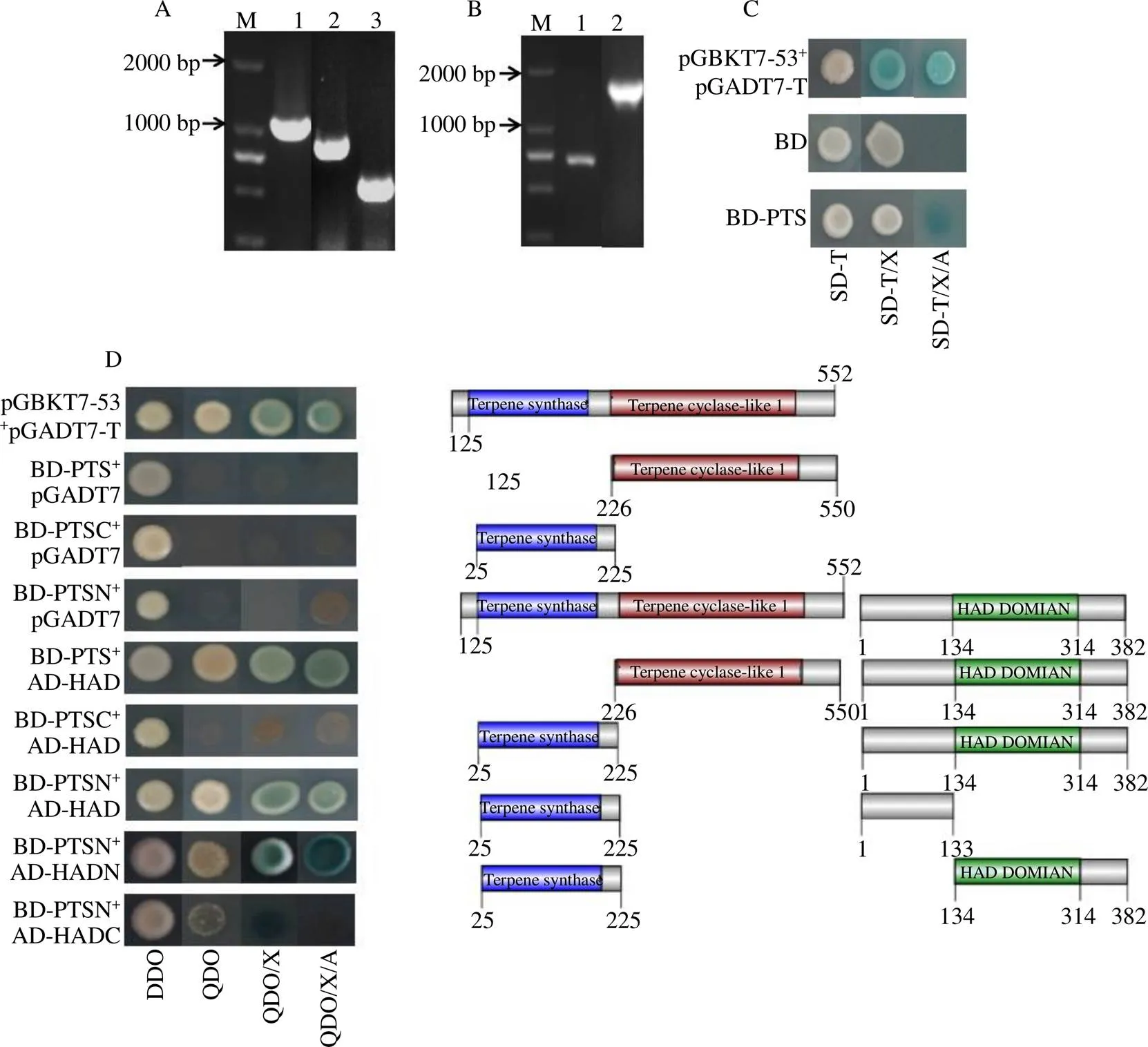
M-Marker A: 1-AD-HAD 2-AD-HADN 3-AD-HADC的菌落PCR電泳檢測 B: 1-BK-PTSN 2-BK-PTS的菌落PCR C-誘餌載體的自激活檢測 D-酵母雙雜交結(jié)果
3.5 PcHAD瞬時過表達(dá)后對廣藿香醇的合成及MVA途徑相關(guān)基因表達(dá)影響分析
提取瞬時侵染后的廣藿香葉片總RNA,反轉(zhuǎn)錄成cDNA,利用qRT-PCR分析基因的表達(dá)情況。結(jié)果表明,瞬時過表達(dá)的葉片,與CK組相比,的表達(dá)量增加約2倍,說明成功獲得了瞬時過表達(dá)的廣藿香株系(圖5-C)。GC-MS結(jié)果顯示廣藿香醇的對照品保留時間為17.25 min,廣藿香醇含量統(tǒng)計結(jié)果表明,過表達(dá)廣藿香葉片的廣藿香醇含量為1.580 mg/g,顯著高于對照(1.212 mg/g),提高了30.3 %(圖5-A、B)。
為了進(jìn)一步揭示基因的功能,本研究選取了廣藿香醇主要的生物合成途徑即MVA途徑中的9個基因,對其在瞬時過表達(dá)基因的廣藿香葉片的表達(dá)進(jìn)行了分析。結(jié)果如圖5-C所示,發(fā)現(xiàn)及MVA途徑的2個關(guān)鍵基因表達(dá)量均顯著上調(diào)。
通過截短蛋白的酵母雙雜交實驗明確了其互作域,PcHADN與PcPTSN互作,因此,PcHAD與PcPTS蛋白的相互作用應(yīng)該是由PcHAD的N端截短蛋白或是PcPTS的N端截短蛋白決定的。但PcHADN無相關(guān)結(jié)構(gòu)域,推測Terpene_synth這個元件可能在PcHAD與PcPTS的結(jié)合中發(fā)揮重要作用,但是具體的作用機(jī)制還不清楚,需要進(jìn)一步研究。
為了明確HAD蛋白調(diào)控廣藿香醇合成的功能,構(gòu)建了pJL-HAD的過表達(dá)載體進(jìn)行瞬時過表達(dá)實驗,發(fā)現(xiàn)過表達(dá)后廣藿香醇的含量顯著上升。另外,RT-qPCR結(jié)果表明在瞬時過表達(dá)葉片中廣藿香醇合酶基因及MVA途徑的和基因的表達(dá)均顯著上調(diào)。據(jù)報道,類異戊二烯核心通路中的基因一旦過表達(dá)或受到抑制,將改變代謝通量,促進(jìn)通路中的反饋或前饋信號,從而調(diào)節(jié)基因的上、下游表達(dá)[26]。課題組前期過表達(dá)MYB_related轉(zhuǎn)錄因子,該基因通過上調(diào)MVA通路中的基因表達(dá),促進(jìn)了廣藿香醇的生物合成和積累[12]。因此,基因可能通過上調(diào)及MVA途徑的和基因的表達(dá)促進(jìn)廣藿香醇的合成和積累。本研究成功克隆了,進(jìn)一步驗證了其編碼蛋白與PcPTS蛋白的互作關(guān)系,并對其功能進(jìn)行了初步分析,探究了過表達(dá)后對廣藿香醇合成途徑基因和廣藿香醇含量的影響,為進(jìn)一步揭示PcPTS及其互作蛋白在廣藿香萜類生物合成調(diào)控中的作用奠定基礎(chǔ)。后續(xù)將通過轉(zhuǎn)基因等實驗進(jìn)一步揭示PcHAD的功能,深入了解其調(diào)節(jié)廣藿香醇生物合成的分子機(jī)制。
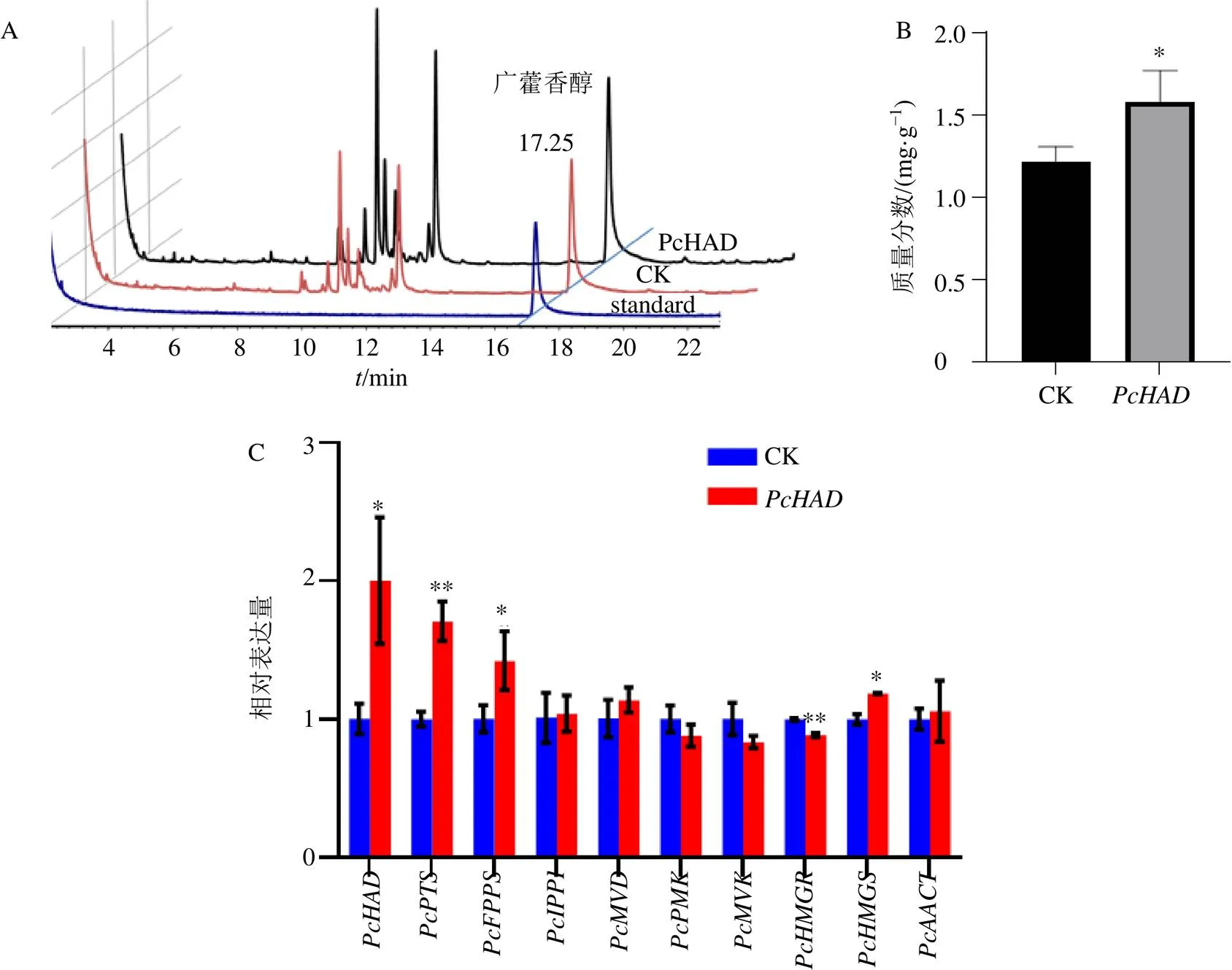
A-GC-MS色譜圖 B-廣藿香醇含量分析柱狀圖 C-及廣藿香醇合成途徑相關(guān)基因表達(dá)情況 CK-空載對照以18 S為內(nèi)參,以空載樣品為對照,采用2-△△Ct法進(jìn)行相對定量計算。每組試驗設(shè)3個生物學(xué)重復(fù),Student’s t-test,與CK組比較:*<0.05、**<0.01
A-GC-MS chromatogram B-content of patchouli alcohol in leaf of transient overexpression plant C-expression levels ofand genes involved in cytosolic mevalonate (MVA) pathway in leaves of transient overexpression plant CK-control check. The relative expression level was calculated according to the expression of PcHAD at CK sample. 2-△△Ctmethod was used for relative quantitative calculation. Data are means ± SD of three independent biological replicates.Student’s-test:*< 0.05,**< 0.01 va CK group
圖5瞬時轉(zhuǎn)化廣藿香葉片廣藿香醇含量檢測及RT-qPCR鑒定廣藿香醇合成途徑相關(guān)基因表達(dá)情況
Fig. 5 Detection of patchouli alcohol content and expression profiles ofand genes involved in cytosolic mevalonate (MVA) pathway in leaves of transient overpression plant
利益沖突 所有作者均聲明不存在利益沖突
[1] 中國藥典[S]. 一部. 2020: 46.
[2] 曾慶錢, 蔡岳文, 嚴(yán)振, 等. 廣藿香精油的殺蟲作用及其活性成分分析 [J]. 植物資源與環(huán)境學(xué)報, 2006, 15(3): 21-25.
[3] 王玥, 郭苗苗, 施雁勤, 等. 廣藿香精油抗炎祛痘功效研究 [J]. 日用化學(xué)工業(yè), 2017, 47(5): 272-276.
[4] Deguerry F, Pastore L, Wu S Q,. The diverse sesquiterpene profile of patchouli,, is correlated with a limited number of sesquiterpene synthases [J]., 2006, 454(2): 123-136.
[5] Swamy M K, Sinniah U R. Patchouli (Benth.): Botany, agrotechnology and biotechnological aspects [J]., 2016, 87: 161-176.
[6] van Beek T A, Joulain D. The essential oil of patchouli,: A review [J]., 2018, 33(1): 6-51.
[7] Newman J D, Chappell J. Isoprenoid biosynthesis in plants: Carbon partitioning within the cytoplasmic pathway [J]., 1999, 34(2): 95-106.
[8] Yang L, Yang C Q, Li C Y,. Recent advances in biosynthesis of bioactive compounds in traditional Chinese medicinal plants [J].(), 2016, 61: 3-17.
[9] Deguerry F, Pastore L, Wu S Q,. The diverse sesquiterpene profile of patchouli,, is correlated with a limited number of sesquiterpene synthases [J]., 2006, 454(2): 123-136.
[10] 劉璐, 吳友根, 于靖, 等. 廣藿香中PTS基因不同時間點的表達(dá)分析 [J]. 熱帶生物學(xué)報, 2016, 7(1): 89-91.
[11] Frister T, Hartwig S, Alemdar S,. Characterisation of a recombinant patchoulol synthase variant for biocatalytic production of terpenes [J]., 2015, 176(8): 2185-2201.
[12] 陳秀珍. 廣藿香醇生物合成途徑中轉(zhuǎn)錄因子對PatPTS的調(diào)控機(jī)制研究 [D]. 廣州: 廣州中醫(yī)藥大學(xué), 2020.
[13] 黃偉展, 胡貞貞, 盧昌華, 等. 廣藿香PTS基因的克隆及CPEC法構(gòu)建其過表達(dá)載體pRI101-PTS [J]. 廣東藥科大學(xué)學(xué)報, 2019, 35(2): 186-192.
[14] 徐重益. 植物中驗證蛋白相互作用的Pull-down和Co-IP技術(shù) [J]. 植物學(xué)報, 2020, 55(1): 62-68.
[15] Jiang W H, Liu T X, Nan W Z,. Two transcription factors TaPpm1 and TaPpb1 co-regulate anthocyanin biosynthesis in purple pericarps of wheat [J]., 2018, 69(10): 2555-2567.
[16] 訾亮, 洪灝, 翟金玲, 等. 擬南芥NiNJA基因酵母雙雜誘餌載體構(gòu)建及互作蛋白的篩選 [J]. 熱帶生物學(xué)報, 2013, 4(1): 31-35.
[17] 孔蘭, 王鋒, 蔡正正, 等. 酵母雙雜交篩選水稻OsJAG互作蛋白 [J]. 基因組學(xué)與應(yīng)用生物學(xué), 2019, 38(10): 4572-4579.
[18] 劉麗. 小麥兩個蛋白激酶MAPK1、W55a基因的表達(dá)特性及功能鑒定 [D]. 楊凌: 西北農(nóng)林科技大學(xué), 2008.
[19] 何潔. 番茄SlMPK1的互作蛋白篩選及初步功能分析 [D]. 揚州: 揚州大學(xué), 2016.
[20] 王亞楠. 水稻OsVDAC3及其互作蛋白亞細(xì)胞定位和功能初步分析 [D]. 武漢: 中南民族大學(xué), 2019.
[21] Yoo S D, Cho Y H, Sheen J.mesophyll protoplasts: A versatile cell system for transient gene expression analysis [J]., 2007, 2(7): 1565-1572.
[22] Chen X Z, Li J R, Wang X B,. Full-length transcriptome sequencing and methyl jasmonate-induced expression profile analysis of genes related to patchoulol biosynthesis and regulation in[J]., 2019, 19(1): 266.
[23] Burroughs A M, Allen K N, Dunaway-Mariano D,. Evolutionary genomics of the HAD superfamily: Understanding the structural adaptations and catalytic diversity in a superfamily of phosphoesterases and allied enzymes [J]., 2006, 361(5): 1003-1034.
[24] Chin T, Okuda Y, Ikeuchi M. Improved sorbitol production and growth in cyanobacteria using promiscuous haloacid dehalogenase-like hydrolase [J]., 2019, 306S: 100002.
[25] Burroughs A M, Allen K N, Dunaway-Mariano D,. Evolutionary genomics of the HAD superfamily: Understanding the structural adaptations and catalytic diversity in a superfamily of phosphoesterases and allied enzymes [J]., 2006, 361(5): 1003-1034.
[26] THOLL D.[M]. Cham: Springer International Publishing, 2015: 63-106.
Cloning ofgene fromand functional analysis of its involvement in biosynthesis of patchouli alcohol
WU Dai-di1, 2, HUANG Hui-ling1, 2, SHAN Yao-kai1, 2, ZOU Xuan1, 2, GONG Li-zhen1, 2, ZHAN Ruo-ting1, 2, 3, CHEN Li-kai1, 2, 3
1. School of Chinese Materia Medica, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 2. Key Laboratory of Chinese Medicinal Resource from Lingnan, Ministry of Education, Guangzhou University of Chinese Medicine, Guangzhou 510006, China 3. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agricultural Science and Technology, Maoming 525000, China
gene of HAD (haloacid dehalogenase) superfamily protease was cloned from Guanghuoxiang (), and its coding protein interaction with patchoulol synthase (PTS) protein was verified to explore its role in regulating the biosynthesis of patchouli alcohol.In this study, agene sequence () with complete coding region and HAD-like domain was screened fromtranscriptome data for cloning and bioinformatics analysis. The tissue expression pattern ofwas analyzed by RT-qPCR. The yeast two-hybrid experiment was used to verify the interaction between PcHAD and PcPTS protein. Transient overexpression ofwas used to analyze the effect ofon the expression of genes related to the MVA pathway and the content of patchouli alcohol.The HAD-like genewas cloned from. Its open reading frame was 1149 bp, encoding 382 amino acids, and the molecular weight of the protein was 43 000. It was an unstable hydrophilic protein and subcellularly localized in the chloroplast. In the yeast two-hybrid assay, the PcHAD protein can not only interact with the PcPTS protein, but also with PcPTSN. After transient overexpression of, the content of patchouli alcohol was increased by 30% compared with the control group, and the expression of genes on the MVA pathway including,andwere significantly up-regulated.In this study,gene that interacts with patchoulol synthase PcPTS was cloned from. Transient overexpression ofcan increased the content of patchouli alcohol and the expression levels ofand genes involved in the MVA pathway, suggesting that this gene may play a positive role in the biosynthesis of patchouli alcohol. These results provided scientific basis for further research on the function of HAD-PTS complex in
(Blanco) Benth.; patchouli alcohol; HAD; protein-protein interactions; synthesis regulation; function analysis
R286.12
A
0253 - 2670(2022)13 - 4100 - 09
10.7501/j.issn.0253-2670.2022.13.023
2021-11-03
國家自然科學(xué)基金資助項目(81803657);廣東省自然科學(xué)基金資助項目(2019A1515011542);廣東省重點領(lǐng)域研發(fā)計劃(2020B020221001)
吳帶娣(1995—),女,碩士研究生,研究方向為藥用植物萜類活性成分遺傳調(diào)控。E-mail: 1753931835@qq.com
陳立凱(1986—),男,博士,副研究員,博導(dǎo),主要從事中藥資源利用與藥效成分的遺傳調(diào)控。E-mail: chenlk@gzucm.edu.cn
[責(zé)任編輯 時圣明]

