清肺口服液黃酮類成分對呼吸道合胞病毒感染小鼠壞死性凋亡的影響
凌曉穎,丁雅荔,陶嘉磊,袁 斌
清肺口服液黃酮類成分對呼吸道合胞病毒感染小鼠壞死性凋亡的影響
凌曉穎,丁雅荔,陶嘉磊,袁 斌*
南京中醫藥大學附屬醫院,江蘇 南京 210029
研究清肺口服液黃酮類成分對呼吸道合胞病毒(respiratory syncytial virus,RSV)感染小鼠壞死性凋亡的影響。將BALB/c小鼠隨機分為對照組、模型組及黃酮類成分低、高劑量(30、60 mg/kg)組和利巴韋林(46 mg/kg)組,建立RSV感染的小鼠模型,給藥4 d后,蘇木素-伊紅(HE)染色法觀察肺組織病理學變化;qRT-PCR檢測肺組織中白細胞介素-6(interleukin-6,)、腫瘤壞死因子-α(tumor necrosis factor-α,)和mRNA表達;流式細胞術檢測肺組織細胞壞死性凋亡率;ELISA法檢測小鼠肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中乳酸脫氫酶(lactate dehydrogenase,LDH)和高遷移率族蛋白B1(high mobility group protein B1,HMGB1)水平;Western blotting檢測肺組織受體相互作用蛋白激酶1(receptor-interacting protein 1,RIP1)、RIP3、混合系列蛋白激酶樣結構域(mixed lineage kinase domain-like,MLKL)、磷酸甘油酸變位酶5(phosphoglycerate mutase 5,PGAM5)、動力相關蛋白1(dynamin-related protein 1,DRP1)蛋白表達;免疫熒光檢測肺組織RIP1和RIP3的共定位以及p-MLKL與上皮細胞的共定位。與模型組相比,黃酮類成分組小鼠肺組織病理損傷減輕;肺組織中、和mRNA表達水平降低(<0.05、0.01);肺組織細胞壞死性凋亡率下降(<0.05、0.01);BALF中HMGB1和LDH水平降低(<0.05、0.01);肺組織RIP1、RIP3、MLKL、PGAM5、DRP1蛋白表達水平均顯著降低(<0.05、0.01);肺組織RIP1/RIP3壞死復合物的形成減少,肺上皮細胞中p-MLKL的熒光表達降低。清肺口服液黃酮類成分可能通過調節RIP1/RIP3/ MLKL/PGAM5/DRP1信號通路,抑制壞死性凋亡,改善RSV感染的小鼠肺部炎癥損傷。
清肺口服液;黃酮類成分;呼吸道合胞病毒;壞死性凋亡;受體相互作用蛋白激酶1;受體相互作用蛋白激酶3;混合系列蛋白激酶樣結構域;磷酸甘油酸變位酶5;線粒體動力相關蛋白1
呼吸道合胞病毒(respiratory syncytial virus,RSV)是全球嬰幼兒、老年人和免疫功能低下人群病毒性肺炎最常見的病原體之一。據估計,RSV感染每年導致超過300萬人住院和近6萬人死亡,主要發生在發展中國家[1]。嬰幼兒早期RSV感染還與隨后發生反復喘息及哮喘的風險密切相關[2]。目前RSV感染的防治方式有限,尚無安全有效的抗病毒藥物及批準用于臨床的疫苗[3]。
細胞凋亡并不能引起或加重炎癥反應,而壞死則會釋放過多的細胞因子和趨化因子,進一步放大炎癥風暴和肺損傷。壞死性凋亡是近年來發現的一種不依賴于半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)活化的新型細胞程序性壞死,它具有典型的壞死樣形態:細胞體積增大,細胞器腫脹,細胞膜穿孔,之后為細胞崩解,內容物釋放,導致大量的炎癥細胞浸潤和激活[4]。越來越多研究表明,壞死性凋亡在RSV的發病機制中扮演著重要的角色,抑制壞死性凋亡不僅能降低RSV感染小鼠肺部病毒載量,還能減輕肺部炎癥[5]。因此,靶向壞死性凋亡可能是防治RSV感染的新方向。
RSV肺炎可歸屬于中醫兒科學“肺炎喘嗽”的范疇,急性期以痰熱閉肺證最為多見[6]。全國名中醫汪受傳教授結合其證候特點,在經方麻杏石甘湯基礎上,加宣肺止咳之前胡,肅肺平喘之桑白皮,瀉肺滌痰之葶藶子,解毒活血之虎杖等,組方制成以開肺化痰、解毒活血為主要功效的清肺口服液[7]。清肺口服液臨床運用多年,隨機對照試驗證實其治療RSV肺炎安全有效[8]。本課題組前期研究發現,黃酮類成分是清肺口服液的主要藥效物質,能夠顯著抑制RSV復制,減輕肺組織的病理損傷[9],但對壞死性凋亡的調控作用還尚未可知。因此本研究建立RSV感染小鼠模型,探究清肺口服液黃酮類成分抑制壞死性凋亡的作用機制,也為清肺口服液的推廣應用提供理論依據。
1 材料
1.1 病毒
RSV A2型long株,購自中國典型培養物保藏中心,RSV在Hep-2細胞上擴增,收集病毒備用。
1.2 動物
SPF級雌性BALB/c小鼠,6~8周齡,體質量18~20 g,購自SIPEIFU生物科技有限公司,合格證號SCXK(京)2019-0010。動物于室溫(23±2)℃,相對濕度40%~70%,晝夜交替照明的環境中飼養,自由進食飲水。動物實驗經南京中醫藥大學實驗動物倫理委員會批準(批準號201805A019)。
1.3 藥品與試劑
清肺口服液按原比例配制:炙麻黃4 g,生石膏24 g,杏仁10 g,桑白皮10 g,葶藶子6 g,紫花前胡10 g,虎杖12 g,拳參12 g,制僵蠶6 g,丹參6 g,以上藥材由江蘇省中醫院提供,經南京中醫藥大學中藥鑒定教研室劉圣金副教授鑒定均符合《中國藥典》2020年版規定。取藥材5 kg粉碎,加12倍量85%乙醇回流提取3次,每次1.5 h,濾過,濾液合并,減壓濃縮、冷凍干燥,獲得凍干粉600 g,經聚酰胺樹脂純化后,減壓濃縮、冷凍干燥獲得黃酮類成分凍干粉,轉移率為78.7%,并采用UPLC-MS/MS技術,定量檢測出兒茶素、木犀草素等26種黃酮類化合物[10]。
利巴韋林購自源葉生物有限公司;蘇木素-伊紅(HE)染料購自美國Sigma公司;RIPA裂解液、蛋白酶和磷酸酶抑制劑混合液、Tris-Glycine SDS電泳緩沖液、快速轉膜液購自蘇州新賽美公司;SDS-PAGE凝膠配制試劑盒購自上海碧云天公司;ChamQ Universal SYBR qPCR Master Mix、HiScript Ⅲ RT SuperMix for qPCR、細胞/組織RNA提取試劑盒、Annexin V-FITC/碘化丙啶(PI)試劑盒購自南京諾唯贊公司;乳酸脫氫酶(lactate dehydrogenase,LDH)ELISA試劑盒、高遷移率族蛋白B1(high mobility group protein B1,HMGB1)ELISA試劑盒購自南京謹庭公司;受體相互作用蛋白1(receptor-interacting protein 1,RIP1)抗體購自美國CST公司;RIP3、磷酸甘油酸變位酶5(phosphoglycerate mutase 5,PGAM5)抗體購自Abmart公司;混合系列蛋白激酶樣結構域(mixed lineage kinase domain-like,MLKL)抗體、動力相關蛋白1(dynamin-related protein 1,DRP1)抗體、鈣黏蛋白E(E-cadherin)抗體購自Proteintech公司;p-MLKL抗體購自英國Abcam公司;甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體、HRP標記的羊抗兔IgG抗體、HRP標記的羊抗鼠IgG抗體購自Affinity公司。
1.4 儀器
蛋白核酸分析儀(德國Eppendorf公司);Quant Studio 7 Flex PCR System(Life technologies公司);化學發光成像儀(Bio-Rad公司);流式細胞儀(BD公司);酶標儀(Tecan公司);光學顯微鏡、熒光顯微鏡(Carl Zeiss公司)。
2 方法
2.1 模型的建立和給藥
將小鼠隨機分為對照組、模型組及黃酮類成分低、高劑量(30、60 mg/kg/d)組和利巴韋林(46 mg/kg)組,每組6只。小鼠適應性飼養1周后,按照本課題組前期已建立的造模方法[10],除對照組外,其余小鼠于實驗第0天,在異氟烷麻醉狀態下予滴度為1×107PFU/mL的RSV病毒液80 μL滴鼻。小鼠感染后,各給藥組ig溶于0.5%羧甲基纖維素鈉(CMC-Na)的相應藥物,對照組和模型組ig 0.5% CMC-Na,1次/d,連續4 d。末次給藥后禁食不禁水,次日處死小鼠,取樣備用。
2.2 肺組織HE染色
取各組小鼠肺組織,于4%多聚甲醛中固定24 h,石蠟包埋、切片、脫蠟,進行HE染色,于光學顯微鏡下觀察肺組織炎癥情況。
2.3 qRT-PCR檢測肺組織白細胞介素-6(interleukin-6,IL-6)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和RSV-F mRNA表達
取各組小鼠肺組織,按照RNA提取試劑盒說明書提取RNA。使用蛋白核酸分析儀測定RNA濃度,根據HiScript III RT SuperMix for qPCR的說明,依次進行基因組DNA去除、配制逆轉錄反應體系,加熱得到cDNA。按照ChamQ Universal SYBR qPCR Master Mix說明配制體系,加樣上機,使用QuantStudio 7 Flex系統進行擴增,數據采用2?ΔΔCt法進行計算分析,以β-actin為內參進行標準化,相關基因的引物序列見表1。
2.4 流式細胞儀檢測肺組織壞死性凋亡情況
取各組小鼠肺組織,制備肺組織單細胞懸液,使用Annexin V-FITC/PI試劑盒檢測細胞死亡形式,右上象限Annexin V(+)和PI(+)雙陽性被定義為壞死性凋亡。
表1 引物序列
Table 1 Primer sequences
基因引物序列 (5’-3’) β-actinF: GTATCCTGACCCTGAAGTACC R: TGAAGGTCTCAAACATGATCT IL-6F: CTCCCAACAGACCTGTCTATAC R: CCATTGCACAACTCTTTTCTCA TNF-αF: ATGTCTCAGCCTCTTCTCATTC R: GCTTGTCACTCGAATTTTGAGA RSV-FF: TGAAAGTCCACCTCCTTACAGA R: CCGGATAAAAAGAGTACGCTGG
2.5 ELISA檢測肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中LDH和HMGB1水平
取各組小鼠BALF,按照ELISA試劑盒說明書測定LDH和HMGB1水平。
2.6 Western blotting檢測肺組織RIP1、RIP3、MLKL、PGAM5和DRP1蛋白表達
取各組小鼠肺組織20 mg,加入200 μL RIPA裂解液和20 μL蛋白酶和磷酸酶抑制劑混合液混勻,研磨組織勻漿,提取肺組織的總蛋白,使用BCA蛋白定量試劑盒測定蛋白濃度,等量蛋白加樣,依次進行電泳、轉膜、封閉。分別加入RIP1抗體(1∶1000)、RIP3抗體(1∶1000)、MLKL抗體(1∶1000)、PGAM5抗體(1∶1000)、DRP1抗體(1∶1000)和GAPDH抗體(1∶3000),4 ℃孵育過夜;洗滌后,加入相應二抗室溫孵育1 h,使用ECL發光液對目的條帶進行成像與分析。
2.7 免疫熒光檢測肺組織RIP1、RIP3、p-MLKL和E-cadherin蛋白表達
取各組小鼠肺組織石蠟切片,依次脫蠟、抗原修復、封閉;分別加入RIP1抗體(1∶200)、RIP3抗體(1∶200)、p-MLKL抗體(1∶200)和E-cadherin抗體(1∶200),4 ℃孵育過夜;PBS清洗后,滴加熒光標記的二抗,室溫避光孵育1 h,PBS清洗后,DAPI染核;用抗熒光淬滅劑封片,于熒光顯微鏡下觀察并拍照。
2.8 統計分析
采用Graphpad Prism 8軟件進行統計分析和作圖,結果以表示,組間比較采用單因素方差分析(One-Way ANOVA)和Tukey檢驗。
3 結果
3.1 小鼠一般情況和體質量變化
對照組小鼠精神、毛發和活動程度等無明顯異常變化。RSV感染小鼠出現飲水進食減少、蜷縮少動、擻毛等現象,而給藥組小鼠的精神狀態、毛發和食量均逐漸恢復,其中以黃酮類成分高劑量組恢復最好。RSV造模后每天監測小鼠體質量,如圖1所示,除對照組外,其余各組小鼠的體質量均明顯降低,提示模型制備成功。小鼠在造模后第1天體質量最低(<0.01),給藥后略有促進體質量恢復趨勢,但無統計學意義。
3.2 清肺口服液黃酮類成分對RSV感染的小鼠肺部炎癥和病毒復制的影響
HE染色用于評估清肺口服液黃酮類成分對RSV感染小鼠肺組織病理的影響,如圖2-A所示,與對照組相比,RSV感染的小鼠肺組織充血、水腫,可見明顯的炎癥細胞浸潤;而黃酮類成分及利巴韋林均能明顯改善上述病理特征,且黃酮類成分高劑量組療效優于利巴韋林。
IL-6和TNF-α是重要的促炎介質,能促進RSV誘導的肺部炎癥進展[11]。因此使用qRT-PCR檢測了肺組織中上述炎癥因子的表達水平,如圖2-B、C所示,模型組肺組織和mRNA表達水平較對照組顯著升高(<0.01),而不同劑量的黃酮類成分均能有效降低上述炎癥因子mRNA表達水平(<0.05、0.01),提示黃酮類成分有較好的抗炎作用。RSV感染后,小鼠肺組織中可以檢測到特異性核酸,與模型組相比,不同劑量的黃酮類成分均可抑制的mRNA表達水平(圖2-D,<0.05、0.01)。以上結果表明,清肺口服液黃酮類成分能夠改善RSV感染小鼠肺組織病理損傷,減輕肺部炎癥,抑制病毒復制。
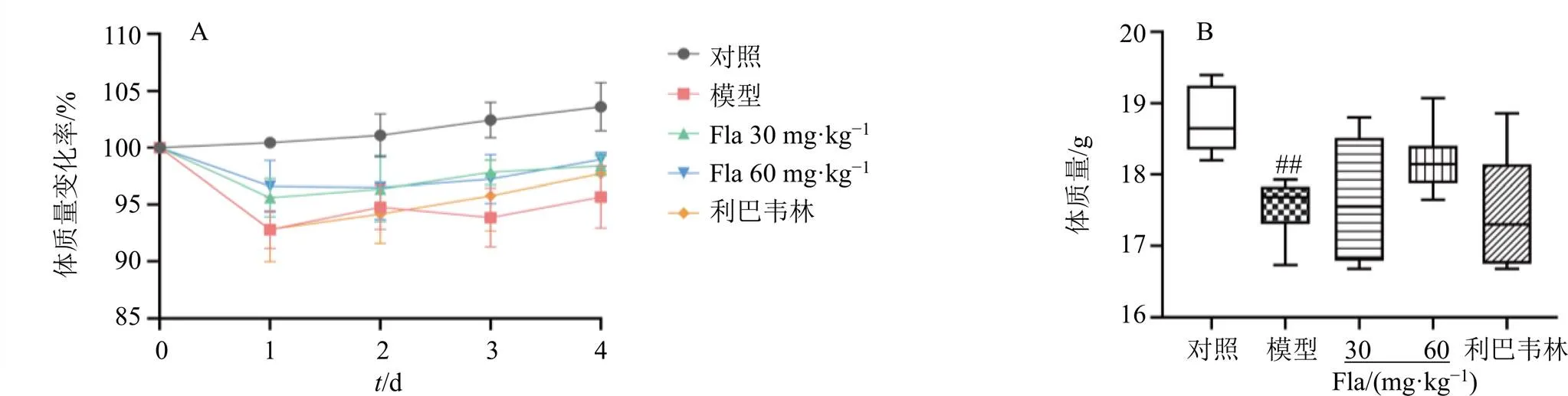
A-小鼠體質量連續變化 B-第1天各組小鼠體質量 Fla-黃酮類成分 與對照組比較:##P<0.01
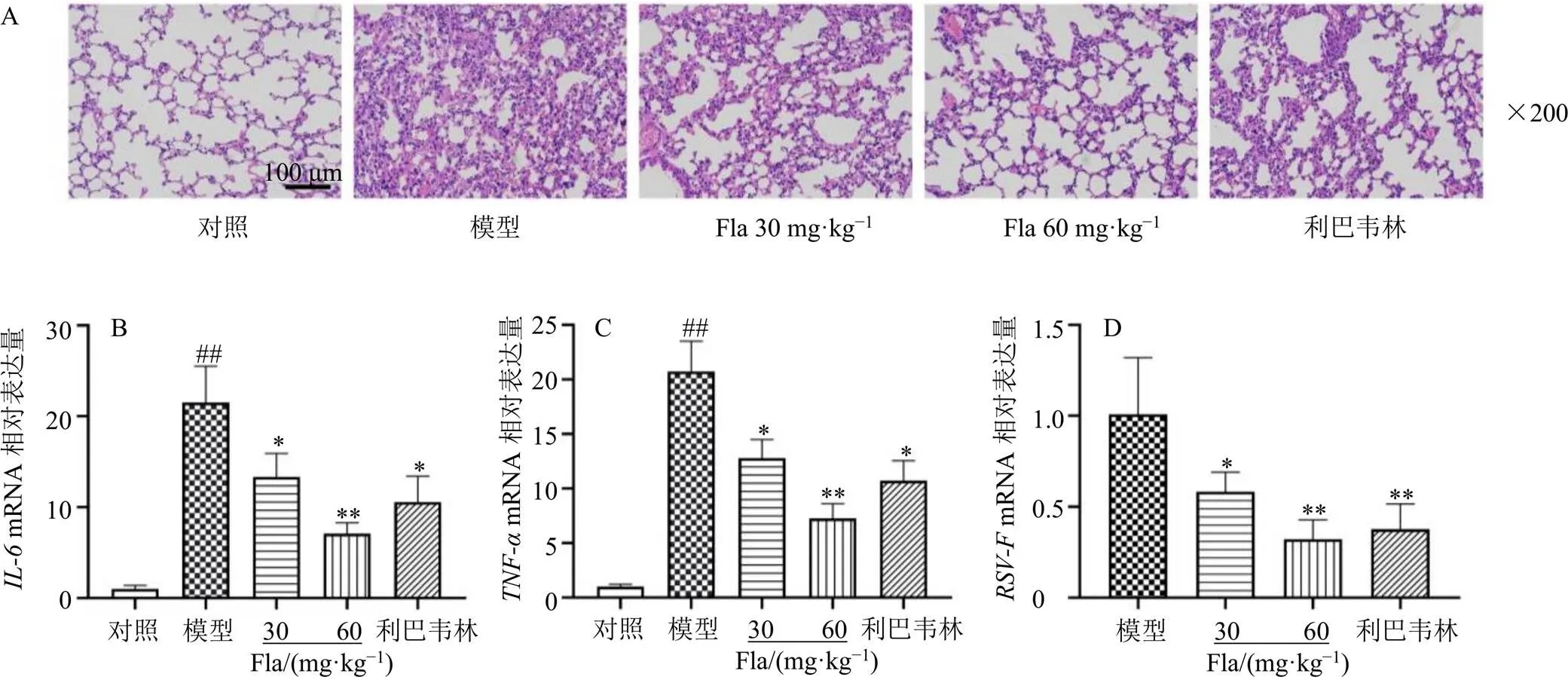
與對照組比較:##P<0.01;與模型組比較:*P<0.05 **P<0.01,下圖同
3.3 清肺口服液黃酮類成分對RSV感染的小鼠肺組織壞死性凋亡的影響
壞死性凋亡是RSV感染中常見的細胞死亡方式之一。使用Annexin V/PI染料標記肺組織單細胞混懸液,如圖3-A、B所示,RSV可以顯著增加Annexin V和PI雙陽性率(<0.01),提示RSV感染增加了肺組織細胞的壞死性凋亡,而黃酮類成分可以降低RSV感染后的壞死性凋亡(<0.05、0.01)。
不同于凋亡,壞死性凋亡通常伴隨著嚴重的炎癥反應、HMGB1的釋放以及細胞膜的破壞[12]。如圖3-C所示,RSV誘導HMGB1大量釋放到BALF中(<0.01),而黃酮類成分抑制了這一過程(<0.05、0.01)。LDH可用于檢測細胞質膜的破壞,如圖3-D所示,黃酮類成分顯著降低RSV感染的小鼠BALF中LDH水平(<0.01)。
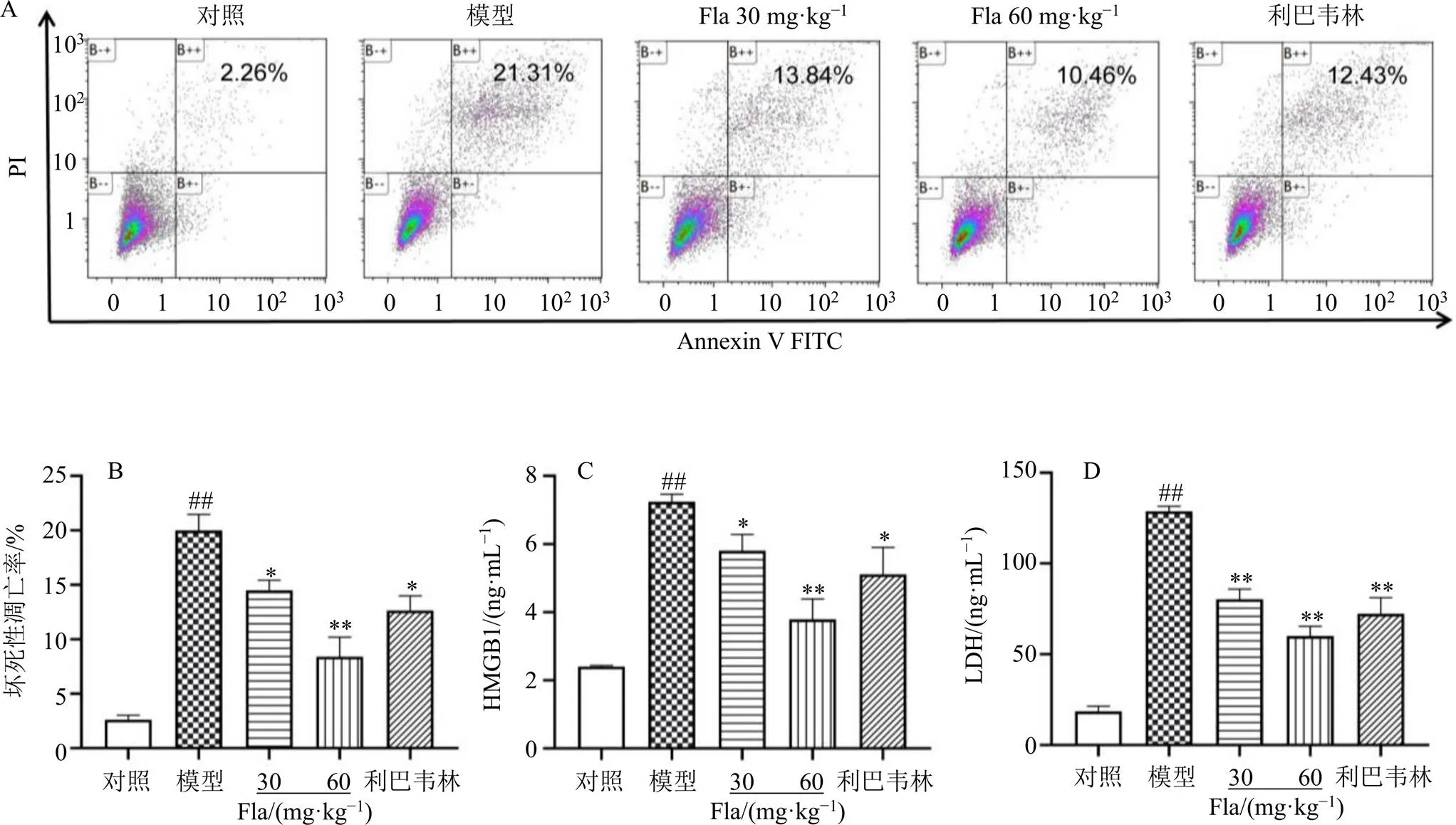
圖3 清肺口服液黃酮類成分對RSV感染的小鼠肺組織細胞壞死性凋亡率 (A、B) 及BALF中HMGB1 (C)、LDH (D) 水平的影響(, n = 6)
3.4 清肺口服液黃酮類成分對RSV感染的小鼠肺組織RIP1/RIP3/MLKL通路蛋白表達的影響
盡管壞死性凋亡的分子機制尚未完全闡釋清楚,但RIP1/RIP3/MLKL已被證實是壞死性凋亡信號通路中的關鍵靶點[13]。為進一步闡述清肺口服黃酮類成分抑制壞死性凋亡的具體機制,對上述蛋白進行檢測。Western blotting結果(圖4)顯示,與對照組相比,RSV感染后肺組織中RIP1、RIP3、MLKL蛋白表達水平均顯著升高(<0.01)。進一步證實了RSV感染通過激活壞死性凋亡的關鍵靶點,促進肺組織細胞的壞死性凋亡,而黃酮類成分通過抑制RIP1/RIP3/MLKL通路減輕了RSV誘導的壞死性凋亡(<0.05、0.01)。
3.5 清肺口服液黃酮類成分對RSV感染的小鼠肺組織RIP1/RIP3壞死復合物的影響
通過免疫熒光對肺組織中RIP1和RIP3的相互作用進行檢測,如圖5所示,RIP1和RIP3的共定位提示RSV促進了壞死復合物的形成,而黃酮類成分的干預降低了它們的共定位,抑制了RIP1和RIP3的相互作用。
3.6 清肺口服液黃酮類成分對RSV感染的小鼠肺上皮細胞p-MLKL蛋白表達的影響
MLKL磷酸化是細胞壞死性凋亡通路中不可或缺的步驟[14],免疫熒光結果(圖6)顯示,RSV感染的小鼠肺組織中p-MLKL陽性綠色信號明顯增加,黃酮類成分處理顯著抑制了p-MLKL的表達。肺上皮細胞是RSV感染的主要靶細胞,增加的p-MLKL染色主要與E-cadherin(上皮細胞的標記物)共定位,這表明黃酮類成分降低了肺上皮細胞中p-MLKL的表達。
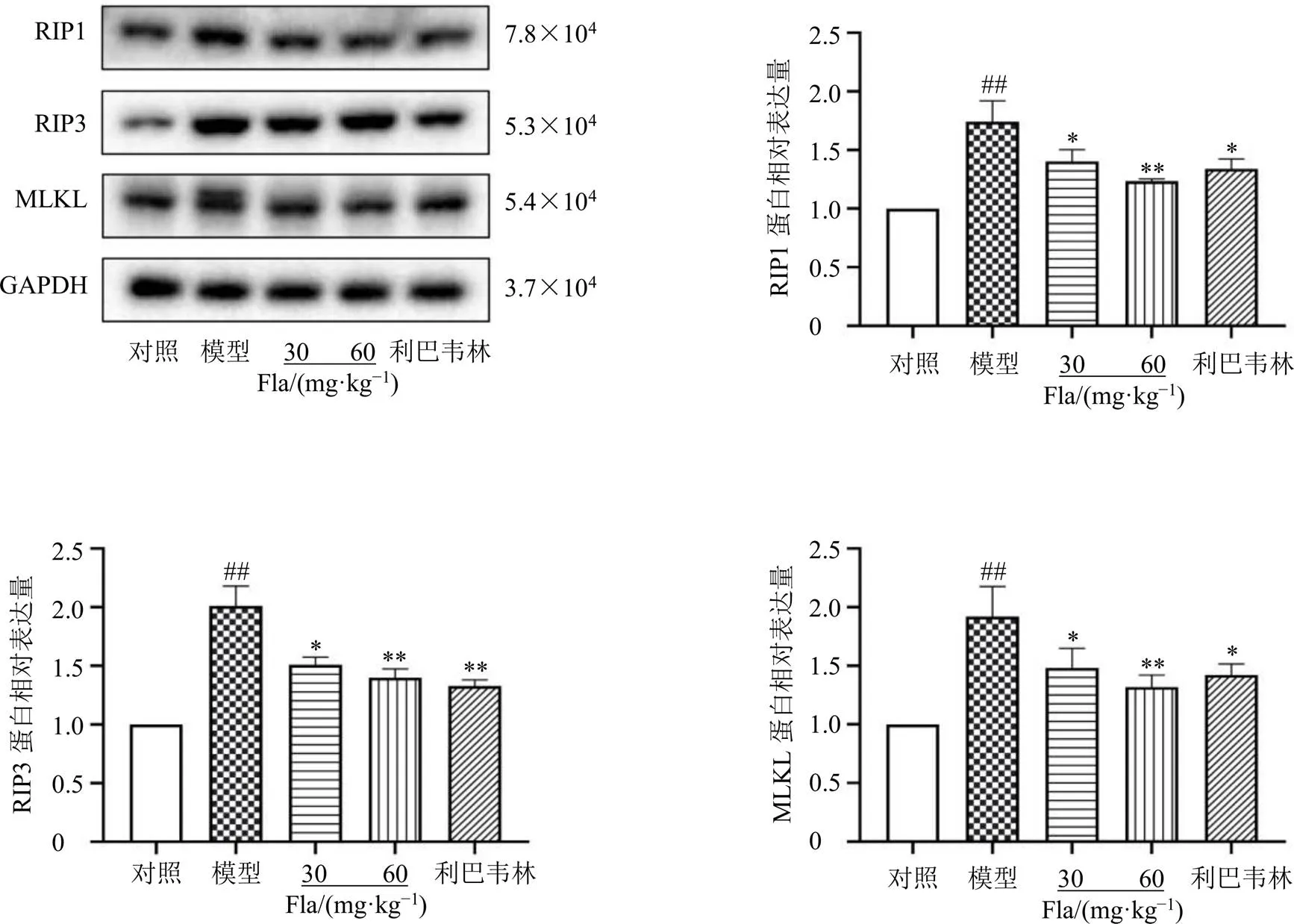
圖4 清肺口服液黃酮類成分對RSV感染的小鼠肺組織RIP1、RIP3和MLKL蛋白表達的影響(, n = 6)
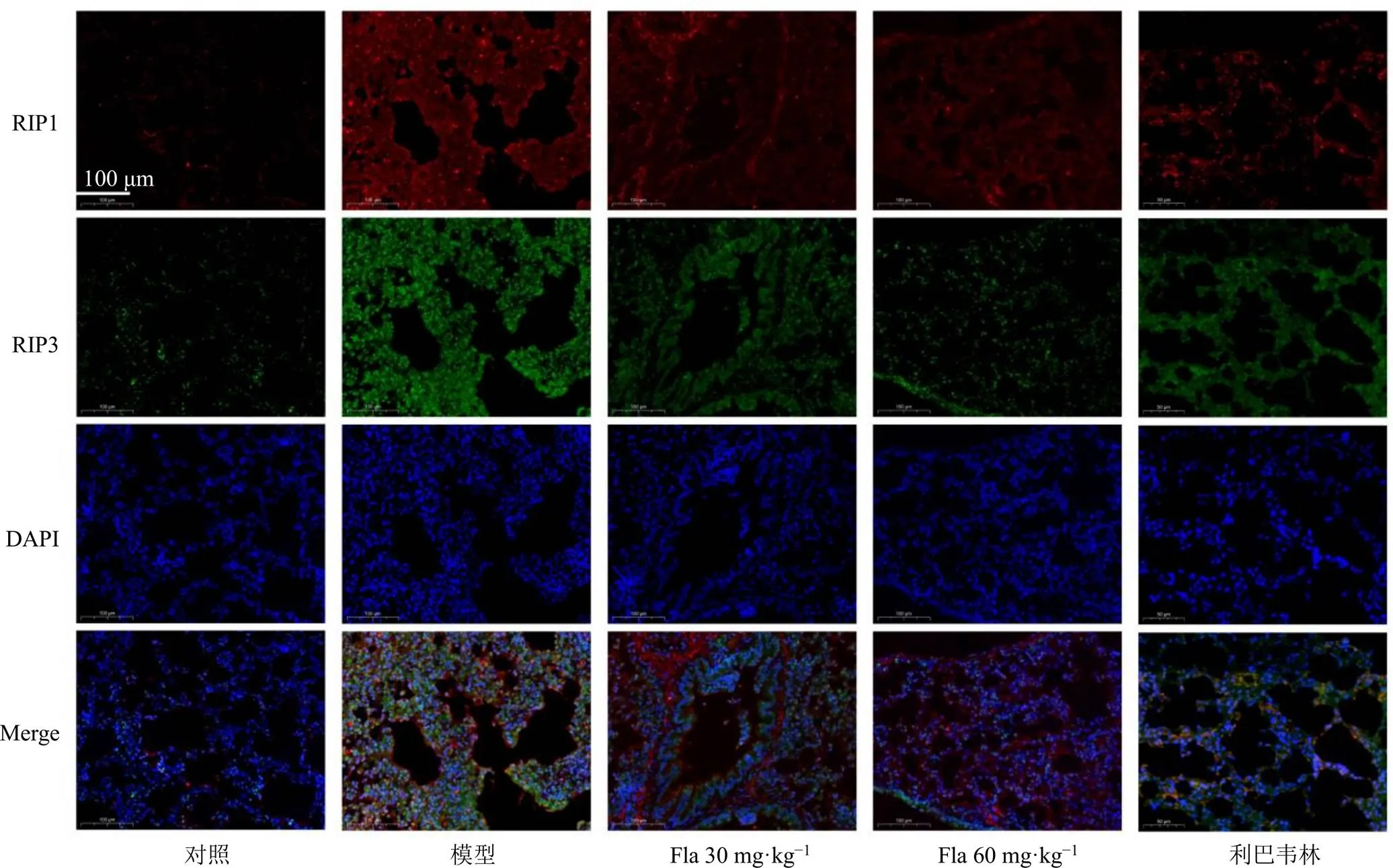
圖5 清肺口服液黃酮類成分對RSV感染的小鼠肺組織中RIP1/RIP3壞死復合物形成的影響(×400)
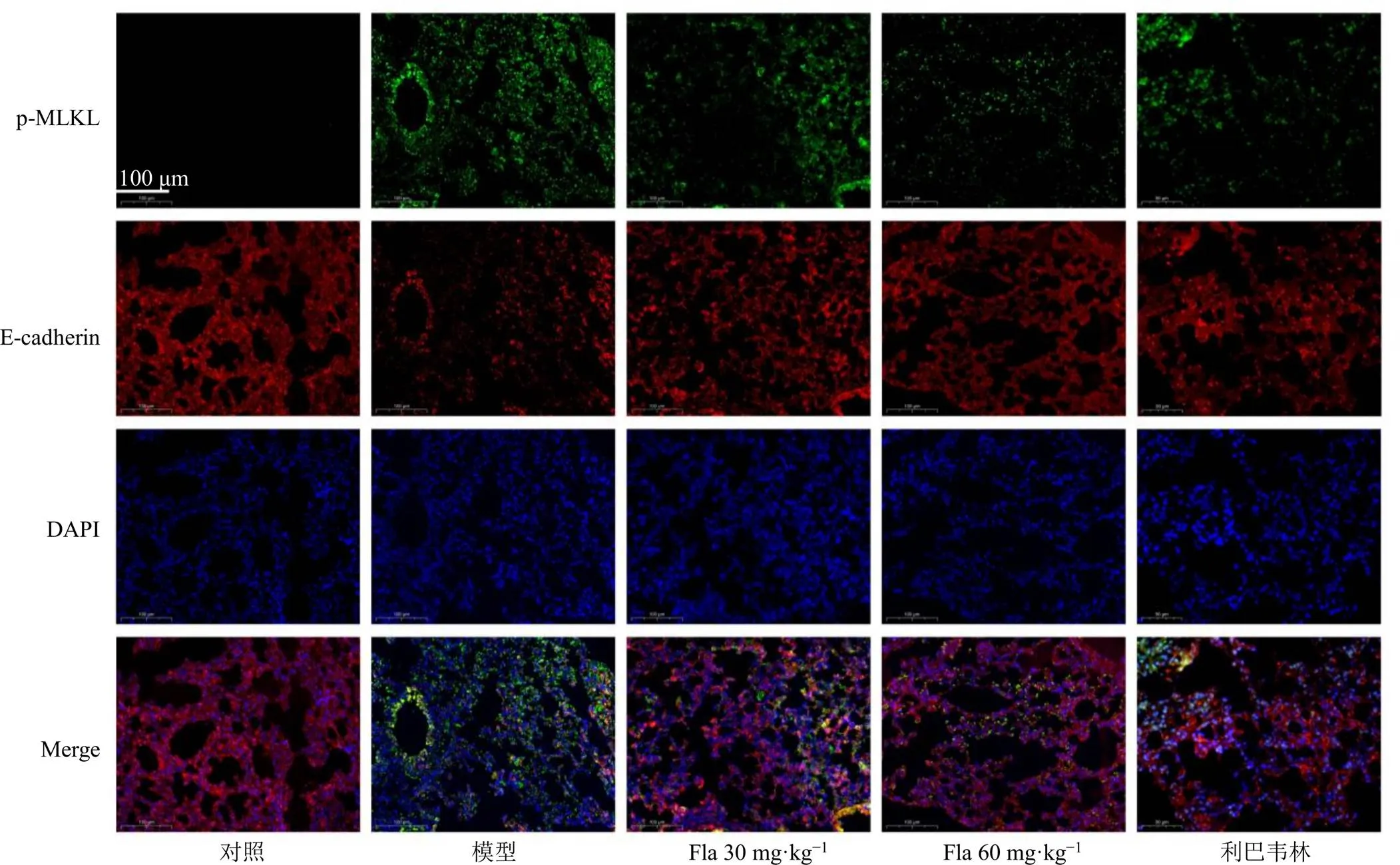
圖6 清肺口服液黃酮類成分對RSV感染的小鼠肺組織p-MLKL蛋白表達的影響(×400)
3.7 清肺口服液黃酮類成分對RSV感染的小鼠肺組織PGAM5/DRP1蛋白表達的影響
RIP1/RIP3形成的壞死復合物可能通過誘導線粒體功能紊亂引起壞死性凋亡,這種紊亂涉及多種機制,如激活PGAM5和DRP1[15]。PGAM5被激活并移動到線粒體外膜,繼而激活DRP1,導致線粒體裂變。PGAM5和DRP1在調節壞死性凋亡和線粒體功能中都發揮著重要作用。進一步檢測參與壞死性凋亡的線粒體蛋白PGAM5和DRP1,如圖7所示,與對照組相比,RSV導致小鼠肺組織中PGAM5和DRP1蛋白表達水平顯著升高(<0.01),給予黃酮類成分干預后PGAM5和DRP1蛋白表達水平均顯著降低(<0.05、0.01),提示黃酮類成分可能通過抑制PGAM5/DRP1減輕壞死性凋亡,改善線粒體功能。
4 討論
RSV嚴重威脅人類健康,尤其是對嬰幼兒、老年人及免疫功能缺陷患者,每年造成巨大的經濟損失。目前批準用于RSV預防和治療的藥物分別為帕利珠單抗和利巴韋林[16]。但兩者均僅適用于RSV感染的高危患者,在療效和安全性方面存在爭議[17-18]。多項臨床研究試驗證明清肺口服液治療RSV肺炎取得了顯著療效,具有獨特的優勢[8,19]。本研究發現,RSV感染的小鼠肺組織中檢測出病毒特異性核酸,肺組織病理充血水腫,炎性細胞因子水平明顯升高,提示該模型構建成功;經清肺口服液黃酮類成分治療后,、和的mRNA表達水平明顯降低,肺組織中炎性浸潤減輕,說明清肺口服液黃酮類成分對RSV導致的肺部炎癥具有改善作用。
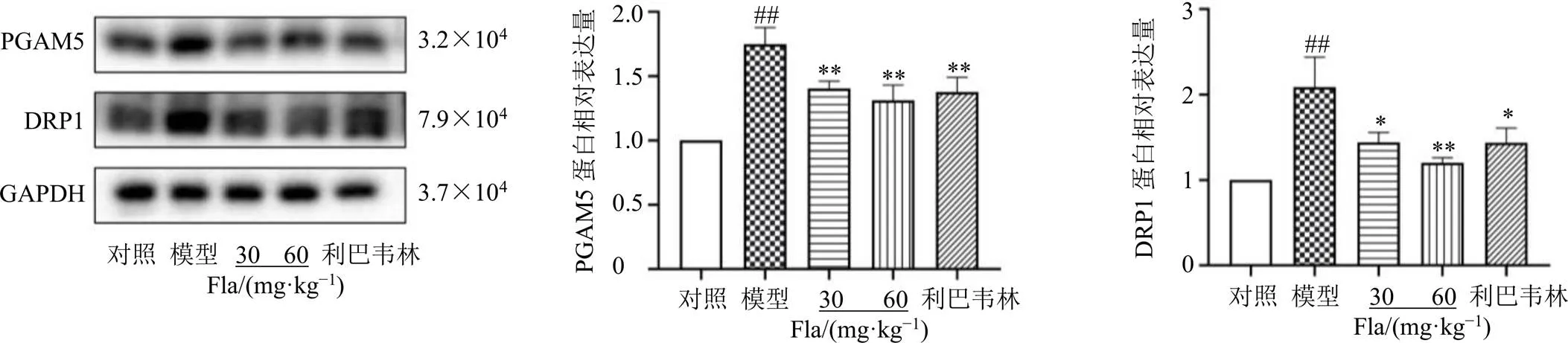
圖7 清肺口服液黃酮類成分對RSV感染的小鼠肺組織PGAM5和DRP1蛋白表達的影響(, n = 6)
壞死性凋亡通常導致大量炎癥因子釋放[4],是一種新型細胞死亡方式,在RSV肺炎的發生與發展中扮演著重要的角色。壞死性凋亡表現為Annexin V和PI雙陽性染色,伴隨著HMGB1的釋放以及細胞膜的破壞,而LDH釋放是細胞質膜破壞的標志[12]。越來越多研究顯示黃酮類成分具有減輕壞死性凋亡的作用,蘆丁能夠通過抑制氧化應激和絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/核因子-κB(nuclear factor-κB,NF-κB)通路改善鎘誘導的肝臟損傷和壞死性凋亡[20];橙皮苷能夠通過抑制RIP3/MLKL介導的壞死性凋亡,改善腸道上皮屏障損傷,從而緩解葡聚糖硫酸鈉誘導的結腸炎[21];槲皮素通過調控信號轉導和轉錄激活子1(signal transducer and activator of transcription 1,STAT1)和NF-κB通路來抑制大鼠脊髓損傷后小膠質細胞極化為M1表型,從而減輕少突膠質細胞的壞死性凋亡[22]。在本研究中,RSV誘導了肺組織細胞的壞死性凋亡,并導致HMGB1和LDH釋放到BALF中,而清肺口服液黃酮類成分可以減輕RSV感染后肺組織細胞的壞死性凋亡,并降低BALF中HMGB1、LDH水平。
壞死性凋亡通路是由RIP1激活啟動的,隨后RIP1和RIP3形成壞死復合物,募集并磷酸化MLKL蛋白,損傷細胞膜,最終導致細胞死亡[13]。MLKL的磷酸化和膜易位是壞死性凋亡的最終執行者。RIP1抑制劑Nec-1可以減輕RSV誘導的上皮細胞壞死性凋亡以及HMGB1釋放[23]。本研究結果顯示,清肺口服液黃酮類成分能夠減少RSV感染后肺組織中RIP1、RIP3、MLKL的表達,同時減少壞死復合物的形成,說明清肺口服液黃酮類成分可以參與調節RIP1/RIP3/MLKL信號通路。肺上皮細胞是RSV感染的主要靶細胞,p-MLKL與上皮細胞標志物E-cadherin的熒光共定位提示,清肺口服液黃酮類成分主要抑制了肺上皮細胞的壞死性凋亡。以上結果說明清肺口服液黃酮類成分可以通過調控RIP1/RIP3/MLKL減輕RSV感染后肺上皮細胞的壞死性凋亡。
壞死性凋亡伴隨著細胞器的損傷,包括線粒體形態和功能障礙。線粒體蛋白PGAM5和DRP1激活后導致的線粒體裂變也促進了壞死性凋亡[15]。抑制或敲低PGAM5表達可以通過抑制DRP1減少心肌細胞的壞死性凋亡,改善線粒體膜電位和活性氧,從而緩解心肌缺血/再灌注損傷[24]。本研究中,清肺口服液黃酮類成分可以降低RSV感染后小鼠肺組織中PGAM5和DRP1蛋白的表達,提示清肺口服液黃酮類成分可以通過調控PGAM5/DRP1,減輕RSV誘導的壞死性凋亡和線粒體功能紊亂。
綜上所述,本研究發現清肺口服液黃酮類成分可能通過抑制RIP1/RIP3/MLKL/PGAM5/DRP1介導的壞死性凋亡,從而減輕RSV導致的肺部炎癥損傷,也為清肺口服液的臨床應用提供了依據。
利益沖突 所有作者均聲明不存在利益沖突
[1] Nair H, Nokes D J, Gessner B D,. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: A systematic review and meta-analysis [J]., 2010, 375(9725): 1545-1555.
[2] Coutts J, Fullarton J, Morris C,. Association between respiratory syncytial virus hospitalization in infancy and childhood asthma [J]., 2020, 55(5): 1104-1110.
[3] Hu M J, Bogoyevitch M A, Jans D A. Impact of respiratory syncytial virus infection on host functions: Implications for antiviral strategies [J]., 2020, 100(4): 1527-1594.
[4] Pasparakis M, Vandenabeele P. Necroptosis and its role in inflammation [J]., 2015, 517(7534): 311-320.
[5] Santos L D, Antunes K H, Muraro S P,. TNF-mediated alveolar macrophage necroptosis drives disease pathogenesis during respiratory syncytial virus infection [J]., 2021, 57(6): 2003764.
[6] 賴建敏. 住院兒童呼吸道合胞病毒肺炎中醫證候特征分析 [D]. 遵義: 遵義醫科大學, 2021.
[7] 汪受傳, 朱先康, 李江全, 等. 開肺化痰解毒法治療小兒病毒性肺炎的研究 [J]. 遼寧中醫雜志, 2001, 28(7): 410-412.
[8] 袁斌, 任現志, 孫軼秋, 等. 清肺口服液治療小兒呼吸道合胞病毒肺炎166例多中心單盲對照臨床觀察 [J]. 中醫雜志, 2009, 50(3): 221-223.
[9] 李淅塤. 基于NF-κB信號通路探究清肺口服液黃酮類成分抗RSV的效應機制[D]. 南京: 南京中醫藥大學, 2021.
[10] 陶嘉磊. 基于I型干擾素信號通路探討清肺口服液類黃酮組分抗RSV研究 [D]. 南京: 南京中醫藥大學, 2020.
[11] Brown P M, Schneeberger D L, Piedimonte G. Biomarkers of respiratory syncytial virus (RSV) infection: Specific neutrophil and cytokine levels provide increased accuracy in predicting disease severity [J]., 2015, 16(4): 232-240.
[12] Weinlich R, Oberst A, Beere H M,. Necroptosis in development, inflammation and disease [J]., 2017, 18(2): 127-136.
[13] Christofferson D E, Yuan J Y. Necroptosis as an alternative form of programmed cell death [J]., 2010, 22(2): 263-268.
[14] Murphy J M, Czabotar P E, Hildebrand J M,. The pseudokinase MLKL mediates necroptosis via a molecular switch mechanism [J]., 2013, 39(3): 443-453.
[15] Wang Z G, Jiang H, Chen S,. The mitochondrial phosphatase PGAM5 functions at the convergence point of multiple necrotic death pathways [J]., 2012, 148(1/2): 228-243.
[16] Griffiths C, Drews S J, Marchant D J. Respiratory syncytial virus: Infection, detection, and new options for prevention and treatment [J]., 2017, 30(1): 277-319.
[17] Hebert M F, Guglielmo B J. What is the clinical role of aerosolized ribavirin? [J]., 1990, 24(7/8): 735-738.
[18] Resch B. Product review on the monoclonal antibody palivizumab for prevention of respiratory syncytial virus infection [J]., 2017, 13(9): 2138-2149.
[19] 張程, 袁斌, 徐建亞, 等. 清肺口服液對RSV肺炎患兒血清中IL-6及TNF-α表達水平的影響 [J]. 中國中醫急癥, 2012, 21(8): 1216-1217.
[20] Liu L L, Zhao L Y, Liu Y,. Rutin ameliorates cadmium-induced necroptosis in the chicken liver via inhibiting oxidative stress and MAPK/NF-κB pathway [J]., 2022, 200(4): 1799-1810.
[21] Zhang J X, Lei H B, Hu X,. Hesperetin ameliorates DSS-induced colitis by maintaining the epithelial barrier via blocking RIPK3/MLKL necroptosis signaling [J]., 2020, 873: 172992.
[22] Fan H, Tang H B, Shan L Q,. Quercetin prevents necroptosis of oligodendrocytes by inhibiting macrophages/microglia polarization to M1 phenotype after spinal cord injury in rats [J]., 2019, 16(1): 206.
[23] Simpson J, Loh Z, Ullah M A,. Respiratory syncytial virus infection promotes necroptosis and HMGB1 release by airway epithelial cells [J]., 2020, 201(11): 1358-1371.
[24] She L, Tu H, Zhang Y Z,. Inhibition of phosphoglycerate mutase 5 reduces necroptosis in rat hearts following ischemia/reperfusion through suppression of dynamin-related protein 1 [J]., 2019, 33(1): 13-23.
Effect of flavonoids in Qingfei Oral Liquid on necroptosis in RSV-infected mice
LING Xiao-ying, DING Ya-li, TAO Jia-lei, YUAN Bin
Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, China
To explore the effect of flavonoids in Qingfei Oral Liquid (清肺口服液) on necroptosis in respiratory syncytial virus (RSV)-infected mice.BALB/c mice were randomly divided into control group, model group, flavonoids low-, high-dose (30, 60 mg/kg) groups and ribavirin (46 mg/kg) group. RSV-infected mice model was established. After continuous administration for 4 d, HE staining was used to observe the pathological changes of lung tissue; qRT-PCR was used to detect interleukin-6 (), tumor necrosis factor-α () andmRNA expressions in lung tissue; Flow cytometry was used to detect necroptosis rate of lung tissue cell; ELISA assay was used to detect lactate dehydrogenase (LDH) and high mobility group protein B1 (HMGB1) levels in bronchoalveolar lavage fluid (BALF) of mice; Western blotting was used to detect protein expressions of receptor-interacting protein 1 (RIP1), RIP3, mixed lineage kinase domain-like (MLKL), phosphoglycerate mutase 5 (PGAM5), dynamin-related protein 1 (DRP1) in lung tissue; Immunofluorescence was used to detect the co-localization of RIP1 and RIP3, co-localization of p-MLKL with epithelial cells.Compared with model group, pathological damage of lung tissue in flavonoids group was alleviated;,andmRNA expressions in lung tissue were decreased (< 0.05, 0.01); Necroptosis rate of lung tissue cells was decreased (< 0.05, 0.01); HMGB1 and LDH levels in BALF were decreased (< 0.05, 0.01); RIP1, RIP3, MLKL, PGAM5 and DRP1 protein expressions in lung tissue were decreased (< 0.05, 0.01); Formation of RIP1/RIP3 necrotic complex in lung tissue was decreased, fluorescence expression of p-MLKL in lung epithelial cells was decreased.Flavonoids in Qingfei Oral Liquid may inhibit necroptosis by regulating RIP1/RIP3/MLKL/PGAM5/DRP1 signaling pathway, and improve lung inflammation in RSV-infected mice.
Qingfei Oral Liquid; flavonoids; respiratory syncytial virus; necroptosis; receptor-interacting protein 1; receptor-interacting protein 3; mixed lineage kinase domain like pseudokinase; phosphoglycerate mutase 5; dynamin-related protein 1
R285.5
A
0253 - 2670(2022)13 - 4019 - 09
10.7501/j.issn.0253-2670.2022.13.015
2022-03-23
國家中醫藥管理局項目(2019XZZX-ek003);國家自然科學基金資助項目(81873340);國家自然科學基金資助項目(82174436);江蘇省研究生實踐創新計劃項目(KYCX21_1647)
凌曉穎,博士研究生。E-mail: 295047667@qq.com
袁 斌,教授,主要從事中醫藥防治小兒肺系疾病的研究。E-mail: yfy0045@njucm.edu.cn
[責任編輯 李亞楠]

