深低溫冷凍對大鼠髕腱肌腱干細胞干性及多向分化能力的影響
代廣春,李滎娟,劉俊延,芮云峰
(1.東南大學附屬中大醫院 骨科,江蘇 南京 210009; 2.東南大學 醫學院,江蘇 南京 210009;3.東南大學附屬中大醫院 創傷中心,江蘇 南京 210009; 4.東南大學 骨科研究所,江蘇 南京 210009; 5.東南大學附屬中大醫院 老年科,江蘇 南京 210009)
1 材料和方法
1.1 材料
1.2 大鼠TDSCs的分離和培養
1.3 干細胞標志物檢測
1.4 成骨分化能力檢測
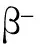
1.5 成脂分化能力檢測
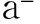
1.6 成軟骨分化能力檢測
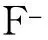
1.7 肌腱標志物檢測
將不同組TDSCs以5×103cm-2的密度接種,待細胞融合度達80%~90%時收獲細胞,提取細胞mRNA,qRT- PCR檢測肌腱標志物Col1、SCX和TNMD,同時用細胞免疫熒光檢測Col1和TNMD蛋白表達變化。
1.8 qR PCR
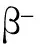
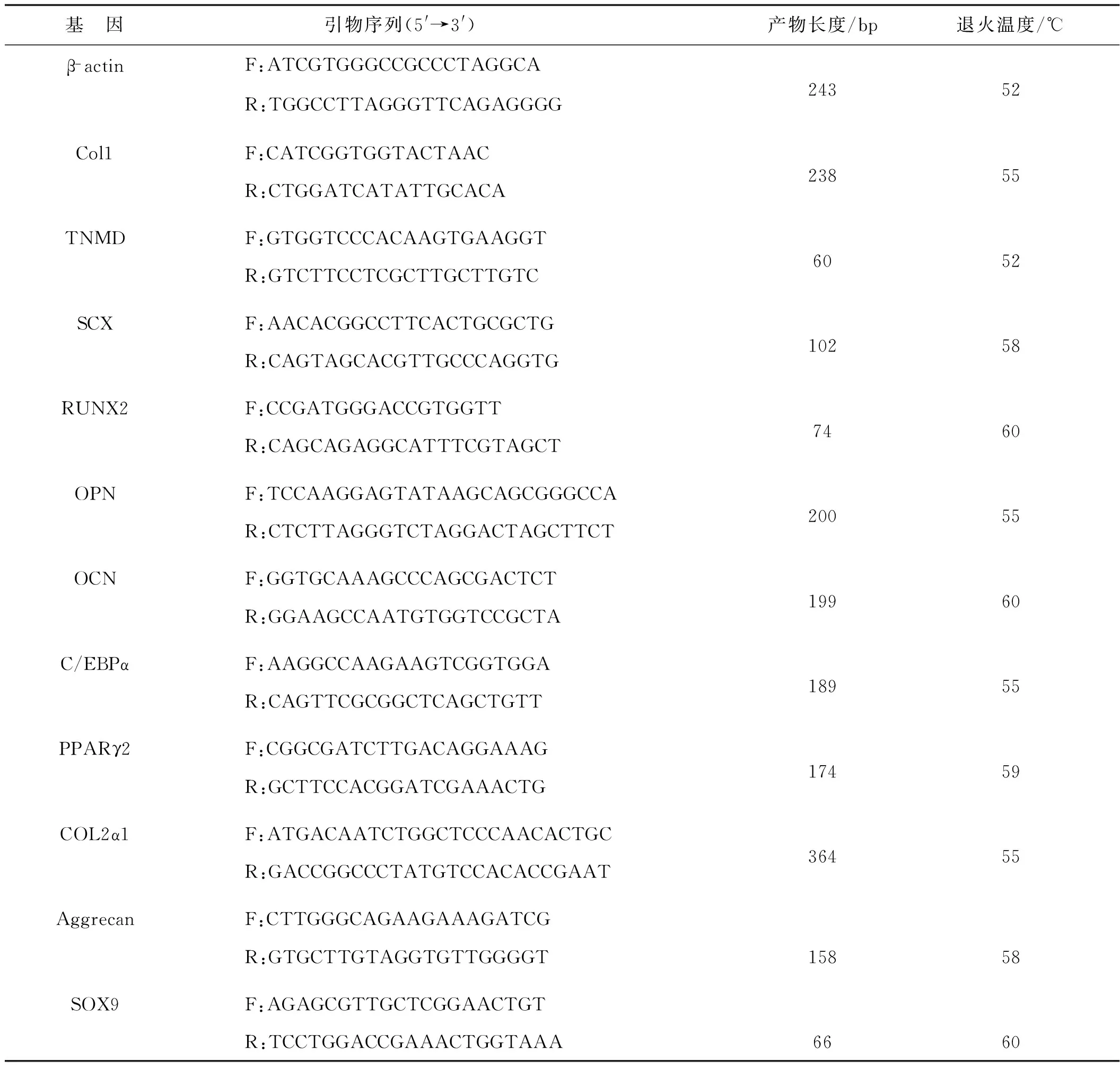
表1 目的基因引物序列、產物長度和退火溫度Tab 1 Primer sequences, product size and annealing temperature of target genes
1.9 統計學處理
采用SPSS 22.0統計軟件進行分析。數據以均數±標準差表示,多組間比較使用單因素方差分析,兩組間比較使用獨立樣本t檢驗。P<0.05為差異具有統計學意義。
2 結 果
2.1 細胞形態學
P0代時,兩組均可見大的多邊形和星形細胞形態。P3代時,兩組均可見均一的成纖維樣細胞形態。見圖1。
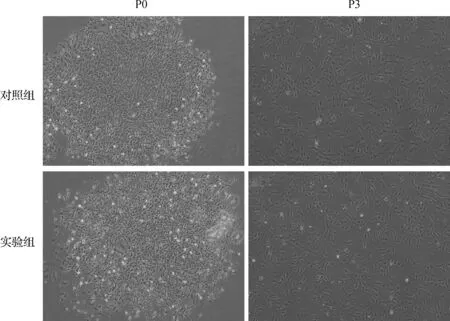
圖1 細胞形態學觀察(×40)Fig 1 Cell morphology observation(×40)
2.2 干細胞標志物表達
兩組TDSCs均有干細胞標志物蛋白,包括Nanog、Oct4和Sox2的表達,主要位于胞核中。同時,這些標志物表達強度的半定量分析表明,兩組TDSCs的蛋白表達量之間差異無統計學意義(P>0.05)。見圖2。
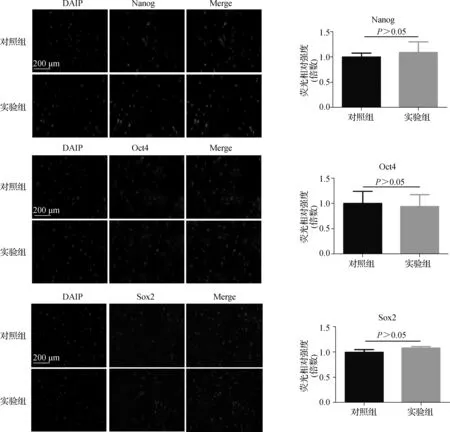
圖2 干細胞標志物表達水平Fig 2 Expression levels of stemnes related markers
2.3 成骨分化能力
茜素紅染色顯示普通培養基培養下兩組TDSCs的細胞外基質中均未見礦化物質(圖3A、B),成骨誘導培養基培養下兩組TDSC的細胞外基質中均可見大量礦化物質出現(圖3C、D)。與普通培養基相比,誘導培養基培養下TDSCs的細胞外基質的礦化物質明顯更多。半定量結果顯示4組吸光度值(OD)之間存在明顯差異(F=83.926,P<0.001);兩兩比較顯示誘導培養基培養下兩組TDSCs的OD均高于普通組(P<0.05),但是兩組TDSCs的OD在誘導培養基和普通培養基之間均無差異(P>0.05)(圖3E)。

A~D.茜素紅染色結果;E.半定量檢測OD;F.成骨分化標志物mRNA表達值圖3 成骨分化能力比較(×40)Fig 3 Comparison of osteogenic differentiation ability(×40)
4組TDSC中Runx2(F=8.978,P=0.006)、OPN(F=183.387,P<0.001)和OCN(F=55.855,P<0.001)的mRNA表達值之間均存在明顯差異;兩兩比較顯示誘導培養基培養下兩組TDSC中Runx2、OPN和OCN的mRNA表達顯著高于普通培養基(P<0.05),但是兩組TDSCs中Runx2、OPN和OCN的mRNA表達在誘導培養基和普通培養基之間均無差異(P>0.05)(圖3F)。
2.4 成脂分化能力
油紅O染色顯示普通培養基培養下兩組TDSCs的細胞外基質中均未見油紅O陽性脂滴(圖4A、B),成脂誘導培養基培養下兩組TDSCs的細胞外基質中均可見大量油紅O陽性脂滴(圖4C- F)。與普通培養基相比,誘導培養基培養下TDSCs的細胞外基質的油紅O陽性脂滴明顯更多。半定量結果4組OD之間差異有統計學意義(F=49.199,P<0.001);兩兩比較顯示誘導培養基培養下兩組TDSCs的OD值均高于普通組(P<0.05),但是兩組TDSCs的OD值在誘導培養基和普通培養基之間均無差異(P>0.05)(圖4G)。
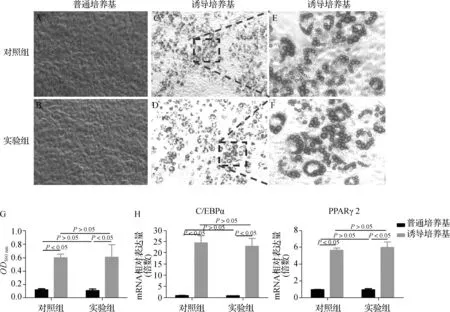
A~F.油紅O染色結果;G.半定量檢測OD;H.成脂分化標志物mRNA表達值圖4 成脂分化能力比較(×40)Fig 4 Comparison of adipogenic differentiation ability(×40)
4組TDSC中C/EBPα(F=31.106,P<0.001)和PPARγ2(F=61.929,P<0.001)的mRNA表達值之間差異均有統計學意義;兩兩比較顯示誘導培養基培養下兩組TDSC中C/EBPα和PPARγ2的mRNA表達顯著高于普通培養基(P<0.05),但是兩組TDSCs中C/EBPα和PPARγ2的mRNA表達在誘導培養基和普通培養基之間均無差異(P>0.05)(圖4H)。
2.5 軟骨分化潛力
兩組TDSCs的阿利新藍染色顯示,均可觀察到軟骨樣細胞的存在和酸性黏多糖(藍色)的形成(圖5A、B)。
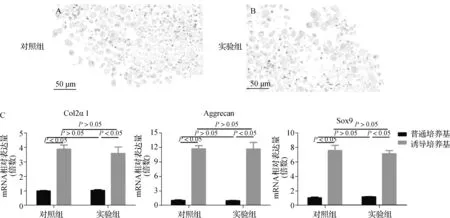
A、B.阿利新藍染色結果;C.成軟骨分化標志物mRNA表達值圖5 成軟骨分化能力比較Fig 5 Comparison of chondrogenic differentiation ability
4組TDSCs中Col2α1(F=36.318,P<0.001)、Aggrecan(F=67.608,P<0.001)和Sox9(F=74.030,P<0.001)的mRNA表達值之間差異均有統計學意義;兩兩比較顯示誘導培養基培養下兩組TDSC中Col2α1、Aggrecan和Sox9的mRNA表達顯著高于普通培養基(P<0.05),但是兩組TDSCs中Col2α1、Aggrecan和Sox9的mRNA表達在誘導培養基和普通培養基之間均無差異(P>0.05)(圖5C)。
2.6 肌腱相關標志物表達

A.qR PCR檢測肌腱相關標志物mRNA表達;B~E.細胞免疫熒光檢測標志物蛋白表達圖6 肌腱相關標志物的表達水平Fig 6 Expression levels of tendo related markers
3 討 論
近年來,TDSCs已先后在小鼠、人[11]、大鼠[12]和兔子[15]等肌腱組織中被分離和鑒定出,這些干細胞被證實對肌腱損傷的修復、愈合和再生具有非常重要的作用。本研究探討深低溫冷凍處理對TDSCs的干性和多向分化能力的影響,結果顯示深低溫冷凍處理的肌腱組織中可成功分離出有活性的TDSCs,且TDSCs的干性和多向分化能力在冷凍前后未受影響。
成年哺乳動物干細胞以沉默狀態和活躍狀態存在于組織中,并在維持組織代謝平衡和參與組織修復中發揮重要作用[16]。肌腱損傷后,肌腱愈合過程中通常會發生TDSCs被激活從而分化為肌腱細胞來促進組織修復[15]。TDSCs的增殖、克隆形成和多向分化能力對于損傷的修復至關重要[17]。增殖和克隆形成能力常與修復的速率息息相關[18]。我們前期的研究[14]表明,TDSCs的增殖和克隆形成能力在冷凍前后沒有明顯改變。在人的冷凍脂肪組織同樣發現組織內間質血管細胞的增殖能力仍良好保持著[19]。Nanog、Oct4和Sox2常與干細胞的多能性和自我更新有關,是未分化狀態和未分化細胞的重要指標[18,20]。因此,本研究選擇這3個指標為TDSCs的干性指標。在人的冷凍睪丸組織可觀察到有活性的精原干細胞,且細胞干性標志物能正常表達[21]。在人的冷凍牙濾泡組織可分離出牙髓干細胞,且與未處理組細胞保持相似的多向分化能力[22]。本研究結果顯示TDSCs保留了干性和多向分化能力,說明在利用同種異體移植肌腱修復肌腱缺損時,存活的TDSCs可以作為細胞池進而為肌腱細胞提供源源不斷的來源,很好地促進組織的修復。
對肌腱組織損傷后愈合機制的進一步了解將有助于在治療過程中制定更有效的策略。同樣,該概念還可以應用于其他肌腱和韌帶模型中,包括前交叉韌帶、跟腱和“肩袖”肌腱等,此類組織經深低溫冷凍處理后是否存在有活性的干細胞值得進一步探究。同時,這樣的技術還可以應用到包括關節軟骨和半月板等其他組織模型中,后續值得探究。
本研究也存在局限性,例如沒有體內試驗、參與研究的樣本量有限、冷凍時間較短等因素。因此,后續實驗可擴大樣本量、延長冷凍時間和進行體內實驗;同時,還可研究深低溫冷凍保存同種異體組織的免疫原性、組織學和生物力學變化以及臨床應用效果。

