定量沉默c-Met基因表達對乳腺癌細胞MDA-MB-231增殖和化療敏感性的影響*
王金西,郭曉娟,程錦紅,張紹東,焦保庭
(1.河北省邯鄲市第一醫院普外四科 056002;2.河北省邯鄲市中心醫院病理科 056001)
乳腺癌是女性最常見的惡性腫瘤之一,其發病率和病死率位居高位,且發病率有逐年升高的趨勢,逐漸成為影響女性健康的首位惡性腫瘤[1]。化療是臨床治療乳腺癌的主要手段之一,但隨著化療藥物的長期應用,患者易對化療藥物產生抗藥性,影響化療的效果[2]。這一現象嚴重影響了乳腺癌患者的生存質量及疾病預后[3-4]。作為傳統的化療藥物,表阿霉素被認為是治療乳腺癌最常用和有效的藥物。然而,如何提高癌細胞對表阿霉素藥物的敏感性目前已成為一個重要的臨床問題。c-Met是一種原癌基因,屬于酪氨酸激酶受體家族,其配體為肝細胞生長因子(hepato-cyte growth factor,HGF)[5],c-Met與HGF結合形成同源二聚體,可使酪氨酸磷酸化并激活下游信號通路。c-Met基因失調或活化與人類腫瘤的發生、發展有密切聯系。過去的幾十年中,多項研究證實c-Met在乳腺癌組織中過表達,與其相關的信號通路與乳腺癌的發展、預后密切相關[6]。QUE等[7]研究發現,在骨髓瘤細胞中抑制c-Met的表達可以提高腫瘤細胞對阿霉素化療的敏感性。嚴婧等[8]研究報道,抑制c-Met信號通路可增加白血病細胞株對硼替佐米的化療敏感性。因此,針對c-Met的靶向治療可以為腫瘤耐藥后的治療提供新的策略及方法。
1 材料與方法
1.1 材料
乳腺癌MDA-MB-231細胞株購于上海生命科學院細胞庫,胎牛血清購于美國Hyclone公司,RPMI1640培養基、DMEM培養基購于邁晨科技(北京)有限公司,嘌呤霉素購于美國Sigma公司,鼠抗人c-Met單抗購于德國CalBiochem公司,噻唑藍(MTT)及二甲基亞砜(DMSO)購于北京索萊寶生物技術有限公司,鼠抗人Cleaved 多聚二磷酸腺苷(ADP)-核糖聚合酶(PARP)、Cleaved 天冬氨酸特異性半胱氨酸蛋白酶-3(caspase-3)一抗、辣根過氧化物酶(HRP)標記羊抗兔二抗IgG 均購于美國Cell signaling公司;兔抗人三磷酸甘油醛脫氫酶(GAPDH)單抗購于美國Santa Cruz公司。流式細胞檢測用試劑盒購于美國Invitrogen公司;表阿霉素購于美國Sigma公司。
1.2 方法
首先參考文獻查找針對c-Met的短發夾RNA(short hairpin RNA,shRNA),TA載體構建并篩選沉默效果最佳的shRNA,進行慢病毒包裝,收集病毒液感染MDA-MB-231細胞,用嘌呤霉素篩選出穩定細胞系PSD400-c-Met-shRNA-MDA-MB-231,鑒定穩定細胞系[9]。
1.2.1細胞培養
MDA-MB-231細胞(空白對照)、PSD400-c-Met-shRNA-MDA-MB-231細胞、PSD400-scramble-MDA-MB-231細胞(陰性對照)均培養于含10%胎牛血清、100 U/mL青霉素和100 μg/mL鏈霉素的DMEM培養基中,置于37 ℃、5% CO2飽和濕度培養箱中培養,每隔2 d更換培養基,0.25%的胰酶消化傳代。
1.2.2篩選最佳多西環素(Doxycycline,DOX)誘導濃度
選擇對數增長期的pSD400-c-Met-shRNA-MDA-MB-231細胞接種于6孔板中,5×105/孔,向培養基中加入DOX進行誘導,終濃度分別調整為0、0.1、0.2、0.3、0.4、0.5 μg/mL。培養72 h后提取細胞蛋白,進行Western blot檢測,根據c-Met蛋白表達水平篩選出最適合的DOX濃度。最終選擇0.4 μg/mL。
1.2.3細胞誘導
將對數生長期的3種細胞用0.25%胰酶消化,接種于6孔板中,每孔加入5×105個細胞、2 mL培養基,設置復孔,加入DOX,使終濃度為0.4 μg/mL,吹打均勻,誘導48 h。
1.2.4MTT法檢測適當敲除c-Met基因后對細胞增殖的影響
把3種細胞接種在6孔板中,每孔接種4×105個細胞,每種細胞分成兩組即有DOX誘導組(+DOX)和無DOX誘導組(-DOX)。待細胞貼壁后加入DOX(0.4 μg/mL)進行誘導,誘導3 d后將細胞接種于96孔板中,每孔接種1.5×103個細胞。設置6個實驗組(+DOX shRNA、+DOX scramble、+DOX MDA-MB-231、-DOX shRNA、-DOX scramble、-DOX MDA-MB-231),每組設5個復孔,6個觀察時間點。為防止邊緣效應周邊各孔加入200 μL的磷酸鹽緩沖液(PBS)。各組細胞在37 ℃、5% CO2條件下培養。分別于12、24、48、72、96、120 h時間點檢測。檢測時每孔加入 20 μL MTT溶液(5 mg/mL),在37 ℃溫箱避光孵育4 h,然后去掉96孔板中的培養基,每孔加入150 μL DMSO,將96孔板振蕩10 min。用酶標儀檢測490 nm波長下的吸光度(A490)值,并處理數據。
1.2.5MTT檢測細胞對表阿霉素的化療敏感性
將誘導的3種細胞及對照組細胞胰酶消化后接種于96孔板中,每孔按照2×103/mL接種,分別加入終濃度為0、0.25、0.5、1、5、10 μg/mL的表阿霉素藥物,每個濃度設置3個復孔,并設置調零孔及空白對照孔。用MTT法檢測A490值。計算細胞存活率。使用GraphPad Prism6.0軟件計算細胞的藥物半數抑制濃度(IC50)并繪制細胞存活率曲線。
1.2.6流式細胞儀檢測細胞周期分布
將誘導的3種細胞及對照組細胞胰酶消化后接種于6孔板中,每孔接種細胞5×105個,置于37 ℃、5% CO2溫箱孵育24 h后去掉原培養基,加入含表阿霉素藥物的培養基,使終濃度為5 μg/mL,培養48 h后去掉原培養基,用無酶消化液[含0.04%乙二胺四乙酸(EDTA)]處理細胞制成細胞懸液,用PBS洗滌并重懸細胞,調整細胞密度為2×105/mL,取1 mL單細胞懸液,離心去上清液,加入1 mL 70%的預冷乙醇,4 ℃固定過夜。染色前用PBS洗滌2次,加入100 mg/L核糖酸酶A(RNaseA),37 ℃水浴30 min。再加入500 μL(50 mg/L)碘化丙啶(PI)染色液混勻,4 ℃避光反應30 min后,轉移至流式細胞儀進行檢測,每組重復3次。流式細胞儀檢測細胞周期,計算 G0/G1期、S期和G2/M期細胞百分比。
1.2.7Western blot檢測細胞中PARP、caspase-3表達
將3種細胞于37 ℃、5% CO2孵育24 h后棄去原培養基,加入含終濃度為5 μg/mL表阿霉素的培養基,培養48 h后收集各組細胞,提取細胞總蛋白,每組設3個復孔。經十二烷基硫酸鈉-聚丙烯酸胺凝膠電泳(SDS-PAGE)、電轉膜至甲醛預處理過的聚偏氟乙烯(PVDF)膜密封2 h,洗膜并分別以鼠抗人Cleaved PARP 、Cleaved caspase-3單克隆抗體作為一抗,在4 ℃下孵育過夜,洗膜加入辣根過氧化物酶標記的二抗,于室溫下孵育2 h。再用電化學發光(ECL)顯示,收集影像,以GAPDH作為內參,采用凝膠圖像處理系統軟件分析各組的條帶灰度值。
1.3 統計學處理
2 結 果
2.1 篩選最佳DOX誘導濃度
將嘌呤霉素篩選出來的穩定細胞系pSD400-c-Met-shRNA-MDA-MB-231用不同濃度的DOX進行誘導,然后Western blot檢測c-Met蛋白表達,結果顯示c-Met蛋白表達水平隨著DOX濃度增加逐漸降低,當DOX濃度在0.5 μg/mL時,c-Met蛋白幾乎不表達。為了避免因c-Met基因被完全敲除而導致細胞死亡,選擇DOX濃度為0.4 μg/mL,見圖1。
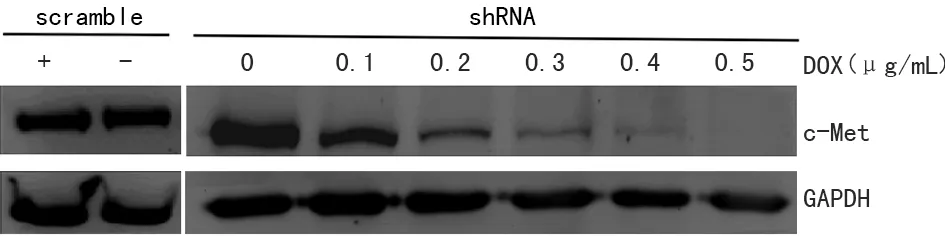
shRNA:pSD400-c-Met-shRNA-MDA-MB-231細胞組;scramble:pSD400-scramble-MDA-MB-231細胞組。
2.2 適當沉默c-Met基因后對MDA-MB-231細胞增殖的影響
3種細胞株接種在96孔板中并加入DOX(濃度:0.4 μg/mL)進行誘導,誘導時間分別為12、24、48、72、96、120 h,在各時間點進行MTT檢測,讀取A490值。由于可誘導shRNA是建立在四環素操縱子(TetO)系統基礎上的慢病毒載體,穩定細胞系在常規培養時與一般細胞無明顯差異,當培養基中加入DOX后,便可誘導穩定細胞系合成shRNA,從而對目的基因進行定量沉默。實驗結果顯示,pSD400-c-Met-shRNA-MDA-MB-231細胞株中經過DOX誘導的細胞(有DOX誘導組)c-Met基因被適當沉默,細胞增殖受到抑制,隨著時間的延長抑制越來越明顯,與無DOX誘導組相比有明顯差異(P<0.05);而陰性對照組及空白組細胞無論有無DOX誘導,細胞增殖無明顯差異(P>0.05)。DOX誘導后pSD400-c-Met-shRNA-MDA-MB-231細胞c-Met基因被適當沉默,較pSD400-scramble-MDA-MB-231細胞增殖明顯受到抑制(P<0.05),見圖2。
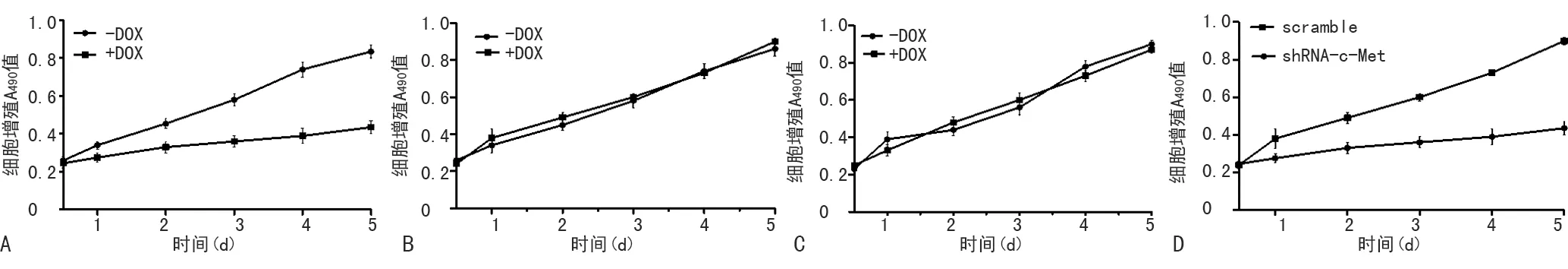
A:加/不加DOX適當沉默c-Met后對pSD400-c-Met-shRNA-MDA-MB-231細胞增殖的變化;B:加/不加DOX對pSD400-scramble-MDA-MB-231細胞增殖的變化;C:加/不加DOX對MDA-MB-231細胞增殖的變化;D:DOX誘導后pSD400-c-Met-shRNA-MDA-MB-231細胞和pSD400-scramble-MDA-MB-231細胞增殖的變化;shRNA-c-Met:pSD400-c-Met-shRNA-MDA-MB-231細胞;scramble:pSD400-scramble-MDA-MB-231細胞。
2.3 適當沉默c-Met基因后MDA-MB-231細胞對表阿霉素的化療敏感性檢測
DOX誘導細胞后,給予不同濃度表阿霉素作用,采用MTT法檢測其對細胞存活率的影響。結果顯示,適當沉默MDA-MB-231細胞c-Met基因表達(有DOX誘導組),其細胞存活率隨著表阿霉素濃度的增加較無沉默c-Met細胞(無DOX誘導組)呈現明顯降低的趨勢,陰性對照組及空白細胞組無明顯差異。經過DOX誘導、表阿霉素處理后pSD400-c-Met-shRNA-MDA-MB-231細胞株IC50為1.23 μg/mL,無DOX誘導組IC50為4.92 μg/mL,差異有統計學意義(P<0.05)。pSD400-scramble-MDA-MB-231細胞株中有DOX誘導組IC50為5.56 μg/mL,無DOX誘導組IC50為5.13 μg/mL;MDA-MB-231細胞株中有DOX誘導組IC50為5.46 μg/mL,無DOX誘導組IC50為5.68 μg/mL;兩種細胞株有、無DOX誘導組IC50比較,差異均無統計學意義(P>0.05),見圖3。
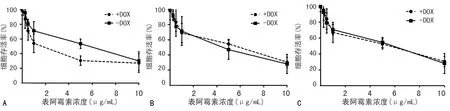
A:加/不加DOX適當沉默c-Met后聯合表阿霉素對pSD400-c-Met-shRNA-MDA-MB-231細胞存活率的影響;B:加/不加DOX聯合表阿霉素對pSD400-scramble-MDA-MB-231細胞存活率的影響;C:加/不加DOX對MDA-MB-231細胞存活率的影響。
2.4 適當沉默c-Met基因表達聯合表阿霉素作用后對細胞凋亡的影響
3種細胞經DOX誘導后,加入4 μg/mL表阿霉素,經48 h后利用流式細胞儀檢測細胞的周期分布情況。結果顯示,pSD400-c-Met-shRNA-MDA-MB-231細胞株經DOX誘導的細胞(有DOX誘導組)G0/G1期細胞百分比為(53.7±1.42)%,S期及G2/M期細胞百分比降低,分別為(38.1±1.13)%、(8.2±0.78)%,差異有統計學意義(P<0.05);而未經DOX誘導的細胞(無DOX誘導組)G0/G1期細胞百分比為(33.5±1.18)%。pSD400-scramble-MDA-MB-231細胞株中有、無DOX誘導組G0/G1期細胞百分比[(32.2±1.26)%vs.33.4±1.12%)]和MDA-MB-231細胞株中有、無DOX誘導組G0/G1期細胞百分比[(32.7±1.31)%vs.(33.1±1.42%)]均無明顯差異(P>0.05),見圖4。
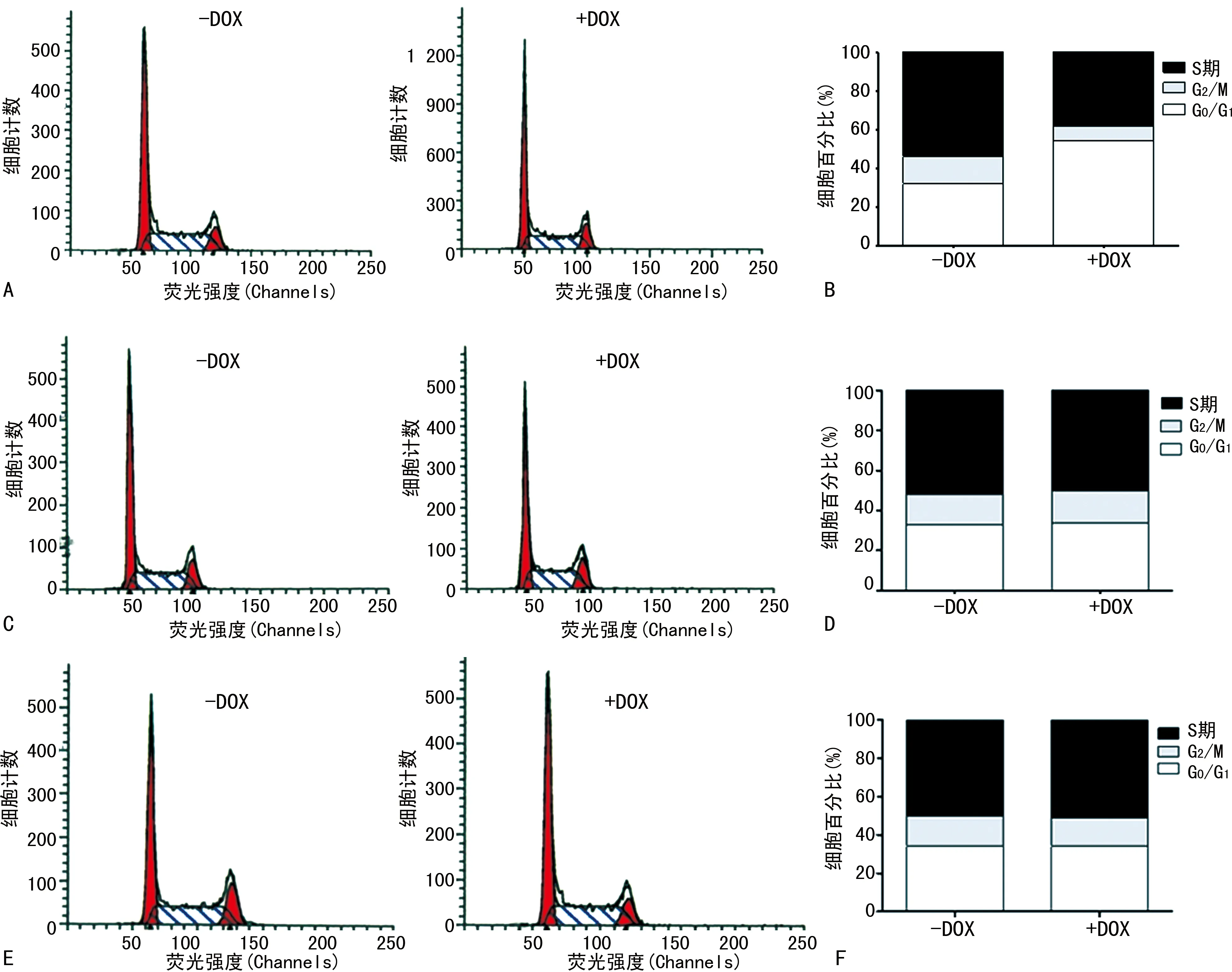
A:加/不加DOX適當沉默c-Met后聯合表阿霉素pSD400-c-Met-shRNA-MDA-MB-231細胞周期的變化;B:加/不加DOX適當沉默c-Met后聯合表阿霉素pSD400-c-Met-shRNA-MDA-MB-231細胞不同周期細胞百分比;C:加/不加DOX聯合表阿霉素pSD400-scramble-MDA-MB-231細胞周期的變化;D:加/不加DOX聯合表阿霉素pSD400-scramble-MDA-MB-231細胞不同周期細胞百分比;E:加/不加DOX MDA-MB-231細胞周期的變化;F:加/不加DOX MDA-MB-231細胞不同周期細胞百分比。
2.5 Western blot檢測細胞凋亡蛋白表達
適當敲除MDA-MB-231細胞c-Met基因后聯合表阿霉素,Western blot檢測細胞中凋亡相關蛋白PARP、caspase-3的表達變化。結果顯示,pSD400-c-Met-shRNA-MDA-MB-231細胞株Cleaved PARP、Cleaved caspase-3表達水平增加明顯,而pSD400-scramble-MDA- MB-231細胞株無論有無DOX誘導,Cleaved PARP、Cleaved caspase-3表達水平無明顯差異,見圖5。
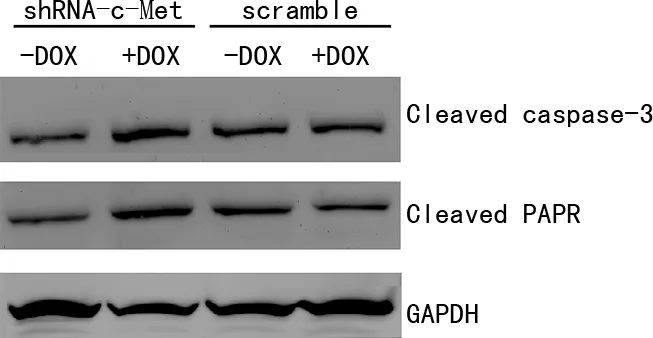
shRNA-c-Met:pSD400-c-Met-shRNA-MDA-MB-231細胞;scramble:pSD400-scramble-MDA-MB-231細胞。
3 討 論
化療目前仍為乳腺癌主要的治療方法,但癌細胞對化療藥物的耐藥性是影響乳腺癌患者預后的主要障礙。表阿霉素由于抗腫瘤效果好且價格低廉,目前為乳腺癌化療常用藥物,但其嚴重的心臟毒性及骨髓抑制,使不少乳腺癌患者不能完成整個化療療程。如何增加乳腺癌細胞對表阿霉素的敏感性顯得尤為重要。
c-Met是一種原癌基因,HGF是其配體,屬于受體酪氨酸蛋白激酶家族成員[10]。腫瘤的侵襲性、脈管浸潤、淋巴結轉移、遠處轉移、耐藥性及預后與c-Met過度表達密不可分[11]。因此,c-Met可能是一個潛在的腫瘤治療靶點,其抑制劑的研究現已成為腫瘤治療領域的熱點。過去很多年的研究中證實,乳腺癌組織中c-Met呈過表達,乳腺癌的發展及預后與c-Met相關的信號通路有密切關系[12]。c-Met抑制劑SGX523能明顯抑制乳腺癌MDA-MB-231細胞增殖并誘導細胞凋亡,使細胞周期G0/G1期阻滯,這一研究被馮煒紅等[13]證實,這為c-Met靶向治療的臨床轉化提供了良好的實驗及理論基礎。
RNA干擾(RNAi)是有效沉默或抑制目標基因表達的過程。RNAi沉默機制是由小干擾RNA(siRNA)或shRNA誘導實現靶mRNA的降解,或者通過微RNA(miRNA)誘導特定mRNA翻譯的抑制[14]。目前shRNA慢病毒載體被廣泛地用于RNAi研究中,這得益于shRNA在宿主細胞中能高效、長期穩定地表達。本研究所采用的可誘導shRNA是建立在TetO系統基礎上的誘導系統,它含有TetO序列,后者可以與四環素阻遏蛋白(TetR)結合并能阻止TetO的啟動子啟動shRNA的轉錄。四環素(Tet)或DOX可以與TetR結合,可使TetR的結構發生改變,最終導致TetO序列上的TetR脫落,使shRNA轉錄表達。
多項實驗研究證實,在多種腫瘤細胞中shRNA對c-Met的沉默是有效的[15-16]。本次研究成功構建針對c-Met的shRNA穩定細胞系,該細胞系常規培養時與陰性對照組無差別,不表達shRNA,在加入DOX誘導后,穩定細胞系可表達shRNA,從而導致穩定細胞c-Met蛋白表達水平降低,細胞增殖能力受到抑制。前期研究發現,如果完全敲除細胞c-Met基因后細胞會死亡,所以本研究選擇可調控沉默c-Met基因的慢病毒載體系統進行后續實驗。在實驗中發現DOX濃度在0.4 μg/mL時c-Met沉默率可達80%左右,所以最終選擇DOX誘導濃度為0.4 μg/mL。適當敲除MDA-MB-231細胞c-Met基因后加入表阿霉素聯合作用,發現MDA-MB-231細胞的增殖明顯受到抑制,同時促進了細胞的凋亡。乳腺癌細胞對表阿霉素作用的IC50由4.92 μg/mL降至1.23 μg/mL,細胞增殖活性明顯降低,這與QUE等[17]的研究結果一致。同時適當沉默c-Met基因與表阿霉素聯合作用誘導細胞出現G1期阻滯,從而抑制細胞的增殖。這些結果或許說明針對腫瘤細胞中特定的原癌基因,調控其在腫瘤細胞中的表達,對于有效提高化療藥物對腫瘤細胞的細胞毒性具有重要作用。
本次研究結果也表明,適當沉默MDA-MB-231細胞c-Met基因表達聯合表阿霉素作用后,細胞中凋亡相關蛋白PARP和caspase-3表達水平增高。目前已經證實caspase-3及其底物PARP在細胞凋亡中起重要作用。當細胞DNA受損嚴重時可以激活caspase-3,從而介導細胞凋亡,此時PARP被caspase-3裂解。裂解的PARP切斷煙酰胺腺嘌呤二核苷酸(NAD+)合成時對三磷酸腺苷(ATP)的消耗,促使細胞凋亡的完成[17]。PARP常被用作細胞凋亡的指標。本研究中適當敲除c-Met后,MDA-MB-231細胞上調caspase-3和PARP表達,結果表明shRNA對c-Met基因適當敲除聯合表阿霉素引起caspase相關細胞凋亡,這可能是導致細胞活性下降的部分原因。這與QUE等[7]研究結果一致,該研究顯示shRNA靶向c-Met可誘發U266細胞caspase依賴性凋亡。本研究顯示,在pSD400-c-Met-shRNA-MDA-MB-231細胞(有DOX誘導組)中細胞增殖能力的下降與凋亡率的增加關系密切,并且細胞周期阻滯發生在G0/G1期。
腫瘤耐藥性是導致乳腺癌患者治療失敗和死亡的重要原因。在本研究中,下調c-Met表達可以增加乳腺癌細胞MDA-MB-231對表阿霉素的敏感性,表明c-Met可能是乳腺癌的輔助化療靶點。作者認為,除了MDA-MB-231細胞以外,本研究還應分析更多的乳腺癌細胞,以證實適當敲除c-Met基因對乳腺癌細胞增殖、侵襲的抑制作用,以及增加乳腺癌細胞對表阿霉素化療敏感性的作用。此外,除了研究下調c-Met對表阿霉素的化療敏感性外,還應分析其他化療藥物的化療敏感性。因此,適當敲除c-Met基因產生的抗癌作用有待進一步研究。

