白細胞介素-37與2型糖尿病腎臟病的相關性分析*
閆妮 李婧 劉玲嬌 林燕
(陜西省人民醫院 1. 風濕免疫科,2. 內分泌科,陜西 西安 710068)
2型糖尿病(Type 2 Diabetes mellitus,T2DM )是以慢性高血糖為特征的一組全身代謝性疾病。其具體發病機制尚未完全闡明,胰島素分泌缺陷和外周組織胰島素抵抗是其主要發病基礎[1]。近年來認為T2DM是一種“慢性低度炎癥狀態”,慢性炎癥及活化的免疫系統在T2DM的發病機制中起作用[2]。糖尿病腎臟病(Diabetic kidney disease,DKD)是糖尿病嚴重的微血管并發癥,是終末期腎功能衰竭的主要原因[3],我國約20%~40%的糖尿病患者合DKD[4]。近年大量研究[5-6]表明低水平的全身慢性炎癥是導致胰島素抵抗、肥胖、T2DM及其并發癥的潛在機制。而且炎癥反應在DKD的發生和發展中起關鍵作用[7]。許多炎癥細胞因子如IL-1、IL-6、IL-18、TNF-α等與DKD的發病密切相關[8]。白細胞介素-37(Interleukin-37,IL-37)是一種新型的天然抗炎細胞因子[9],已被證實參與多種自身免疫性疾病[10-13]、肥胖[14]、冠狀動脈粥樣硬化性心臟病[15]等的發生發展。然而IL-37在T2DM合并腎臟病中研究鮮少。本研究探討疾病不同階段IL-37濃度與DKD危險因素的相關性,分析其在T2DM合并DKD疾病中的作用。
1 資料和方法
1.1 一般資料 選取2018年12月~2019年12月于陜西省人民院內分泌科住院的T2DM患者228例,分為單純DM組(正常蛋白尿組,80例)和T2DM合并DKD組(DKD組,148例)。DKD組又分為早期DKD組和臨床DKD組。同時納入同期本院體檢中心年齡、性別匹配的60例健康者作為對照組。所有T2DM患者診斷均符合1999年WHO糖尿病診斷及分型標準。DKD診斷按2014年美國糖尿病協會(ADA)與美國腎臟病基金會(NKF)達成的共識,認為DKD是指由糖尿病引起的慢性腎病,主要包括腎小球濾過率(GFR)<60 mL·min-1·1.73 m-2或尿白蛋白/肌酐(UACR)>30 mg/g肌酐持續超過3個月。排除標準:1型糖尿病、糖尿病急性并發癥、急性痛風發作、妊娠、發熱、感染、惡性腫瘤、自身免疫性疾病、慢性炎癥性疾病、肝腎功能異常、冠心病、心功能不全、原發性腎小球及繼發性腎小球疾病的患者、近半年內有手術或創傷、以及任何原因服用糖皮質激素或免疫抑制劑的患者。本研究經醫院倫理委員會通過,所有參與者均簽署知情同意書。
白蛋白尿分期根據2012年KDIGO CKD分期,A1期UACR<30 mg/g肌酐,A2期UACR在30~300 mg/g肌酐,A3期UACR>300 mg/g肌酐。本研究根據患者的蛋白尿水平分為3組,正常蛋白尿組(單純DM組):UACR 在0~30 mg/g、微量白蛋白尿組(早期DKD組):UACR 在30~300 mg/g、大量白蛋白尿組(臨床DKD組):UACR>300 mg/g。
1.2 資料采集 收集所有病例的年齡、性別、病程、血壓、身高、體重,計算BMI。空腹抽取外周靜脈血,檢測尿素、肌酐、HDL-C、LDL-C、TG、糖化血紅蛋白A1c (HbA1c)。腎小球濾過率(GFR)采用慢性腎臟病流行病學協作組(CKD-EPI)公式計算估算的腎小球過濾率(eGFR)。收集晨尿及24 h尿液,檢測尿微量白蛋白(尿ALB)、尿α1微球蛋白(尿α1-MG)、尿β2微球蛋白(尿β2-MG)、尿微量白蛋白/尿肌酐比值(UACR)及尿蛋白總量。
1.3 IL-37檢測 收集所有入選患者及健康對照組者的靜脈血3 mL,將血液離心,并分別收集離心后的血清,置-80℃冰箱保存待檢。用酶聯免疫吸附試驗(ELISA)檢測血清IL-37水平。購買美國AdipoGen公司IL-37 (human) ELISA 試劑盒 (Cat. NO. AG-45A-0041YEK-K101),嚴格按照說明書操作。

2 結果
2.1 4組研究對象各臨床資料比較 4組在年齡、性別、血壓、血脂(TG、TC、HDL-C、LDL-C)方面差異無統計學意義(P>0.05)。然而BMI、HbA1C、FBG、SCre、BUN、eGFR、尿ALB、尿β2-MG、尿α1-MG在4組間差異均有統計學意義(P<0.05)。BUN、Scre、尿ALB、尿α1-MG、尿β2-MG均隨蛋白尿增加而增加,eGFR呈下降趨勢(均P<0.05)。進一步分析3組病例組之間實驗室檢查資料,發現早期DKD組和臨床DKD組患者eGFR 顯著低于單純DM組(P<0.001),臨床DKD組顯著低于早期DKD組(P=0.003);尿蛋白定量在臨床DKD組顯著高于單純DM組、早期DKD組(P<0.001);尿α1-MG在臨床DKD組顯著高于單純DM組(P=0.028);尿ALB在臨床DKD組顯著高于單純DM組及早期DKD組(P<0.001),早期DKD組顯著高于單純DM組(P<0.01);尿β2-MG在臨床DKD組均顯著高于單純DM組及早期DKD組(P<0.001);FBG在臨床DKD組顯著高于單純DM組(P=0.032),早期DKD組顯著高于單純DM組(P=0.031);HbA1C在臨床DKD組顯著高于單純DM組(P=0.039)。見表1。
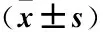
表1 4組研究對象臨床資料比較Table 1 Comparison of clinical data among the four groups
2.2 4組研究對象血清IL-37水平比較 ELISA法檢測4組研究對象IL-37血清濃度在對照組、單純DM組、早期DKD組及臨床DKD組分別為66.48±37.84 pg/mL、92.47±38.32 pg/mL、98.78±43.73 pg/mL、118.41±34.31 pg/mL。與對照組相比,單純DM組、早期DKD組及臨床DKD組患者血清IL-37蛋白水平均顯著升高(P<0.05);臨床DKD組患者血清IL-37較早期DKD組顯著升高,差異有統計學意義(t=2.056,P=0.043);早期DKD組患者血清IL-37濃度雖高于與單純DM組,但差異無統計學意義(t=0.641,P>0.05)。見圖1。
2.3 血清IL-37水平與各臨床指標的相關性 采用Spearman秩相關分析血清IL-37濃度與上述組間有統計學差異實驗室指標的相關性,結果顯示血清IL-37濃度與尿蛋白定量、尿ALB、尿α1-MG、尿β2-MG、HbA1C呈顯著正相關(均P<0.05),與eGFR呈顯著負相關(P<0.05),見表2。

表2 各項指標與血清IL-37水平的相關性分析Table 2 Correlation analysis of each index and serum IL-37 level
2.4 影響T2DM合并DKD的Logistics多因素回歸分析 以有無DKD為因變量,年齡、BMI、HbA1C、IL-37為自變量行二分類Logistics回歸分析。結果顯示:HbA1C和IL-37是影響T2DM合并DKD的主要因素。HbA1C是T2DM合并DKD的獨立危險因素(OR=2.745,95%CI:1.736-5.536,P=0.027),IL-37是其保護性因素(OR=0.822,95%CI:0.702-0.962,P=0.015)。
3 討論
DKD是最常見的糖尿病微血管并發癥,近年來隨著我國糖尿病患病率的增加,DKD的患病率逐年上升,我國DKD在終末期腎病(ESRD)中占16.4%[16],成為糖尿病患者的主要死亡原因。其發病機制較復雜,與多種因素有關,慢性炎癥反應是DKD發生發展的重要環節[17]。參與DKD炎癥反應的細胞不僅包括腎臟固有細胞(如腎小球內皮細胞、系膜細胞、足細胞、腎小管上皮細胞、成纖維細胞與間質細胞),還包括進入腎臟的外來細胞(如中性粒細胞、淋巴細胞、巨噬細胞等)[17]。上述細胞分泌細胞因子(包括促炎和抗炎細胞因子)通過復雜的細胞因子網絡共同參與DKD發病。機體中炎癥相關細胞及細胞因子可能會成為糖尿病及其并發癥的潛在治療靶點。
IL-37是新發現的IL-1家族(IL-1 family,IL-1F)第7個成員,也稱IL-1F7,是一種天然的免疫應答抑制物,能夠抑制多種炎癥因子的表達發揮顯著的抗炎效應。IL-37有5種亞型(IL-37a-e),其中IL-37b是IL-37最長的序列,也是其功能性亞型[18]。IL-37發揮抗炎作用主要有胞外和胞內兩種途徑:①胞外IL-37與其受體的結合主要有以下機制:胞外IL-37與IL-18受體α鏈(IL-18Rα)鏈結合繼之招募IL-1受體8(IL-1R8,主要包括TIR8/SIGIRR),后者可以作為“負性”附屬鏈激活抗炎反應[19];IL-37與IL-18結合蛋白(IL-18BP)結合,阻止IL-18Rα招募IL-18Rβ,以及后續的炎癥基因的轉錄。②IL-37能轉移到細胞內作為核轉錄的調節因子與Smad3相互作用,從而下調炎癥反應;也可以通過抑制信號傳導與轉錄活化因子(STAT)、絲裂原激活蛋白激酶(MAPK)p38α功能起到顯著抗炎的效應[9]。IL-37在生理狀態下表達極少,在某些誘因如炎癥狀態下,炎性因子如IFN-γ、IL-6、IL-1β能顯著上調IL-37表達。
最近眾多的研究已證實IL-37通過抑制炎癥參與了自身免疫性疾病如類風濕關節炎(RA)、系統性紅斑狼瘡(SLE)、炎癥性腸病(IBD)、以及代謝綜合征等的發生發展,發現上述疾病患者外周血清IL-37蛋白水平顯著高于正常對照,IL-37升高幅度與疾病嚴重度或活動性相關,對自身免疫病提供一定保護作用[10-14]。然而,IL-37與糖尿病及糖尿病相關并發癥的研究較少。本研究結果發現,IL-37蛋白在單純DM (正常蛋白尿組)、早期DKD (微量蛋白尿組)及臨床DKD組(大量蛋白尿組)患者血清中的濃度均顯著高于正常對照組,且在臨床DKD患者血清中濃度顯著高于早期DKD患者。這與彭晶[20]研究結果相一致,即IL-37在糖尿病腎病微量蛋白尿、大量蛋白尿組均顯著升高,血清升高的 IL-37可以作為DKD嚴重程度及預測預后的有效指標。還發現早期DKD組患者IL-37濃度雖高于單純DM組,但無統計學差異,這與彭晶的結論不相同,可能與樣本例數偏少及選擇糖尿病病程不同相關。此外,莫春艷[21]發現在T2DM合并增殖性糖尿病視網膜病變患者血清中IL-37顯著高表達,且隨著視網膜病情嚴重程度的增加IL-37表達增強。然而,Borzouei S等[22]發現在伊朗人群未治療的T2DM合并糖尿病腎病患者血清中IL-37表達顯著低于對照組,經過8個月的西格列汀單藥或西格列汀聯合維生素D3治療,T2DM合并糖尿病腎病患者血清中IL-37水平明顯升高,但具體機制尚未闡明。我們從血清蛋白層面說明體內IL-37水平與DKD蛋白尿相關,當T2DM患者腎臟出現微量或大量蛋白尿,體內炎癥水平增加,IL-37蛋白水平表達也隨之升高,從而抑制炎癥因子的產生,對糖尿病及DKD有保護作用。需要關注的是IL-37蛋白濃度在不同疾病或同種疾病不同實驗室情況下檢測結果也不同,推測造成這種差異的原因可能與檢測試劑盒、所選擇的檢測人群不同有關。
此外,Spearman相關分析發現IL-37濃度與尿蛋白定量、尿ALB、腎小管損傷指標(尿α1-MG、尿β2-MG)、HbA1C呈顯著正相關,與eGFR呈顯著負相關,部分結果與彭晶[20]研究相一致。Logistics回歸分析發現IL-37可能是T2DM并發DKD的保護性因素,HbA1C是T2DM合并DKD的危險因素。DKD危險因素包括糖尿病病程、高血糖、高血壓、血脂異常、超重、肥胖等。本研究結果發現血脂、血壓在單純DM、早期DKD及臨床DKD3組間比較無顯著性差異,推測與已接受降壓、降脂等藥物等因素有關;然而BMI在3組間比較存在統計學差異。本研究還發現HbA1C在單純DM組高于其他組,也可能是由于微量、大量蛋白尿組患者隨訪頻繁,血糖監測及降糖藥物使用依從性更好所致。Ballak DB[23]等發現表達人IL-37的轉基因鼠在高脂飲食喂養后,胰島素抵抗、血糖水平及脂肪浸潤均明顯改善,也支持IL-37對于T2DM有治療作用這一觀點。以上結果更近一步說明IL-37在糖尿病及DKD中起抗炎作用,可能成為治療T2DM及其并發癥的潛在靶點。
4 結論
本研究結果發現,T2DM合并DKD患者血清IL-37濃度升高,且與尿蛋白量及血糖控制相關,IL-37可能是DKD的保護因素。本研究進一步豐富了DKD的發病機制,IL-37可作為治療T2DM合并DKD的潛在新途徑。但DKD是多因素疾病,本次研究樣本量較小,仍需大樣本及體內外試驗進一步闡明IL-37在T2DM合并DKD中的具體作用機制。

