蘋小吉丁自然種群腸道微生物多樣性*
賈斐然 周忠福 趙文霞 孫薈荃 姚艷霞
(國家林業和草原局森林保護學重點實驗室 中國林業科學研究院森林生態環境與自然保護研究所 北京 100091)
新疆野蘋果(Malussieversii)也稱塞威氏蘋果,是第三紀孑遺植物,為現代栽培蘋果的祖先(林培鈞等, 2000); 在我國境內主要分布于新疆鞏留至新源的南部低山,霍城至伊寧的北部低山; 這些地區主要為1 200~1 600 m的陰坡、半陰坡以及河谷地帶,并與哈薩克斯坦中亞山地野蘋果林相連(李利平等, 2011)。然而,近年來,蘋小吉丁(Agrilusmali)(鞘翅目Coleoptera: 吉丁甲科Buprestidae)在新疆野蘋果林內暴發成災,導致新疆野蘋果損失慘重; 蘋小吉丁主要以幼蟲蛀食蘋果等薔薇科果樹的韌皮部、造成寄主枝條干枯,嚴重時使整株植物死亡(Bozorovetal., 2019; 崔志軍等, 2018; 王智勇, 2013; 周忠福等, 2020)。
為揭示蘋小吉丁成災機制,探討其在危害過程中腸道微生物可能產生的作用,本研究擬對蘋小吉丁腸道真菌和細菌多樣性開展研究。眾所周知,昆蟲體內棲息著大量的微生物,這些微生物主要以腸道菌群(gut microbiota)的形式定殖在消化道內(Dongetal., 2009),與宿主昆蟲在長期協同進化過程中形成了相互依存的共生關系,參與了昆蟲絕大多數的生命活動,對宿主的生長和發育具有重要作用(王四寶等, 2017),因此,在研究害蟲危害時,不僅要著眼于昆蟲本身,還要關注與之密切相關的腸道菌群。昆蟲腸道獨特的結構和理化性質為多種多樣的微生物定殖提供了特殊環境,腸道菌群組成與宿主昆蟲的生長發育、新陳代謝、繁殖、防御等生命活動密切相關(Brummeletal., 2004; Hosokawaetal., 2010; Kikuchietal., 2007); 這種相對穩定的關系對昆蟲整個生命周期具有極其重要的作用(張靜等, 2017): 一方面,腸道為菌群提供穩定的生存環境和必要的營養物質(Pangetal., 2016; Petersonetal., 2016),昆蟲腸道微環境可以影響腸道菌群結構和代謝活動,從而賦予腸道菌群種類多樣性和宿主特異性的特點(Kuraishietal.,2013); 另一方面,昆蟲腸道菌群參與調控宿主生長發育、營養代謝和環境適應性等諸多生物學過程,是調控宿主生物學性狀的重要調節因子(Douglas, 2015; Hammeretal., 2015)。
我國學者已初步開展了蘋小吉丁腸道微生物群落多樣性研究(Zhangetal., 2018; Bozorovetal., 2019),奠定了良好的基礎,然而,就目前的數據來看,蘋小吉丁腸道細菌群落較為復雜且多變,并未呈現較為一致的研究結果,而真菌群落研究較少。為此,本研究在前人的基礎上,通過Illumina MiSeq測序技術對真菌ITS基因和細菌16S rRNA基因進行分析,對我國新疆伊犁地區不同蟲期(幼蟲和成蟲)、不同環境條件(栽培果園和野果林)的蘋小吉丁自然種群腸道微生物群落多樣性進行研究,并運用PICRUSt2 軟件進行功能預測,以期為下一步探討蘋小吉丁腸道菌群功能提供科學數據。
1 材料與方法
1.1 試驗樣地
新疆伊犁自治州鞏留縣受蘋小吉丁危害較為嚴重,因此本研究選擇在受害最為嚴重的新疆野果林和人工栽培蘋果(M.pumila)園內設置樣地,每個樣地大小為100 m×100 m。
1.2 試驗材料
1.2.1 蘋小吉丁幼蟲取樣方法 在蘋小吉丁幼蟲出蟄危害季節于樣地中隨機選取30枝帶蟲枝條作為試驗樣品(表1)。將樣品帶回實驗室后在無菌條件下解剖枝條,剝取幼蟲放入-80 ℃冰箱備用。
1.2.2 蘋小吉丁成蟲的取樣方法 在成蟲羽化高峰期使用捕蟲網,在樣地內捕捉成蟲,將樣地內的成蟲分別放入貼有標簽的收集管中,再放入有冰袋的冰盒內立即帶回實驗室,隨后將成蟲放入-80 ℃冰箱備用。
1.2.3 腸道獲取 將保存于-80 ℃冰箱的蘋小吉丁取出,隨后用75%的酒精對蟲體表面消毒3次,每次1 min,再用無菌水清洗3遍。將體式解剖鏡置于超凈工作臺中,與超凈工作臺一起紫外滅菌20 min,用已滅菌的鑷子和解剖針在PBS緩沖液中解剖蟲體,分離出腸道,將腸道置于已滅菌的2 mL離心管中,如表1編號。

表1 蘋小吉丁樣品信息①Tab.1 Sample information of Agrilus mali
1.3 DNA提取和PCR擴增
使用DNeasy Blood & Tissue Kit(Qiagen,Hilden,德國)試劑盒、參照說明書提取蘋小吉丁腸道總DNA。以該總DNA為模板,分別以通用引物對333F/806R(5′-ACTCCTACGGGAGG CAGCAG-3′; 5′-GGACTACHVGGGTWTCTAAT-3′)和FITS7/RITS4(5′-GTGARTCATCGAATCTTTG-3′; 5′-TCCTCCGCTTATTGATATGC-3′)擴增真菌ITS2區域(Blaalidetal., 2013)和細菌16S rRNA V3+V4 區域(張軍毅等, 2015)。PCR擴增體系總體積均為50 μL: DNA模板2 μL,TransStartTaq DNA Polymerase 0.5 μL,10×Buffer 5 μL,引物338F/806R(10 mmol·L-1)各1 μL,dNTPs(各2.5 mmol·L-1)4 μL,ddH2O 36.5 μL。PCR擴增條件: 94 ℃預變性5 min; 94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸45 s,35個循環; 72 ℃延伸 10 min。PCR擴增反應重復3次,PCR擴增產物合并后經1%瓊脂糖凝膠電泳檢測,隨后采用Illumina MiSeqPE300測序平臺進行雙端測序。
1.4 高通量測序數據分析
MiSeq測序完成后,對獲得的原始序列(raw reads)進行質量控制,舍棄低質量序列(50個連續堿基平均質量<25,序列長度<50bp,模糊堿基≥1)。運用Flash V1.0.3軟件將雙端數據進行拼接,去除嵌合體,剔除宿主自身、葉綠體和線粒體序列后,獲得優質序列(clean reads)數據。用軟件QIIME對優質序列在97%水平上進行操作分類單元(operational taxonomic unit,OTU)聚類,并利用Silva和UNITE數據庫分別對1.3節擴增獲得的蘋小吉丁腸道真菌ITS和細菌16S rRNA序列進行物種注釋。基于OTU的統計結果,利用Mothur軟件計算Alpha多樣性指數,用于反映樣本內菌群的多樣性。本研究選取Shannon、Simpson、Ace、Chao、coverage 5 個常用指數來分析蘋小吉丁腸道菌群的多樣性。Chao和Ace指數反映樣品中群落豐富度,二者數值越大,表示樣品中群落豐富度越高; Shannon指數和Simpson指數反映樣品中物種多樣性,Shannon指數越高,Simpson指數越小,說明樣品中的物種多樣性越高; coverage常用在微生物16S/18S/ITS測序中,作為反映測序深度的指標。其值越接近于1,說明測序深度越合理,測序深度已經基本覆蓋到樣品中所有的物種。
1.5 PICRUSt2功能預測
利用PICRUSt2軟件進行ITS和16S rRNA基因數據功能預測,將測序樣品中的基因數據通過EC基因家族到途徑的結構化映射,在PICRUSt2中計算出COG、KO的豐度信息和MetaCyc途徑的豐度。
2 結果與分析
2.1 序列拼接組裝與OTU聚類分析
蘋小吉丁成蟲腸道真菌ITS2與細菌16S rRNA高通量測序質控拼接后共獲得OTU分別為285和1 470個(表2)。從不同蟲態來看: 蘋小吉丁幼蟲腸道真菌和細菌OTU數均大于成蟲腸道; 從不同寄主來看: 新疆野蘋果蘋小吉丁腸道真菌OTU數大于栽培蘋果蘋小吉丁腸道,而細菌則相反。
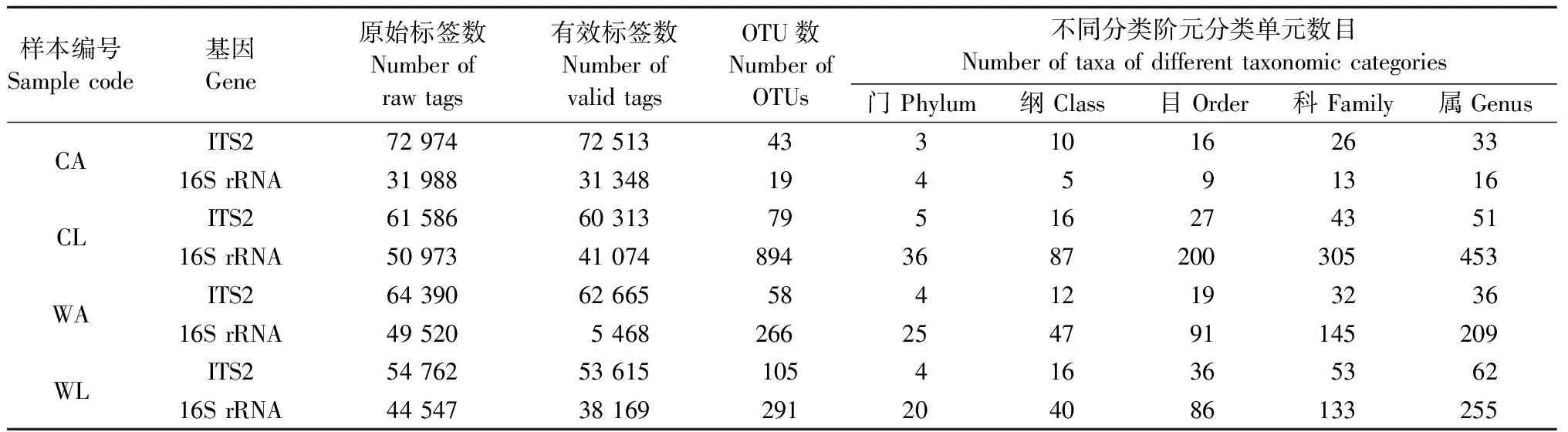
表2 不同寄主不同蟲態蘋小吉丁腸道真菌ITS2和細菌16S rRNA高通量測序基本信息Tab.2 Basic information of high-throughput sequencing of fungal ITS2 and bacterial 16S rRNA in gut of A. mali with different hosts and stages
2.2 蘋小吉丁腸道真菌和細菌鑒定
通過序列比對,共鑒定真菌5門22綱50目92科和122屬,細菌40門103綱231目364科和594屬。其中真菌主要隸屬于3門,即擔子菌門(Basidiomycete)、子囊菌門(Ascomycota)、被孢霉門(Mortierellomycota),12綱,即座囊菌綱(Dothideomycetes)、糞殼菌綱(Sordariomycetes)、銀耳綱(Tremellomycetes)、散囊菌綱(Eurotiomycetes)、傘菌綱(Agaricomycetes)、囊擔子菌綱(Cystobasidiomycetes)、酵母綱(Saccharomycetes)、子囊菌綱(Ascomycota)、錘舌菌綱(Leotiomycetes)、圓盤菌綱(Orbiliomycetes)、擔子菌綱(Basidiomycota)、傘形束梗孢菌綱(Agaricostibomycetes); 細菌主要隸屬于7門,即變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、放線菌門(Actinobacteria)、Bacteroidota、Patescibacteria、綠彎菌門(Chloroflexi)、疣微菌綱(Verrucomicrobiota),11綱,即γ-變形菌綱(Gammaproteobacteria)、放線菌綱(Actinobacteria)、梭菌綱(Clostridia)、擬桿菌綱(Bacteroidia)、α-變形菌(Alphaproteobacteria)、芽孢桿菌綱(Bacilli)、纖細菌綱(Gracilibacteria)、厭氧繩菌綱(Anaerolineae)、儉菌總門未確定綱(Parcubacteria)、疣微菌綱(Verrucomicrobiae); 其中,γ-變形菌綱、放線菌綱、α-變形菌綱、芽孢桿菌綱、座囊菌綱、糞殼菌綱、銀耳綱在每個樣品中均有分布(圖1)。

圖1 蘋小吉丁腸道真菌和細菌組成(綱級分類階元)Fig. 1 Gut microbiota composition of Agrilus mali (at the class level)
2.3 腸道細菌和真菌Alpha多樣性分析
Alpha多樣性分析結果表明(表3),測序深度基本覆蓋到樣品中所有的物種,已獲得的測序數據量足以覆蓋蘋小吉丁腸道大多數微生物類群; 野果林蘋小吉丁腸道真菌群落豐富度和物種多樣性成蟲均大于幼蟲,而細菌群落豐富度成蟲小于幼蟲,但物種多樣性成蟲卻大于幼蟲,說明在蘋小吉丁不同的發育階段,腸道微生物群落變化較大,此外,蘋小吉丁幼蟲腸道微生物群落和物種多樣性在栽培果園遠大于野果林。
2.4 不同蟲態、不同環境蘋小吉丁腸道細菌和真菌的差異性
從屬級分類階元來看,不同蟲態、不同環境蘋小吉丁腸道細菌和真菌組成存在差異,其中CA特有真菌11屬,特有細菌2屬; CL特有真菌28屬,特有細菌223屬; WA特有真菌37屬,特有細菌47屬; WL特有真菌12屬,特有細菌68屬。而在4組樣品的核心菌群中,真菌7屬,細菌21屬(圖2),其中共有真菌為枝孢菌屬(Cladosporium)、Cutaneotrichosporon、籃狀菌屬(Talaromyces)、曲霉菌屬(Aspergillus)、青霉菌屬(Penicillium)、假絲酵母屬(Candida)、頂孢霉菌屬(Acremonium);可供比對的 共有細菌為腸桿菌屬(Enterobacter)、隆布次氏菌屬(Romboutsia)、梭狀芽孢桿菌屬(Clostridium)、乳酸桿菌屬(Lactobacillus)、纖維單胞菌屬(Cellulomonas)、鞘氨醇單胞菌屬(Sphingomonas)、副球菌屬(Paracoccus)、拉爾斯通氏菌屬(Ralstonia)、諾卡氏菌屬(Nocardioides)、微桿菌屬(Microbacterium)、鼠李桿菌屬(Rathayibacter)、曲棍桿菌屬(Curtobacterium)、漆螺科未確定屬(Lachnospiraceae)、伯克霍爾德菌屬(Burkholderia)、假單胞菌屬(Pseudomonas)、擬黑桿菌屬(Paeniglutamicibacter)、擬桿菌屬(Planomicrobium)、泛菌屬(Pantoea)、需氧菌屬(Aeromicrobium)。
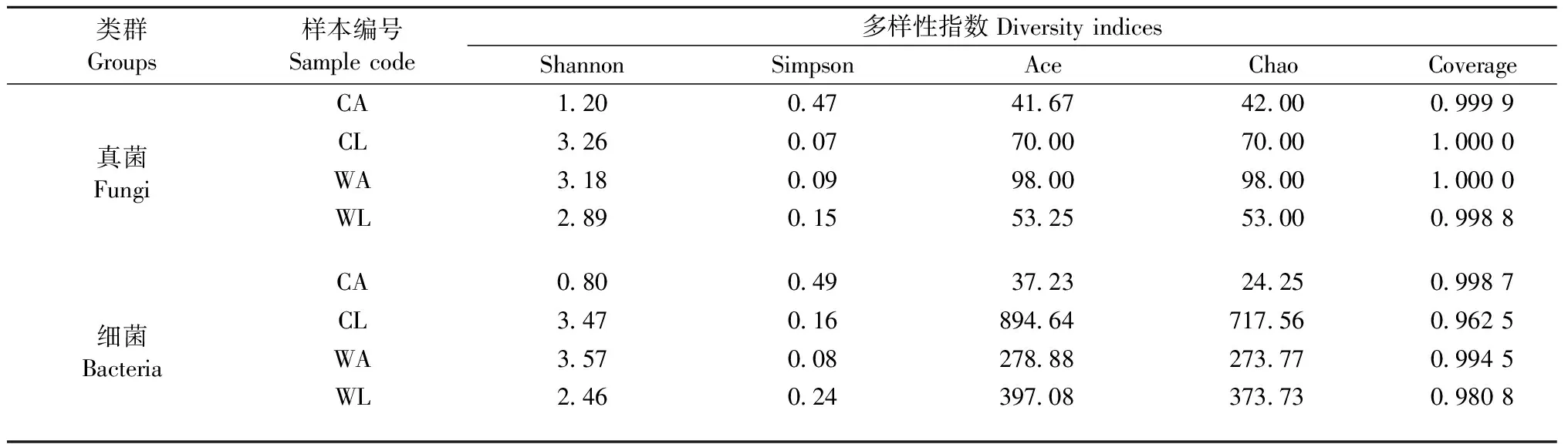
表3 不同寄主不同蟲態蘋小吉丁腸道內真菌和細菌多樣性指數統計Tab.3 Diversity indices of fungi and bacteria in gut of A. mali at different hosts and stages

圖2 腸道真菌和細菌維恩圖Fig. 2 Venn diagram of gut fungi and bacteria
2.5 PICRUSt2功能預測
通過COG功能預測獲得蘋小吉丁腸道細菌總共擁有23個功能(圖3),并且野果林蘋小吉丁腸道細菌擁有的功能總體比栽培果園蘋小吉丁腸道細菌的高(表4); 通過MetaCyc代謝途徑分析,共注釋到74條真菌代謝通路,426條細菌代謝通路,并且各樣品之間代謝通路Top20豐度存在一定差異(圖4、5),其中,栽培蘋果蘋小吉丁腸道真菌代謝通路數量遠大于野蘋果蘋小吉丁腸道真菌代謝通路數量,且成蟲腸道真菌代謝通路數量大于幼蟲腸道真菌代謝通路數量,這可能與寄主和環境有關; 通過KEGG代謝途徑分析,共注釋到871條真菌代謝通路,426條細菌代謝通路。同時,酶功能熱圖(Enzyme Heatmap)顯示各樣品之間酶的豐度存在較大差異(圖6),并且成蟲腸道真菌酶的豐度明顯多于幼蟲,而細菌則相反,成蟲酶的豐度小于幼蟲,說明蘋小吉丁腸道真菌對成蟲生長發育具有重要作用,而腸道細菌則對幼蟲生長發育起著關鍵性作用。

圖3 腸道細菌COG功能基因預測Fig. 3 Prediction of COG functional gene in gut bacteria

表4 不同寄主不同蟲態蘋小吉丁腸道內COG預測功能類別占比Tab.4 The proportion of COG prediction function categories in gut of A. mali with different hosts and stages

續表 Continued

圖4 腸道真菌MetaCyc代謝途徑Top 20豐度統計Fig. 4 Top 20 MetaCyc pathway of abundance for the gut fungus
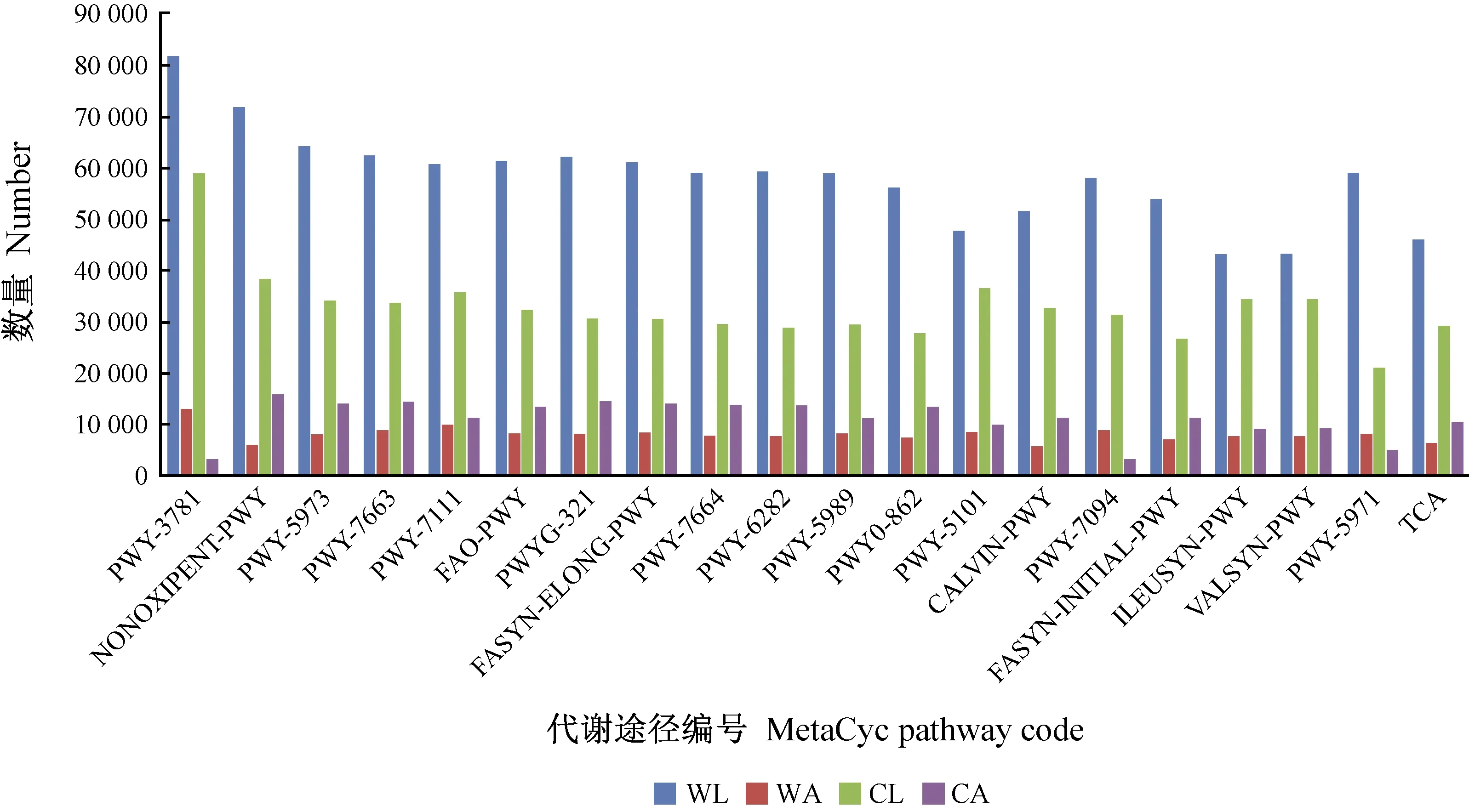
圖5 腸道細菌MetaCyc代謝途徑Top 20豐度統計Fig. 5 Abundance statistics of gut bacteria MetaCyc pathway Top 20
3 討論
3.1 序列拼接組裝與OTU聚類分析
從獲得的OTU數量來看,蘋小吉丁腸道細菌CA遠小于其他3個組(CL、WA和WL),推測可能的原因是: 取樣時CL、WA、WL來自新鮮蟲體,而CA蟲體曾保存在液氮中3個月,CA腸道部分細菌已降解; 但是真菌CA與其他組差異不大,說明真菌并未受樣品的影響。此外,蘋小吉丁幼蟲腸道真菌和細菌OTU數量均大于成蟲,這可能是由于昆蟲腸道結構不同所導致,也可能與取食寄主植物成份有關,蘋小吉丁幼蟲取食韌皮部,而成蟲取食葉片,不同的飲食導致腸道產生不同的生化反應從而形成出不同的微生物群落,類似的結果在大頭金蠅(Chrysomyamegacephala)和蜣螂(Coprisincertus)中有過報道(Wangetal., 2018; Surez-Mooetal., 2020),并且,已證實食木昆蟲腸道細菌豐富(Engeletal., 2013),因此,細菌為蘋小吉丁幼蟲腸道微生物的優勢種。同時,昆蟲腸道細菌與真菌之間具有復雜的相互作用(Zhangetal., 2018),細菌可以促進真菌的生長(Briardetal., 2016),待成蟲羽化后,其食物發生了改變,細菌不再是優勢菌群,真菌也出現了相應的變化。再者,造成野蘋果和栽培蘋果蘋小吉丁腸道菌群OTU數量上的差異,可能與寄主有關,也可能與人為干擾有關,野果林有放牧活動,而栽培果園林下種植苜蓿(Medicago),定期割除,對此,還需更多的數據支持方可進一步探討。
3.2 蘋小吉丁腸道細菌和真菌鑒定及多樣性研究
在腸道核心真菌類群中,本研究與Zhang 等(2018)所報道的曲霉菌屬、枝孢菌屬、假絲酵母屬、青霉菌屬所相同,其中念珠菌屬、曲霉菌屬及青霉菌都為常見的致病菌,本研究測得的頂孢霉菌屬、Cutaneotrichosporon和曲霉菌屬為核心真菌類群未見報道,同時本研究核心菌群不包括Zhang等報道的隱球菌屬、莖點霉屬、鐮刀菌屬和節擔菌屬真菌,莖點霉屬和鐮刀菌屬的很多種類是植物致病菌(楊文等, 2016; Chengetal., 2019),并且鐮刀菌屬是蘋小吉丁伴生菌的主要類群(周忠福等, 2020)。腸道微生物群落的不同可能是由于捕捉蘋小吉丁的地點不同,其寄主品種出現了差異所致(Colmanetal., 2012)。本研究結果腸道細菌中有3門4綱,與Bozorov等(2019)研究結果一致,即變形菌門、厚壁菌門、放線菌門和γ-變形菌綱、放線菌綱、梭菌綱、芽孢桿菌綱,并且在細菌Top 20屬都存在泛菌屬和假單胞菌屬,泛菌屬對蘋小吉丁纖維素分解具有重要作用(Bozorovetal., 2019),該菌也是本研究中4個樣品的共有菌群,而Zhang 等(2018)在研究蘋小吉丁腸道細菌時未報道存在該細菌,說明在一定的條件下,泛菌屬細菌可能對蘋小吉丁纖維素分解起到一定作用,但是否與蘋小吉丁形成共生關系需進一步研究; 而假單胞菌屬細菌由于其具有能固定穿入組織、產生彈力應蛋白和具有粘連活性等特性,常被作為潛在的致病菌(錢伯欽,1986),可引起植物立枯病的勞爾氏菌屬(Ralstonia)(林海云等, 2011)和引起的植物病害發生率位居十大細菌性植物病害之首的假單胞菌屬(王丹丹等, 2017)同樣也在蘋小吉丁腸道細菌Top 20中存在。 總體而言,蘋小吉丁腸道中細菌和真菌都有較多的植物致病菌,但蘋小吉丁與致病菌是否存在協同作用共同危害寄主植物也需進一步研究。
此外,本研究在蘋小吉丁成蟲和幼蟲腸道中均發現大量厚壁菌門細菌,其在宿主的物質和能量代謝過程中起著非常重要的作用,并且其對食物的消化起著重要作用(Hongetal., 2011; Ruthetal., 2008)。蘋小吉丁幼蟲以蘋果枝條韌皮部為食,其中含有大量的纖維素和半纖維素組分,食物中纖維素和半纖維素在蘋小吉丁腸道內首先被這些厚壁菌門的細菌所分解,分解產物進而被其他細菌利用,如梭菌綱細菌和擬桿菌綱細菌在丁酸的生成中起著非常重要的作用(Zhuetal., 2011),因此推測這些細菌都參與了蘋小吉丁腸道內食物的消化過程。同時,筆者在蘋小吉丁腸道中的共有菌群檢測到了乳桿菌屬細菌,該屬細菌還具有合成碳水化合物降解酶(糖苷水解酶、果膠降解酶、多糖水解酶)的能力,由此推測其與蘋小吉丁的營養代謝有關(張筠等, 2009),也曾有報道該屬對腸黏膜具有很強的黏附能力,具有拮抗有害菌定植、減少腸道疾病發生和改善腸道菌群分布的能力; 并且能產生廣譜抗菌物質,廣泛且有效的抑制細菌、酵母、真菌和病原蟲等的生長,對昆蟲提高免疫力方面發揮著重要的作用(Olofssonetal., 2008; Pangetal., 2011)。另外,目前也有報道稱乳桿菌屬細菌對昆蟲抗藥性具有一定作用,并且蘋小吉丁腸道的共有菌群中還發現了伯克霍爾德菌屬細菌,可能參與有毒物質解毒過程的細菌(Xiaetal., 2013),但這些腸道菌與蘋小吉丁是否具備抗藥性以及與其抗藥性的產生是否相關需要進一步驗證。
3.3 不同蟲態不同環境的蘋小吉丁腸道微生物的差異性
本研究4組不同樣本中均存在枝孢菌屬、籃狀菌屬、曲霉菌屬、青霉菌屬等7屬真菌和腸桿菌屬、乳酸桿菌屬、伯克霍爾德菌屬等21屬細菌,這些真菌和細菌可能與蘋小吉丁建立了某種共生關系,對蘋小吉丁具有非常重要的生理功能,這些功能有待進一步深入研究。
昆蟲從幼蟲到成蟲形態會發生變化,消化道的結構和物理化學性質出現了較大的差異,對于食物的攝取表現出較大的不同。盡管昆蟲達到成蟲階段前的多次蛻皮過程中,前腸或后腸壁會逐漸形成適于細菌定殖的表面結構,有些腸道微生物可以保留下來,然而,腸道微生物群落結構仍然受到了影響(曹樂等, 2018)。本研究從Alpha多樣性分析結果來看,野果林蘋小吉丁腸道真菌群落豐富度和物種多樣性成蟲大于幼蟲,說明成蟲腸道真菌種類多而且均勻度好,和Zhang等(2018)的研究結果一致; 對于野果林蘋小吉丁腸道細菌群落而言,豐富度成蟲小于幼蟲,但物種多樣性成蟲卻大于幼蟲,說明細菌在幼蟲腸道中種類較多,但是各個種類的數量分布并不均勻,存在明顯的優勢類群,這在許多昆蟲腸道微生物研究中得到證實(Tsuchida, 2002; 黃勝威, 2012; Engeletal., 2013; Zhangetal, 2018; 王爭艷等, 2020)。
此外,蘋小吉丁幼蟲腸道真菌和細菌群落豐富度和物種多樣性在栽培果園大于野果林,這應該與寄主存在密切關系,蘋小吉丁在栽培果園取食蘋果樹,而在野果林取食新疆野蘋果樹。Zhang等(2018)曾發現喂食蘋果葉片會使蘋小吉丁成蟲腸道微生物Alpha多樣性升高。可見,即使同屬不同種之間的寄主差異也可以引起昆蟲腸道微生物群落發生變化。
3.4 PICRUSt2功能預測
PICRUSt2分析通過與數據庫比對,將微生物的多樣性情況與功能聯系起來。對比發現,在不同樣品中腸道微生物種類和豐度雖有較大的差別,但其功能大致相同,所以推測在蘋小吉丁腸道中發揮功能的為一固定類群,可能是其與宿主長期協同進化的結果。從圖6可以看出,細菌注釋到Enzyme功能幼蟲腸道中的豐度明顯多于成蟲,而真菌注釋到Enzyme功能成蟲腸道中的豐度明顯多于幼蟲,推測其與不同發育階段固有的飲食特殊化和個體發育特征有關(Shuklaetal., 2016)。細菌群落中纖維素分解細菌包括假單胞菌屬都在以蘋果樹的形成層和韌皮部為食的幼蟲腸道中更為豐富,并且在取食不同食物葉片的成蟲之間的細菌群落相似(Zhangetal., 2018),因此其功能未發生大的改變,只是有所降低; 相比之下,真菌群落更容易受到不同食物的影響,許多昆蟲腸道真菌都來自于周圍環境,包括食物的葉子表面(Zhangetal., 2018),所以成蟲取食葉片后,腸道中真菌數量增加,從而的整體功能呈現增加的變化。
4 結論
不同蟲態、不同環境蘋小吉丁腸道真菌和細菌種類和豐度存在差異,腸道真菌種類和豐度成蟲大于幼蟲,而細菌幼蟲大于成蟲,說明真菌對于成蟲的生長發育起著關鍵性作用,而細菌對于幼蟲的生長發育起著關鍵性作用。此外,不同的腸道微生物結構與組成,呈現出大致相同的功能,因此推測在蘋小吉丁腸道中發揮功能的為一些固定類群,這可能是與其宿主長期協同進化的結果。

