出口梗阻型便秘病人的差異表達蛋白及其生物學功能-基于同位素標記相對和絕對定量的蛋白質組學研究
李文哲 萬松林 劉韋成 吳云華 江從慶 錢群
我國慢性便秘(chronic constipation,CC)患病率近年來明顯上升,已經成為影響人們生活質量的一個重要因素[1]。據統計慢性便秘發病率達20%,在我國成人慢性便秘患病率為4%~6%,但是60歲以上人群慢性便秘患病率可高達22%[1]。慢性便秘主要類型為出口梗阻型便秘(obstructed defecation syndrome,ODS),臨床表現為排便困難,排便過程肛門堵塞[2]。導致ODS的解剖學改變主要為直腸內脫垂,直腸前突等。雖然目前針對ODS治療的方法較多,但臨床療效并不確切[1-2]。目前已有便秘治療一線方案對這類慢性便秘主要類型治療效果欠佳[3]。通過手術治療短期效果尚可,但是存在急便感等并發癥,影響病人術后滿意度。隨著隨訪時間延長,便秘復發比例增加。目前ODS治療對于臨床醫生仍然是挑戰[1,4-5]。我們采用同位素標記相對和絕對定量(isobaric tags for relative and absolute quantification,iTRAQ) 技術,比較ODS病人與相應非便秘病人手術切除直腸標本中的差異蛋白譜,以了解ODS病人存在解剖學改變直腸蛋白質組表達差異。
對象與方法
一、對象
我院結直腸肛門外科2016年1~5月間收治直腸內脫垂/直腸前突導致出口梗阻型便秘病人20例,年齡31~82歲,平均年齡(62.3±15.3)歲。納入標準:診斷均符合羅馬Ⅳ便秘診斷標準[6]。排除標準:合并子宮陰道脫垂;合并直腸肛管炎癥性疾病;盆底痙攣綜合征或者恥骨直腸肌肥厚導致便秘;合并肛門直腸狹窄;合并慢傳輸便秘、腸易激綜合征、炎癥性腸病;合并精神疾病或者拒絕手術;合并肛門失禁。同期選取與入組病人的年齡、性別匹配的混合痔Ⅳ度脫垂病人10例,年齡29~88歲,平均(60.1±15.1)歲。所有病人均采用經肛門吻合器直腸切除術并收集手術切除直腸標本,術前完成慢傳輸試驗,排糞造影,結腸鏡檢查。本研究經武漢大學中南醫院醫學倫理委員會批準(No.2015048),中國臨床試驗注冊中心臨床研究注冊(No.ChiCTRORN-16007696),所有研究對象均簽署知情同意書。
二、方法
1.實驗方法:所有收集ODS組以及混合痔組切除直腸標本用預冷的PBS清洗;液氮充分研磨,將研磨后的粉末轉移至離心管中。加入適量的lysis buffer(含有終濃度1% PMSF 的PBS溶液),冰浴超聲5分鐘;4 ℃,12 000 g離心10分鐘,取上清;加等體積的100%乙腈溶液,混合均勻,冰上放置1小時;沉淀完成后10 000 g離心10分鐘,取除沉淀外的所有上清液;冷凍抽干至體積縮小一半后,用預先潤濕的10 kD超濾管10 000 g,4 ℃離心20分鐘,然后用200 μl超純水重復上述操作,收集穿透液,加入1%的甲酸調pH至2~3。在-80 ℃下保存待測。共分為2組進行實驗,包括ODS組、對照組(混合痔組),各自將組內所有樣本進行混合。取適量樣本用Bradford法進行蛋白定量,根據標準曲線和蛋白樣品稀釋倍數計算出蛋白濃度,進行酶解除鹽,iTRAQ標記后進行肽段組分分離,最后進行液相色譜-多級質譜聯用分析。
2.生物信息分析:為了研究所鑒定蛋白的生理功能,我們將上述鑒定的顯著差異表達蛋白和NR動物庫進行blast比對,然后借助blast2go軟件將蛋白映射到基因本體論(GO),從而實現蛋白的GO功能注釋和富集分析;為了研究所鑒定的顯著差異蛋白可能參與的通路途徑,我們使用京都基因與基因組百科全書 Pathway數據庫進行通路富集分析。GO富集分析和KEGG Pathway富集分析均采用費舍爾精確檢驗,并認為P-value≤0.05作為顯著富集的功能條目。我們采用軟件信號肽(SignalP)4.0進行蛋白的信號肽預測,最后根據軟件的Dmax得分來評估蛋白是否含有信號肽區及信號肽區域,結果以Dmax為0.45作為閾值,大于0.45則認為蛋白含信號肽區域。
結果
1.質量檢測:電泳結果顯示總蛋白提取質量較好,總量足夠,各組樣本分離情況佳且基本相同,見圖1;色譜-質譜分析中,肽段長度整體集中在10aa附近,表明酶解正常,質譜性能穩定,見圖2,可進行下一步實驗。

注:1、2分別為ODS組、混合痔組,M為電泳條帶標志物。圖1 兩組樣本SDS-PAGE 電泳圖

圖2 肽段長度分布圖
2.質譜數據檢測結果:共采集到153 332張二級譜圖,其中有52 560張得以解析,共對應29 455種肽段,匹配到3 122種蛋白group。
3.生物信息學分析結果:(1)定量分析:質譜下機數據通過ProteinPilot V4.5(AB SCIEX,USA)與Uniprot人屬蛋白數據庫進行匹配分析,按照Unused得分在1.3以上匹配結果進行篩選,從質譜數據中匹配上29 455個肽段,共3 122個蛋白,部分信息見表1。(2)差異分析:本研究根據蛋白質組學定量結果,在ODS組:混合痔組中,通過控制篩選中標準差異系數(Fold Change,FC)和矯正后的假定概率(Adjust.P value,adj.P)的閾值來實現差異篩選。本研究使用的篩選閾值為FC≥1.5或FC≤0.667及adj.P≤0.05,共篩選出了164個顯著差異的蛋白(上調蛋白88種,下調蛋白76種)。見圖3。(3)GO分析:對ODS組以及混合痔組相比的164種差異表達蛋白進行GO功能分類,涉及20種生物學過程、3種細胞組分和15種分子功能。其中,生物過程包括細胞進程(154種差異蛋白)、生物調節(129種差異蛋白)、代謝過程(88種差異蛋白)、刺激反應(75種差異表達蛋白)、運動(23種差異蛋白)、免疫系統過程(34種差異表達蛋白)、行為(6種差異表達蛋白)、生長(6種差異表達蛋白)等,分子功能主要表現為結合(157種差異表達蛋白)、催化活性(56種差異表達蛋白)、結構分子活性(35差異表達蛋白)、運輸活性(14種差異表達蛋白)、抗氧化活性(8種差異蛋白)等,細胞組分主要為細胞解剖實體(163種差異表達蛋白)、含蛋白復合體(74種差異表達蛋白)、病毒組件(1種差異表達蛋白)等,見圖4。(4)KEGG通路分析:對ODS組以及混合痔組比較的差異表達蛋白經過KEGG Pathway注釋,共涉216條條通路,包括代謝通路(27種差異表達蛋白)、糖尿病性心肌病(13種差異表達蛋白)、阿爾茨海默病(10種差異表達蛋白)、血小板激活(10種差異表達蛋白)等,特別地,注釋到較多神經性相關疾病的通路,見圖5。(5)SignalP分析:為了研究可能的信號肽,我們使用SignalP 4.0進行蛋白的信號肽預測。

表1 Unused得分排名前5的蛋白結果
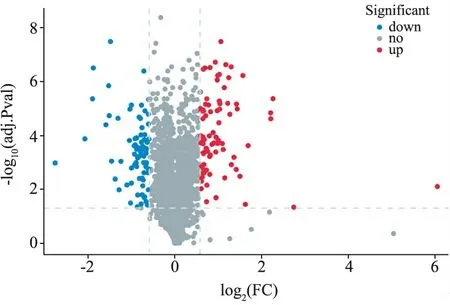
圖3 差異蛋白火山圖

圖4 差異蛋白GO注釋
在164種差異蛋白中,我們預測到有42種蛋白可能是信號肽,如基質金屬蛋白酶(MMP9,在細胞外基質的局部蛋白水解和白細胞遷移中起重要作用)、IGKV3-20(免疫球蛋白輕鏈可變區域的V區,參與抗原識別)、DEFA3(防御素2和防御素3具有抗生素、殺菌劑和抗病毒活性)等。(6)PPI互作分析:在針對差異蛋白的GO,KEGG注釋結果中,我們發現許多神經調控通路以及神經疾病相關的蛋白都出現了顯著的上下調差異。為了尋找神經調控與ODS之間可能存在的潛在聯系,在注釋結果中我們篩選出了兩個在功能注釋中明顯富集的通路negative regulation of neuron apoptotic process(GO-biological process)和Neurodegenerative disease(KEGG),共24個蛋白進行了蛋白互作分析(protein-protein interaction,PPI),見圖6,其中紅色為上調蛋白,藍色為下調蛋白,灰色為通路名。
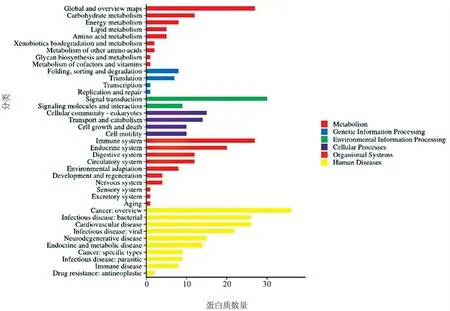
圖5 差異蛋白KEGG Pathway注釋結果

圖6 PPI互作分析結果
討論
直腸內脫垂、直腸前突是導致ODS癥狀主要解剖學異常。目前,臨床對ODS病人一線治療方案主要為飲食調節、常規瀉劑、生物反饋等行保守治療,但療效并不確切[1-2]。保守治療無效病人需要手術切除直腸內脫垂、直腸前突部分恢復正常解剖學結構。手術治療的短期療效尚可,但隨著手術時間推移,病人便秘癥狀多再次出現[1,3-5]。因此,存在相當數量ODS病人經過保守甚至手術治療后依然需要瀉劑等輔助排便。
基于質譜的高通量蛋白質組學是研究大規模蛋白質表征的核心技術,是一個多組學研究領域,旨在有效整合基因組學、轉錄組學和蛋白質組學。通過這種方法,可以識別可能對疾病發展,特別是新的病人特異性蛋白形式。通過蛋白質組學能夠更好地解釋疾病的分子機制,識別病人特異性蛋白質形式并更好地了解疾病的分子機制,進而為精準和個性化醫療開辟道路[7-8]。
目前,在外科研究領域,蛋白質組學研究主要集中在腫瘤相關疾病,對于功能性疾病蛋白質組學研究較少,對于ODS的蛋白質組學研究尚鮮見報道[9-10]。iTRAQ 蛋白質組學技術作為一種新的蛋白質定量技術,能夠提供有關疾病對蛋白質改變影響的信息,可以同時篩查疾病中幾乎全部蛋白質的改變,以及對疾病治療所涉及的潛在機制和途徑的深入了解,從而發現致病過程中的關鍵蛋白質分子[11]。
我們利用iTRAQ技術分析ODS組以及混合痔組病人組織標本中差異蛋白的表達譜,結果顯示,ODS組與混合痔組比較,88種蛋白質表達水平升高,76種蛋白質表達水平降低。ODS組以及混合痔組之間的差異表達蛋白中,共涉及216條通路,包括代謝通路(27種差異表達蛋白)、糖尿病性心肌病(13種差異表達蛋白)、阿爾茨海默病(10種差異表達蛋白)、血小板激活(10種差異表達蛋白)等,特別地,注釋到較多神經性相關疾病的通路,具有臨床意義。
線粒體是細胞進行有氧呼吸的主要場所,為細胞的生命活動提供能量,在細胞能量代謝、維持氧化還原平衡和調節細胞凋亡中起著重要作用[12]。線粒體功能障礙在多種疾病過程中發揮重要作用,如神經系統疾病、腎臟疾病、肝臟疾病、心血管疾病、癌癥等[13-15]。線粒體呼吸鏈是線粒體的主要功能單元,線粒體呼吸鏈是由復合體Ⅰ(NADH-泛醌還原酶)、Ⅱ(琥珀酸-泛醌還原酶)、 Ⅲ(泛醌-細胞色素C還原酶)、 Ⅳ(細胞色素C氧化酶)、Ⅴ(ATP合成酶)組成。在氧化磷酸化過程中,線粒體呼吸鏈上的大部分電子向下傳遞到細胞色素C氧化酶,然后與質子和氧反應形成水。但是電子在經過線粒體呼吸鏈傳遞過程中極易發生逃逸,與氧反應形成超氧陰離子(O2-)自由基, 進而形成過氧化氫(H2O2)等[16]。線粒體是細胞中ROS形成的主要部位。在本研究中,我們發現,在ODS病人的直腸組織標本中線粒體呼吸鏈上多個蛋白發生明顯變化,包括NDUFS1和NDUFS3(復合體I的亞基),COX5A 和COX7C(復合體IV的亞基),ATP5B 和 ATP5D(復合體V的亞基)。其中,NDUFS1是線粒體復合體I最大的核心亞基,在維持復合體I的結構和功能方面起關鍵作用。在成纖維細胞以及星形膠質細胞與神經元中的研究發現,NDUFS1 表達降低不利于線粒體復合體I 組裝成超級復合體,削弱氧氣消耗,導致線粒體ROS 升高。因此,我們推測線粒體呼吸鏈損害導致的線粒體ROS增多或細胞氧化應激可能通過某些通路參與到ODS的發病過程。
腦組織具有很高的能量需求,有研究表明,線粒體功能障礙是抑郁癥、自閉癥和雙相情感障礙等精神疾病病理生理學的潛在機制[17-18]。在線粒體一系列的生理活動中,氧化磷酸化是為細胞提供能量的重要環節。有研究發現,COX5A、COX5B等參與氧化磷酸化的蛋白質在抗壓模型小鼠中表達上調,這些蛋白的調節為小鼠面對壓力應激時提供保護,降低其患抑郁癥等精神性疾病的風險[19]。而在我們的研究中,COX5A蛋白表達下調,這可能說明ODS病人同時患上抑郁癥等精神疾病的風險會增加。
ITPR3基因可編碼肌醇1,4,5三磷酸受體(IP3R)[20],后者可介導Ca2+從內質網釋放到細胞質,該信號傳導途徑被證實與哺乳動物腦神經功能、外分泌等重要生理活動密切相關[21-22]。IP3R可在胃腸道的肌肉細胞中表達[23],也可在腸道神經元上發生表達[24],胃腸道平滑肌收縮障礙或者胃腸神經元受損均可導致胃腸道消化功能障礙。有研究發現,IP3R在調節體內腸道的生理功能中起著關鍵作用,缺乏IP3R的小鼠腸動力顯著減弱,全腸道傳輸時間延長,導致假性腸梗阻,這說明IP3R可能和維持腸道的正常生理功能有關。同時,這項研究中初步發現IP3R的缺乏可能會導致腸神經元結構的細胞分化和功能出現微小的畸形或缺陷[23]。本研究發現,ODS病人直腸組織標本中ITPR3表達發生下調。因此,ITPR3的表達變化可能與ODS的潛在發病機制有一定的相關性。
綜上所述,基于iTRAQ技術的蛋白質組學分析發現,ODS病人以及混合痔病人之間存在較多差異表達蛋白,這些蛋白質涉及包括免疫過程在內的眾多生物學過程及分子功能,可能參與了ODS分子發病機制。

