NF-κB信號通路在硬骨魚免疫中的作用研究進(jìn)展
劉 念,周俊豪,楊 映
( 佛山科學(xué)技術(shù)學(xué)院 生命科學(xué)與工程學(xué)院,廣東 佛山 528225 )
核轉(zhuǎn)錄因子κB(NF-κB)信號通路的激活對于機(jī)體的免疫應(yīng)答、細(xì)胞凋亡及應(yīng)激反應(yīng)等應(yīng)答過程至關(guān)重要。通過多年的研究,已對魚類NF-κB通路的調(diào)節(jié)作用有了一些認(rèn)識。在硬骨魚中NF-κB轉(zhuǎn)錄因子是多種靶基因的關(guān)鍵調(diào)控因子,這些靶基因包括免疫調(diào)節(jié)基因和生長控制基因、細(xì)胞存活基因和細(xì)胞死亡基因,它可以被多種刺激激活,從而調(diào)控多種免疫應(yīng)答相關(guān)分子的表達(dá)。在硬骨魚中涉及NF-κB信號通路調(diào)控機(jī)制的研究還比較零散,筆者從硬骨魚類NF-κB信號通路調(diào)控機(jī)制、免疫應(yīng)答、調(diào)控凋亡幾方面進(jìn)行綜述,探討NF-κB信號通路在硬骨魚免疫中的調(diào)控網(wǎng)絡(luò)及轉(zhuǎn)導(dǎo)途徑。重要的是通過有關(guān)該通路的機(jī)制研究,可以為人工干預(yù)NF-κB通路增強(qiáng)魚類的抗病能力提供理論基礎(chǔ)。
1 NF-κB信號通路調(diào)控機(jī)制
1.1 NF-κB的激活
首次發(fā)現(xiàn)NF-κB時(shí),其被證明可以與B細(xì)胞免疫球蛋白基因轉(zhuǎn)錄控制元件中的保守特征序列結(jié)合[1]。經(jīng)過大量的研究后發(fā)現(xiàn),幾乎在所有細(xì)胞類型中均可誘導(dǎo)NF-κB活性,現(xiàn)在已知NF-κB/Rel家族的成員可調(diào)節(jié)許多涉及免疫和炎癥反應(yīng)的基因[2]。NF-κB家族成員包括NF-κB1(蛋白產(chǎn)物為p50及其前體p105)、 NF-κB2(p52及其前體p100)、REL(c-Rel)、RELA(p65或RelA)、RELB(Rel B),通過同源或異源結(jié)合成二聚體與抑制性蛋白IκB相互作用形成復(fù)合物保留在細(xì)胞質(zhì)中[3-4]。研究表明,NF-κB作為一種轉(zhuǎn)錄因子從昆蟲到哺乳動物都是保守的[5-7],Correa等[8]也發(fā)現(xiàn),斑馬魚(Daniorerio)的NF-κΒ蛋白能夠結(jié)合哺乳動物的共有DNA結(jié)合(κB)位點(diǎn)和抑制性蛋白IκBα,這說明脊椎動物中NF-κB/IκB蛋白有保守性和相容性。NF-κB可被內(nèi)毒素,炎性細(xì)胞因子如腫瘤壞死因子-α(TNF-α)或白介素-1(IL-1),病毒感染或某些病毒基因產(chǎn)物的表達(dá),紫外線照射,B或T細(xì)胞激活,以及其他生理和非生理刺激而激活[9]。NF-κB的激活通過此過程完成,IκB激酶復(fù)合物(IKK)磷酸化細(xì)胞質(zhì)中NF-κB復(fù)合體中IκB的兩個絲氨酸,磷酸化的IκB隨后被泛素標(biāo)記并使其脫離復(fù)合體,而被泛素標(biāo)記的IκB由酶水解,最終NF-κB二聚體暴露并進(jìn)入細(xì)胞核結(jié)合相關(guān)基因元件調(diào)控廣泛的基因表達(dá)[10-11]。研究表明,NF-κB參與許多生物反應(yīng),如其激活可以促進(jìn)炎癥反應(yīng),調(diào)控細(xì)胞凋亡,參與免疫應(yīng)答等[12-15]。
1.2 NF-κB信號通路的信號傳導(dǎo)途徑
NF-κB激活途徑包括經(jīng)典和替代(非經(jīng)典)途徑。經(jīng)典途徑是通過Rel A與p50的二聚復(fù)合物激活的,而替代途徑是由腫瘤壞死因子家族(不包括腫瘤壞死因子-α)如分化簇40配體(CD40L)、B細(xì)胞活化因子受體、淋巴毒素β受體誘導(dǎo)生成Rel B與p52的二聚復(fù)合物激活。經(jīng)典途徑是在多種刺激信號下誘導(dǎo)泛素—蛋白酶體系統(tǒng)將NF-κB復(fù)合物中IκB組分降解,釋放的NF-κB二聚體可以進(jìn)入細(xì)胞核,與靶基因κB位點(diǎn)結(jié)合并調(diào)節(jié)基因表達(dá)。在經(jīng)典途徑中,NF-κB二聚體與IκB家族抑制性分子相互作用并形成一種穩(wěn)定復(fù)合物(圖1)。NF-κB信號轉(zhuǎn)導(dǎo)通路被促炎性細(xì)胞因子受體激活,例如腫瘤壞死因子受體,白介素-1受體和Toll樣受體家族成員TLR3、TLR4、TLR7;抗原受體,如T細(xì)胞受體和B細(xì)胞受體。這些受體能夠激活I(lǐng)KK(包括IKKα,IKKβ和IKKγ),磷酸化IκB并促進(jìn)其泛素化,最終被26S蛋白酶體降解,降解后的二聚體進(jìn)入細(xì)胞核內(nèi)發(fā)揮轉(zhuǎn)錄調(diào)控作用。在替代(非經(jīng)典)途徑中,沒有IκB,但是RelB/p100復(fù)合物在細(xì)胞質(zhì)中無活性。分化簇40配體,淋巴毒素β受體和B細(xì)胞活化因子受體發(fā)出的信號導(dǎo)致NF-κB誘導(dǎo)激酶(NIK)活化,使同型二聚體IKKα/IKKα磷酸化,p100的C端殘基上的磷酸基團(tuán)被泛素化并被蛋白酶處理成p52。RelB/p100復(fù)合物最終形成RelB/p52經(jīng)過核易位調(diào)控靶基因表達(dá)[16]。
2 硬骨魚NF-κB信號通路調(diào)控機(jī)制
2.1 硬骨魚NF-κB信號傳導(dǎo)途徑

2.2 硬骨魚NF-κB的核轉(zhuǎn)錄調(diào)控作用
核轉(zhuǎn)錄因子NF-κB在沒有誘導(dǎo)信號的情況下主要定位于細(xì)胞質(zhì)中。腫瘤壞死因子-α或白介素-1等炎性細(xì)胞因子刺激細(xì)胞后,可誘導(dǎo)NF-κB的抑制因子IκB降解,引起NF-κB的核蓄積和特定基因表達(dá)的調(diào)節(jié),而IκB的降解最初由IκB激酶誘導(dǎo)的磷酸化控制,這個過程包括泛素化和隨后蛋白酶體對抑制劑的蛋白水解[25]。NF-κB一旦進(jìn)入細(xì)胞核,活化的NF-κB經(jīng)歷一系列翻譯后修飾,包括磷酸化、乙酰化和甲基化,而這些修飾調(diào)節(jié)NF-κB活性的強(qiáng)度和持續(xù)時(shí)間。活化的NF-κB與靶基因中的特定DNA序列(稱為κB元件)結(jié)合,并調(diào)節(jié)涉及免疫調(diào)節(jié)、生長調(diào)節(jié)、炎癥、致癌和凋亡等500多個基因的轉(zhuǎn)錄(圖2為NF-κB調(diào)控的一些基因產(chǎn)物),在硬骨魚中已報(bào)道的受NF-κB調(diào)控的基因用紅色標(biāo)出[26-28],不難發(fā)現(xiàn),硬骨魚中受NF-κB調(diào)控的基因還有待深入研究。NF-κB的激活可以影響其下游的免疫相關(guān)基因的表達(dá),如在草魚幼魚腸道中NF-κB通路可以影響腫瘤壞死因子-α、白介素-1β,IKKβ和c-Rel等mRNA水平的表達(dá)[29-30]。在鯉魚中NF-κBp65基因表達(dá)被增強(qiáng)后,NF-κB通路被激活導(dǎo)致炎性相關(guān)細(xì)胞因子基因(即白介素-1β、白介素-6、白介素-10)表達(dá)增加[31]。Kong等[32]對褐牙鲆(Paralichthysolivaceus)中的白介素-6啟動子進(jìn)行表征,結(jié)果表明,p65亞基調(diào)控了白介素-6的轉(zhuǎn)錄,即NF-κB通路參與了白介素-6的表達(dá)調(diào)控。
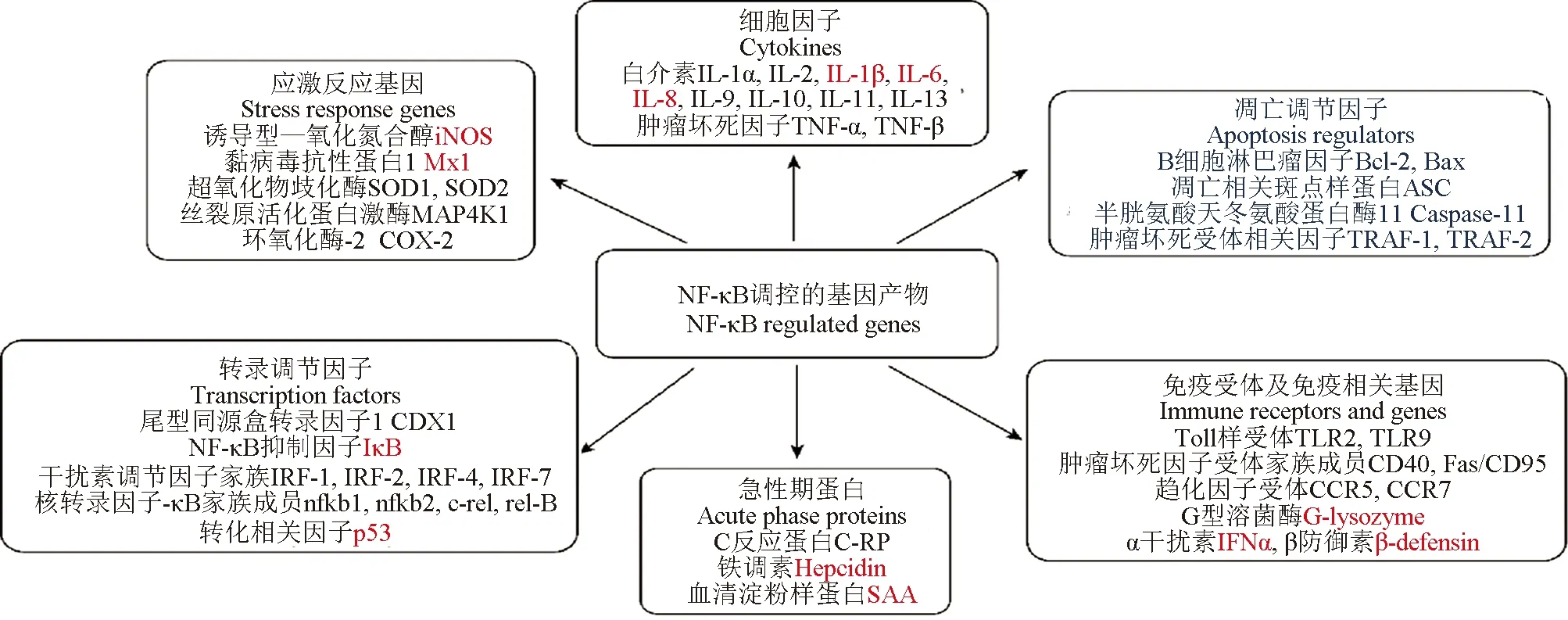
圖2 NF-κB調(diào)控的一些基因產(chǎn)物
3 硬骨魚NF-κB免疫應(yīng)答
3.1 營養(yǎng)因素影響NF-κB免疫應(yīng)答
硬骨魚的頭腎、肝臟、脾臟、腸黏膜等是其重要的免疫相關(guān)器官,如魚類攝入營養(yǎng)素不足,會影響NF-κB通路免疫應(yīng)答,進(jìn)而影響組織器官免疫功能。研究發(fā)現(xiàn),維生素E缺乏導(dǎo)致草魚頭腎、脾臟和鰓中NF-κB 通路激活,使得白介素-10、轉(zhuǎn)化生長因子-β1、IκBα mRNA表達(dá)水平被下調(diào),而促炎性細(xì)胞因子白介素-1β、白介素-6、白介素-8表達(dá)被上調(diào),結(jié)果表明,維生素E缺乏將介導(dǎo)草魚NF-κB信號通路影響草魚免疫功能[33-34]。Feng等[35]研究表明,草魚膳食煙酸缺乏會激活NF-κB通路,通過上調(diào)促炎細(xì)胞因子(腫瘤壞死因子-α、白介素-1β、干擾素-γ2和白介素-8)在魚腸中表達(dá)和下調(diào)抗炎細(xì)胞因子(白介素-10和轉(zhuǎn)化生長因子-β1)的表達(dá),影響草魚腸道免疫。而在草魚日糧中添加苯丙氨酸后,可在全段腸通過NF-κB信號通路下調(diào)促炎細(xì)胞因子同時(shí)上調(diào)抗炎細(xì)胞因子的表達(dá),從而改善草魚腸道免疫狀態(tài)[36]。Li等[37]發(fā)現(xiàn),烏鱧(Channaargus)肝臟和脾臟中腫瘤壞死因子-α、白介素-1β和白介素-8等炎癥相關(guān)基因的表達(dá)會受到微量元素硒(Se)的影響,與對照組相比,烏鱧肝臟和脾臟被硒誘導(dǎo)后上調(diào)p65、腫瘤壞死因子-α、白介素-1β和白介素-8的基因表達(dá),同時(shí)下調(diào)了IκBα的基因表達(dá),最終誘導(dǎo)炎癥的發(fā)生。而Liu等[38]在飼料中添加谷氨酰胺飼喂大菱鲆(Scophthalmusmaximus)后,在其腸中發(fā)現(xiàn)NF-κB信號通路被抑制可以增強(qiáng)腸道屏障功能,同時(shí)NF-κB核易位的減少還可以抑制炎癥從而減輕腸病。
3.2 有毒物質(zhì)和污染物
在魚類肝臟中NF-κB通路也調(diào)控著相關(guān)免疫基因的表達(dá),如Guo等[39]發(fā)現(xiàn),斑馬魚暴露于全氟辛烷磺酰基化合物(PFOS)中,魚肝臟中的NF-κB水平均顯著高于對照組;同時(shí)伴隨NF-κB的活化IκBα基因表達(dá)強(qiáng)烈下調(diào),p65、白介素-15、轉(zhuǎn)化生長因子-β的mRNA表達(dá)水平顯著增加,白介素-1β、腫瘤壞死因子-α表達(dá)均顯著增強(qiáng)。還有研究發(fā)現(xiàn),斑馬魚肝臟中NF-κB通路在鎘的暴露下被抑制,導(dǎo)致炎癥細(xì)胞因子表達(dá)降低影響斑馬魚的炎癥反應(yīng)[40]。在硬骨魚中,有研究者利用H2O2在斑馬魚中建立慢性炎癥作用模型,發(fā)現(xiàn)H2O2通過激活NF-κB通路從而誘導(dǎo)編碼促炎介質(zhì)的基因(包括白介素-1β)的表達(dá)[41]。還有研究者將NF-κB特異性抑制劑吡咯烷二硫基甲酸鹽(PDTC)預(yù)處理建鯉(Cyprinuscarpiovar.jian)精密切割肝切片,然后再將其用CCl4處理,發(fā)現(xiàn)NF-κB信號通路炎癥細(xì)胞因子以及由NF-κB信號通路調(diào)節(jié)的下游炎癥細(xì)胞因子白介素-1β、白介素-6和白介素-8相應(yīng)地顯著下調(diào),NF-κB通路被抑制的切片與對照組切片相比活力顯著增加。表明抑制NF-κB信號通路激活可以下調(diào)炎性細(xì)胞因子表達(dá)進(jìn)而減輕CCl4誘導(dǎo)的魚肝炎癥[42]。甘海燕等[43]發(fā)現(xiàn),斑馬魚被生活污水處理后,NF-κB的表達(dá)上調(diào)并激活從而促進(jìn)炎癥反應(yīng)。
3.3 免疫刺激物及病原
有研究表明,在草魚飼料中添加大豆β-球蛋白可以增強(qiáng)其腸組織p65核移位,升高促炎細(xì)胞因子和降低抗炎細(xì)胞因子mRNA水平,繼而引起全腸段腸道炎癥[44]。還有研究發(fā)現(xiàn),斑馬魚在遲鈍愛德華氏菌(Edwardsiellatarda)保護(hù)性免疫原誘導(dǎo)下,激活NF-κB通路使得白介素-1β、白介素-6和白介素-8等天然免疫基因的表達(dá)相比于非保護(hù)性免疫原有更高和更持久的免疫反應(yīng)[45]。在聚肌胞苷酸和脂多糖的刺激下,草魚各組織中的p65、p105和c-Rel的表達(dá)水平均呈現(xiàn)上調(diào),說明NF-κB與草魚的抗病毒或抗菌的生理過程有關(guān)[23]。另外Zhang等[46]在轉(zhuǎn)基因熒光斑馬魚卵黃中注入脂多糖后,提取RNA進(jìn)行定量分析發(fā)現(xiàn),NF-κB通路IκBα的表達(dá)顯著降低,而p65升高;同時(shí)細(xì)胞因子白介素-1β、白介素-6、腫瘤壞死因子-α和干擾素-γ的mRNA水平顯著升高,白介素-10的表達(dá)明顯減少。再進(jìn)行斑馬魚活體熒光成像也發(fā)現(xiàn),卵黃囊中的中性粒細(xì)胞炎癥活性顯著增加。Zheng等[47]從草魚頭腎中分離白細(xì)胞,將其經(jīng)過脂多糖處理后發(fā)現(xiàn),NF-κB、IKKα和IKKγ的mRNA表達(dá)顯著增加,NF-κB通路被激活導(dǎo)致促炎性細(xì)胞因子白介素8和腫瘤壞死因子-α mRNA表達(dá)也顯著上調(diào),從而促進(jìn)白細(xì)胞炎癥反應(yīng)。Jiang等[48]利用脂多糖對建鯉進(jìn)行免疫刺激后發(fā)現(xiàn),魚腸中腫瘤壞死因子-α、白介素-1β、白介素-8的相對mRNA表達(dá)水平被上調(diào),同時(shí)NF-κB通路被激活促進(jìn)白介素-1β的表達(dá)上調(diào),進(jìn)一步導(dǎo)致炎癥反應(yīng)加劇,從而引起魚的腸炎。Shanaka等[49]在許氏平鲉(Sebastesschlegelii)中發(fā)現(xiàn),多種免疫刺激物(包括聚肌胞苷酸、脂多糖)和海豚鏈球菌(Streptococcusiniae)均可引起NF-κB轉(zhuǎn)錄因子的激活。健康魚體內(nèi)NF-κB2在肝臟組織中表達(dá)量最高,IκBα在腎中表達(dá)量最高,草魚經(jīng)過草魚呼腸孤病毒(GCRV)感染后,NF-κB2在腸道中出現(xiàn)了顯著的上調(diào)表達(dá);IκBα在肝臟中產(chǎn)生了顯著的下調(diào)表達(dá),在腸道中出現(xiàn)了小幅度的上調(diào)表達(dá);盡管具體應(yīng)答機(jī)制還不明確,但這些結(jié)果可能指示,NF-κB通路經(jīng)病毒感染后的肝臟和腸道中產(chǎn)生了主要的免疫應(yīng)答[50]。然而有研究者用遲鈍愛德華菌誘導(dǎo)虹鱒(Oncorhynchusmykiss)肝癌細(xì)胞系(RTH-149細(xì)胞)時(shí)發(fā)現(xiàn),虹鱒去泛素化酶(CYLD)對于NF-κB的激活具有抑制作用[51]。
3.4 其他影響免疫調(diào)節(jié)
在魚類和哺乳動物中均發(fā)現(xiàn),一些抗氧化物質(zhì)可以抑制NF-κB的激活,導(dǎo)致NO、白介素-1β的表達(dá)降低影響炎癥反應(yīng)[52-53]。有研究發(fā)現(xiàn),抗生素氟苯尼考(FFC)可以下調(diào)NF-κB信號通路抑制脂多糖誘導(dǎo)的炎性細(xì)胞因子腫瘤壞死因子-α、白介素-6、白介素-1β的表達(dá),從而表現(xiàn)出抗炎作用[54],而鯉原代巨噬細(xì)胞在恩諾沙星、四環(huán)素等抗生素的作用下卻可導(dǎo)致NF-κB的激活[15]。而在當(dāng)前尋找替代抗生素的背景下,有研究發(fā)現(xiàn),通過添加一種新益生菌的飼料投喂斑馬魚,在其肝臟中誘導(dǎo)了天然免疫相關(guān)基因(白介素-1β、白介素-6、腫瘤壞死因子-α、白介素-10、白介素-21、NF-κB)的表達(dá),而且發(fā)現(xiàn)溶菌酶和補(bǔ)體C3b活性增強(qiáng),經(jīng)益生菌處理的試驗(yàn)魚在感染嗜水氣單胞菌(Aeromonashydrophila)和海豚鏈球菌后存活率高于對照魚。這可能是通過NF-κB信號通路調(diào)節(jié)斑馬魚對致病菌的天然免疫[55]。另外Rastgar等[56]通過使用NF-κB拮抗劑吡咯烷二硫代氨基甲酸酯(PDTC)處理自波斯鱘(Acipenserpersicus)頭腎中分離培養(yǎng)的巨噬細(xì)胞,消除了NF-κB的作用,最終導(dǎo)致巨噬細(xì)胞吞噬活性降低。有趣的是魚體內(nèi)脂肪過多時(shí)將導(dǎo)致脂肪因子表達(dá)失調(diào),此時(shí)白色脂肪組織具有免疫活性,Sun等[57]發(fā)現(xiàn),在草魚白色脂肪細(xì)胞由其前脂肪細(xì)胞分化過程中伴隨NF-κB信號通路的激活,并且在脂肪形成過程中NF-κB的水平升高,這說明NF-κB信號通路可能通過影響草魚脂肪細(xì)胞分化進(jìn)而影響脂肪積累時(shí)的免疫功能。
4 硬骨魚NF-κB調(diào)控細(xì)胞凋亡
4.1 氧化應(yīng)激過程中的調(diào)控作用
NF-κB信號通路有著重要的細(xì)胞凋亡調(diào)控功能,它可以調(diào)控下游炎癥相關(guān)細(xì)胞因子參與細(xì)胞凋亡,也可以與其他通路相互串?dāng)_調(diào)控凋亡過程,在對抗氧化應(yīng)激和自由基的細(xì)胞毒性方面有重要調(diào)控作用。Ivanova等[58]發(fā)現(xiàn),NF-κB亞單位RelA、IκBα存在于線粒體內(nèi),兩者共同參與防止缺氧早期細(xì)胞凋亡。另外有研究發(fā)現(xiàn),NF-κB亞單位RelA或RelB的過度表達(dá)可顯著拮抗p53誘導(dǎo)的人結(jié)腸癌細(xì)胞(HCT116細(xì)胞)Bax啟動子活性,而通過抑制NF-κB可增強(qiáng)Bax的表達(dá),表明NF-κB信號通路參與Bax誘導(dǎo)的線粒體凋亡[59]。Li等[60]利用斑馬魚胚胎模型,通過偶氮二異丁脒鹽酸鹽(AAPH,偶氮化合物,會刺激細(xì)胞產(chǎn)生大量的活性氧,在體外或體內(nèi)可以誘導(dǎo)氧化應(yīng)激)誘導(dǎo)活性氧產(chǎn)生引發(fā)細(xì)胞毒性,但加入NF-κB抑制劑抑制該通路后,斑馬魚胚胎活性氧的產(chǎn)生相較于對照組大幅降低,即通過抑制該通路可以減弱活性氧對機(jī)體引起的抗氧化應(yīng)激,減弱細(xì)胞毒性。在另一項(xiàng)研究中發(fā)現(xiàn),H2O2誘導(dǎo)細(xì)胞產(chǎn)生活性氧促進(jìn)NF-κB的磷酸化和p65的轉(zhuǎn)運(yùn),而3-溴-4,5-二羥基苯甲醛(BDB,具有清除羥基和烷基自由基的活性)可抑制這個過程,明顯抑制NF-κB通路的激活。該結(jié)果提示,BDB通過調(diào)節(jié)NF-κB途徑抑制H2O2誘導(dǎo)的細(xì)胞凋亡[61]。而Jaafaru等[62]發(fā)現(xiàn),上調(diào)神經(jīng)細(xì)胞中參與NF-κB途徑的組成性信號傳導(dǎo)的轉(zhuǎn)錄因子(c-ReL和p52)的表達(dá),可以增加細(xì)胞在H2O2毒性環(huán)境中存活率。另外,Jia等[63]用CCl4誘導(dǎo)鯉肝臟形成高活性自由基引起氧化應(yīng)激,觸發(fā)腫瘤壞死因子-α釋放并增加Toll樣受體4水平,然后激活NF-κB刺激一氧化氮合酶、白介素-1β和白介素-12的表達(dá)引起細(xì)胞炎癥和壞死,而高水平的腫瘤壞死因子-α還會激活肝細(xì)胞凋亡。
4.2 其他影響因素下的調(diào)控作用
同樣,營養(yǎng)性因素也可以影響NF-κB信號通路調(diào)節(jié)細(xì)胞凋亡,有研究發(fā)現(xiàn),維生素E缺乏將介導(dǎo)草魚NF-κB信號通路上調(diào)草魚頭腎、脾臟和皮膚中天冬氨酸特異性半胱氨酸蛋白酶-2,3,7,8 mRNA的水平誘導(dǎo)細(xì)胞凋亡[33]。Zhang等[64]用大豆?jié)饪s蛋白和棉籽濃縮蛋白組成的植物蛋白混合物完全替代魚粉的日糧飼喂花鱸(Lateolabraxmaculatus),結(jié)果其肝臟中NF-κB通路被激活促使caspase-8表達(dá)上調(diào),這預(yù)示NF-κB介導(dǎo)外源性途徑(caspase8/caspase3)促進(jìn)肝細(xì)胞凋亡。另外,Silva等[65]發(fā)現(xiàn),美人魚發(fā)光桿菌殺魚亞種(Photobacteriumdamselaessp.piscicida)的主要毒力因子AIP56(56 ku的凋亡誘導(dǎo)蛋白,可以切割p65的鋅金屬蛋白酶)可以介導(dǎo)歐洲舌齒鱸(Dicentrarchuslabrax)腹膜白細(xì)胞(由約70%的巨噬細(xì)胞和20%的中性粒細(xì)胞組成,并有少量的嗜酸性粒細(xì)胞、淋巴細(xì)胞和紅細(xì)胞)p65的裂解,通過干擾NF-κB通路導(dǎo)致巨噬細(xì)胞和中性粒細(xì)胞凋亡。NF-κB信號通路在防止熱應(yīng)激誘導(dǎo)的炎性細(xì)胞因子生成和細(xì)胞凋亡中起著重要作用。有研究者對牛進(jìn)行熱應(yīng)激時(shí)發(fā)現(xiàn),NF-κB通路被抑制,白介素-2、白介素-12等促炎介質(zhì)和caspase-3等細(xì)胞凋亡參數(shù)顯著降低,抗凋亡基因Bcl-2表達(dá)增強(qiáng),從而阻止細(xì)胞凋亡[66]。然而目前還沒有在水產(chǎn)動物中研究熱應(yīng)激對NF-κB信號通路的影響,在當(dāng)前全球氣候變暖的趨勢下,進(jìn)行這方面的研究還是很有意義的。在哺乳動物中NF-κB信號通路還可以在剝奪糖氧再恢復(fù)氧應(yīng)激[67]、神經(jīng)毒素[68]、特異性磷酸酶(PTEN)[69]等因素作用下調(diào)控細(xì)胞凋亡。在硬骨魚中,NF-κB信號通路很可能在其他影響因素介導(dǎo)下調(diào)控細(xì)胞凋亡。
5 展 望
綜上所述,NF-κB信號通路是一個經(jīng)典的也是非常重要的信號轉(zhuǎn)導(dǎo)通路,在影響細(xì)胞的炎癥反應(yīng),免疫應(yīng)答以及凋亡等方面有著重要地位。但在魚類中NF-κB信號通路相關(guān)機(jī)制上的研究還不夠充分,盡管如此,NF-κB信號通路在魚類疾病防控中的研究依然重要。該通路可以調(diào)控免疫相關(guān)活性分子的生成直接參與機(jī)體免疫應(yīng)答,還可以通過應(yīng)激反應(yīng)和其他因素影響組織細(xì)胞的凋亡,而這些影響都涉及機(jī)體免疫功能。因此進(jìn)一步研究NF-κB信號通路在硬骨魚中的調(diào)控網(wǎng)絡(luò)及轉(zhuǎn)導(dǎo)途徑,有助于解釋魚類免疫應(yīng)答過程和機(jī)制,然后通過人為調(diào)控NF-κB信號通路,增強(qiáng)魚類的抗病能力。

