基于LAMP 技術的弧菌快速檢測方法的建立
張芳芳
(福建省閩東水產研究所,福建 寧德 352100)
弧菌(Vibrio)是一種菌體短小、彎曲成弧形、尾部帶一鞭毛的革蘭氏陰性細菌,也是一類兼具遺傳多樣性與生態多樣性的兼性厭氧細菌,廣泛分布于近岸海域及海洋環境中,是海水及養殖生物的主要致病菌之一[1]。海洋弧菌可引起海洋經濟動物的大規模感染和死亡,給養殖業造成巨大的經濟損失。如哈維弧菌(V.harveyi)可以引起海水養殖生物,包括琥珀魚、大菱鲆、暗紋東方鲀、斜帶石斑魚、鮑魚、對蝦和大黃魚等的全球性疾病[2];溶藻弧菌(V.alginolyticus)能夠使大菱鲆、大黃魚、石斑魚等致病,還可引起珊瑚白化病[3]。此外,海洋弧菌還可能對人類的健康產生危害,例如:副溶血弧菌(V.parahemolyticus)可感染貝類、甲殼類、魚類等,人類如果食用腌制或未完全煮熟的帶病菌海鮮,容易引起嚴重的腸胃炎[4];人體皮膚損傷后接觸到帶有創傷弧菌(V.vulnificus)的海水或者海產品,會發生感染,病情嚴重的會導致敗血癥、器官衰竭等[5]。因此,弧菌的快速檢測和監控對于海洋養殖和人類健康的安全有著重要的意義。
傳統的弧菌檢測方法主要包括選擇性培養基、生化和血清學檢測、組織切片觀察法、超薄切片電鏡觀察法[6]。近年來,弧菌的分子生物學檢測技術也有較大進展,包括分子雜交法、DGGE 法、TGGE 法、RFLP 法[7]、高通量液相芯片法[8]、多重PCR 檢測、微陣列技術[9]等,然而這些技術普遍存在成本高、耗時耗力、依賴專業人員和專業檢測設備等缺點,不適合在養殖場及魚排上推廣。而環介導等溫擴增(loopmediated isothermal amplification,LAMP)技術是一種新的病原核酸檢測技術,該技術憑借高效簡便、靈敏度高、成本低等優勢在病原檢測領域廣泛應用,并取得了較好的效果[10]。相關研究顯示,LAMP 技術已在副溶血性弧菌、霍亂弧菌、創傷弧菌、哈維氏弧菌和溶藻弧菌等的檢測上應用[5,11-16],但現有LAMP 技術大部分都只針對單一的弧菌檢測,該研究針對上述問題,根據弧菌屬保守基因序列設計引物,并對LAMP反應條件進行篩選優化,建立了可檢測多種致病性弧菌的LAMP 快速檢測方法。最后利用水樣和不同菌株進行方法特異性和靈敏度分析,旨在為弧菌快速檢測及早期診斷提供技術支持和數據支撐。
1 材料與方法
1.1 試驗材料
試驗使用的菌株包括:哈維氏弧菌(V.harveyi,vha)、副溶血弧菌(V.parahemolyticus,vpa)、創傷弧菌(V.vulnificus,vvu) 和 溶 藻 弧 菌(V.alginolyticus,val),由福建農林大學海洋研究院從大黃魚身上分離并保存;維氏氣單胞菌(Vickers aeromonas,vae)、嗜水氣單胞菌(Aeromonas hydrophila,vhy)、豚鼠氣單胞菌(Aeromonas caviae,aca)、溫和氣單胞菌(Aeromonas sobria,aso)、大腸桿菌(Escherichia coli,eco)、金黃色葡萄球菌(Staphylococcus aureus,sau)、遲鈍愛德華菌(Retarded Edwards,red)、綠膿桿菌(Pseudomonas aeruginosa,pae),由集美大學鰻鱺病害防控課題組提供。
主要試驗試劑包括:硫酸鎂、鈣黃綠素與甜菜堿[Sigma Aldrich 公司(美國)],Tris-HCl (pH 值8.8)、KCl、(NH4)2SO4(索萊寶生物科技有限公司),MiniBEST 細菌基因組DNA 提取試劑盒、Taq DNA 聚合酶、dNTPs 和DNA Marker DL 2 000 [寶生物工程(大連)有限公司],Bst DNA 聚合酶、10× Reaction Buffer 和Solution Mix[New EnglandBiolabs 公 司( 美國)],胰酪大豆胨瓊脂(TSA)培養基、胰酪大豆胨肉湯(TSB)培養基(廈門琉聯生物科技有限公司),ALL-DNA-OUT 試劑盒[生工生物工程(上海)股份有限公司]。
根據弧菌屬16S rRNA 高度保守區域的基因片段,利用Primer Explorer version 4.0 設計3 套LAMP 特異性引物,引物由生工生物科技有限公司合成。通過預試驗進行比較篩選,最終確定1 套最優的LAMP 引物(見表1)。
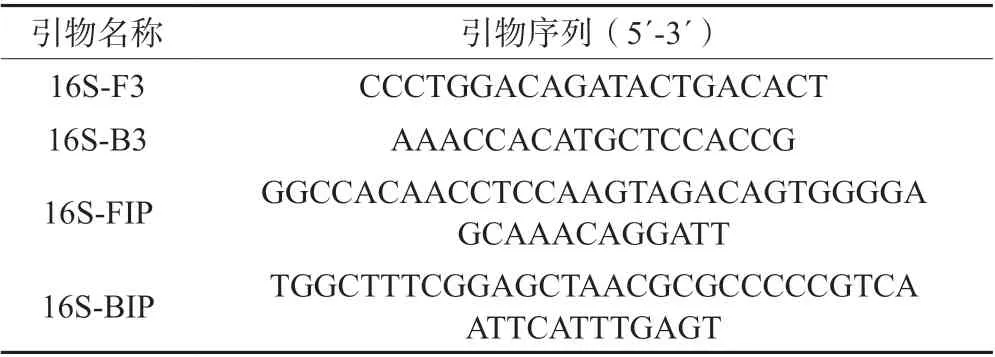
表1 LAMP 引物序列
1.2 試驗方法
1.2.1 細菌DNA提物制備 將菌種從-80 ℃冰箱取出后快速復溫,接種在TSA 平板上,并將平板倒置于培養箱中30℃過夜培養,從過夜培養的平板中各挑出3 個單菌落至TSB 培養基中,震蕩培養12 h,按照細菌基因組DNA 提取試劑盒說明書進行DNA 提取,用分光光度計檢測DNA 濃度及純度,-20℃保存備用。
1.2.2 LAMP反應體系和反應程序的優化 根據相關文獻使用LAMP 25 μL 反應體系,各種成分及其濃度為:內引物16s-FIP 和16s-BIP 各1.6 μmol/L、外引物16s-F3 和16s-B3 各0.2 μmol/L、20 mmol/L Tris-HCl (pH值8.8)、10 mmol/L KCl、8 mmol/L MgSO4、10 mmol/L(NH4)2SO4、0.1% Tween-20、0.8 mol/L 甜 菜 堿、1.6 mmol/L dNTPs,8U Bst DNA 聚合酶及模板2 μL,使用超純水補齊至25 μL。反應程序為63 ℃、45 min。通過對Mg2+濃度(4、6、8、10 mmol/L)、甜菜堿濃度(0.4、0.6、0.8 、1.0 mol/L)、dNTPs濃度(1.2、1.4、1.6、1.8 mmol/L)和反應溫度(61、63、65、67 ℃)4 個變量參數進行單因素試驗,以擴增條帶的清晰度為考察指標優化反應體系及反應程序。
1.2.3 特異性試驗根據優化好的LAMP 反應體系及反應程序,以vha、vpa、val、vvu、vae、vhy、aca、aso、eco、sau、red 和pae 的DNA 為模板進行檢測,以滅菌超純水為陰性對照,同時向反應管中加入1 μL鈣黃綠素,通過顏色變化來判斷是否存在擴增,變黃綠色,說明發生了LAMP 特異性擴增,反之則無。同時進行常規PCR 擴增,引物為16S-F3 和16S-B3。反應體系(25 μL):Taq DNA 聚合酶0.3 μL,10×PCR Buffe 2.5 μL ,dNTP 2 μL,上下游引物 各0.5 μL,DNA 模板2 μL,用ddH2O 補齊至25 μL。反應程序:預變性94℃,5 min;變性94℃,30 s;退火58℃,30 s;延伸72℃,45 s,進行30 個循環;最后72℃終延伸10 min。反應結束后,將LAMP 擴增產物和常規PCR 擴增產物在1.2%瓊脂糖凝膠上110 V 電泳分離30 min,并觀察LAMP 擴增產物在紫外光照射下的顏色變化,以驗證所建方法的特異性。
1.2.4 敏感性試驗以vvu 為代表,將提取的DNA模板加入雙蒸水,進行10 倍遞進稀釋,在相同反應條件下對不同濃度DNA 模板進行LAMP 擴增和常規PCR 擴增,通過瓊脂糖電泳結果及顏色變化驗證所建方法的最低檢測限。
1.2.5 實際樣品檢測為了評價LAMP 檢測方法的有效性,2019 年7 月從寧德蕉城區泥土澳養殖場采集體表有肉眼可見潰爛的大黃魚6 條,采集其肝臟取約芝麻粒大小,加入到含有50 μL All-DNA-Fast-Out 的0.2 mLPCR 管中,在80℃孵育15 min 后,將上清液直接用做LAMP 檢測的模板進行檢測,并對常規PCR 方法與LAMP 方法的檢測結果進行比較,同時對PCR產物進行測序。
2 結果與分析
2.1 LAMP 檢測方法優化
在不同的Mg2+濃度、dNTP 濃度、甜菜堿濃度及反應溫度下擴增,分別取5 μL 反應產物進行1.2%瓊脂糖凝膠電泳,結果如圖1 所示。
由圖1A 可知,隨著Mg2+濃度增加,LAMP 反應效率呈降低趨勢,Mg2+濃度為4 mmol/L 時LAMP產物跑膠時條帶最亮,與負對照相比差異最明顯,這說明在LAMP 反應體系中Mg2+濃度為4 mmol/L 時反應效率最優。相反,反應體系中隨著dNTPs 濃度的增加,LAMP 反應效率呈上升趨勢(圖1B),dNTPs 濃度為1.8 mmol/L 時,LAMP 產物跑膠時條帶最亮,與負對照相比差異最明顯。因此,選擇dNTPs 濃度為1.8 mmol/L 進行LAMP 后續反應。
LAMP 反應體系中加入4 種不同濃度甜菜堿均可以得到梯型條帶(圖1C)。但0.4 和0.6 mol/L 條帶亮度差異不大,與負對照相比差異最明顯,考慮到試驗成本,確定加入0.4 mol/L 甜菜堿進行LAMP 后續反應。此外,LAMP 反應體系中,61、63 和65℃均可以擴增出條帶,說明反應溫度條件具有比較好的寬容性,其中61 和63℃擴增產物亮度比較接近,與負對照相比差異最明顯,說明在LAMP 反應體系中反應溫度為61 或63℃時反應的產量相對更高。同樣考慮到試驗成本問題,確定最優的LAMP 反應溫度為61℃。
綜上所述,優化后LAMP 反應條件為:在25 μL 反應體系中內引物16S-FIP 和16S-BIP 濃度為1.6 μmol/L、外引物16S-F3 和16S-B3 濃度為0.2 μmol/L,反 應 體 系 中 包 含20 mmol/L Tris-HCl( pH 值8.8),KCl 10 mmol/L,MgSO44 mmol/L,(NH4)2SO410 mmol/L,Tween-20 0.1%,甜菜堿0.4 mol/L,dNTPs 1.8 mmol/L,8U BstDNA 聚合酶及模板2 μL;最終反應程序為61℃條件下運行45 min。
2.2 LAMP 反應特異性評價
使用優化后的LAMP 反應體系對供試的12 種菌株進行擴增,結果如圖2 所示,僅溶藻弧菌、哈維氏弧菌、副溶血弧菌和創傷弧菌4 種菌株發生顯色反應。常規PCR 結果(圖3)顯示,也只有溶藻弧菌、哈維氏弧菌、副溶血弧菌和創傷弧菌4 種菌株擴增出了條帶,其他8 種常見致病菌及陰性對照樣本均未擴增出條帶。這表明優化后的LAMP 反應體系特異性較好。

圖2 12 種供試菌株的LAMP 檢測結果
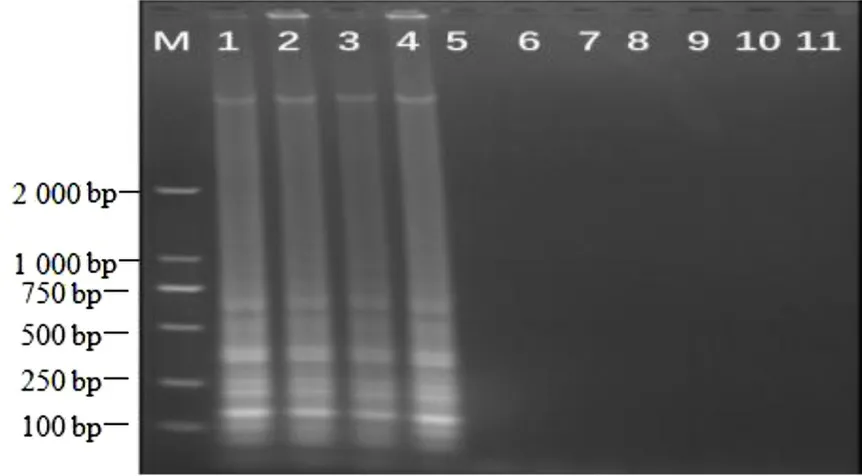
圖3 12 種供試菌株的常規PCR 檢測結果
2.3 LAMP 反應靈敏度評價
由圖4 可知,將創傷弧菌提取的DNA 進行系列稀釋作為擴增反應模板,當濃度依次為94 ng/μL~ 940 fg/μL 時,均有發生顯色反應,當濃度為94 fg/μL 時未出現顯色,說明沒有擴增。由圖5 可知,常規PCR法的最低檢測限為94 pg/μL。兩相比較,說明LAMP檢測比常規PCR 檢測具有更好的靈敏度。

圖4 LAMP 的靈敏性檢測結果
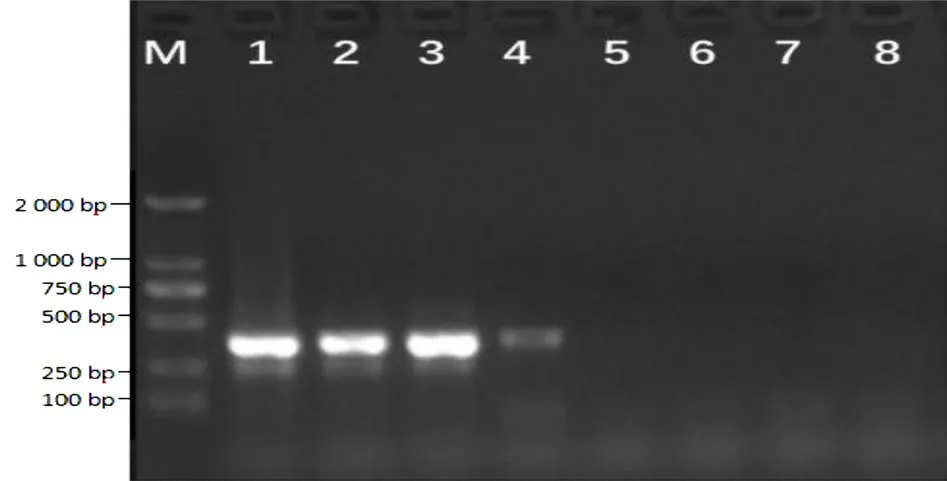
圖5 常規PCR 的靈敏性檢測結果
2.4 LAMP 檢測方法的應用
用該研究建立的LAMP 法以及常規PCR 法對采集的體表有肉眼可見潰爛的大黃魚進行檢測,二者結果相一致,結果見圖6 和圖7,而且LAMP 反應液顯色結果(圖8)與電泳結果也是一致的。對PCR 產物進行測序,序列比對結果顯示,PCR 擴增出的目的條帶與Gene Bank 上公布的弧菌屬序列同源率高達99%以上,表明大黃魚感染了致病弧菌。同時,也驗證了該LAMP 方法可準確檢測出水產品上的弧菌,在實際應用中具有一定的可行性。
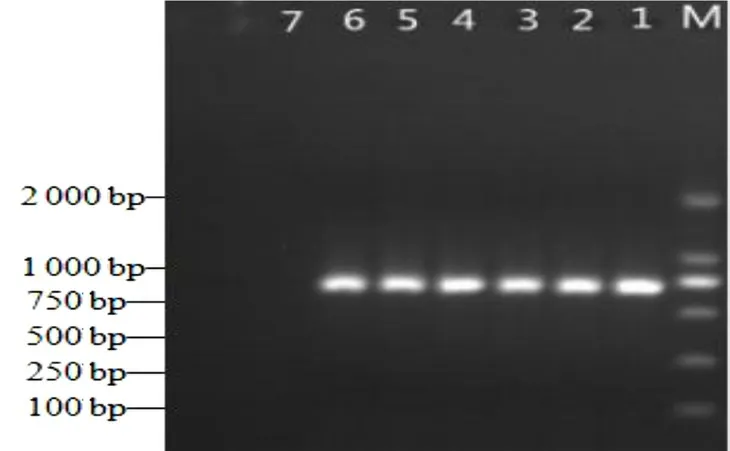
圖6 實際樣品的常規PCR 檢測結果
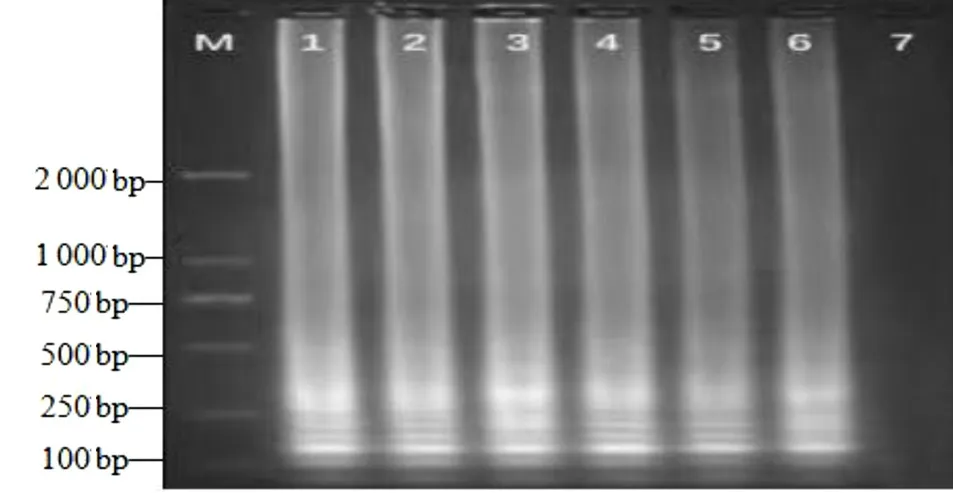
圖7 實際樣品的LAMP 檢測電泳結果

圖8 實際樣品的LAMP 檢測顯色結果
3 討 論
相關研究顯示,海水養殖水生生物在感染弧菌的早期由于無臨床征象,往往難以察覺。然而,一旦感染,溶藻弧菌、哈維氏弧菌、副溶血弧菌、霍亂弧菌、創傷弧菌等弧菌在合適的外界環境下便會大量繁殖,當魚體中的病原微生物大量積累,導致魚群發生應激反應,魚體組織出現明顯潰爛時,養殖戶們才會發現,此時已錯過弧菌防治的最佳時機[17]。而且,水產養殖中弧菌病暴發的概率高,感染比例大,已成為阻礙水產養殖產業健康發展的主要因素[18]。
該研究針對致病性弧菌基因保守序列中的6 個位點設計了2 對特異性引物(內、外引物各一對),利用具有鏈置換活性的Bst DNA 聚合酶,通過鏈置換方式進行高效擴增,建立了一種針對致病性弧菌的快速通用LAMP 檢測方法。由于LAMP 獨特的核酸擴增機制,反應過程在恒溫下即可完成,不再需要像常規PCR 那樣復雜的程序(需經歷預變性、變性、退火、延伸等多個溫度),操作簡便高效且成本低,對儀器要求也不高[19]。此外,LAMP 的產物是由多重復靶序列的莖-環狀DNA 和花椰菜狀DNA 所組成的混合物,在瓊脂糖凝膠電泳上會呈現出LAMP 所特有的階梯狀條帶,故可通過跑膠后的條帶判斷反應是否進行,另外可結合特定的熒光染料進行顯色反應,檢測人員可以直接根據顏色的變化來得出結果,對場地和人員的操作要求相對較低,在條件相對簡陋的情況下也可以展開工作[20]。目前,LAMP 方法已成功應用于多種病毒、真菌、細菌等病原的分子生物學檢測和診斷[21-23],在水產養殖領域也得到了有效推廣。弧菌在海水和海洋動物中廣泛存在且常年引發疾病,但大部分LAMP 檢測都僅針對單一弧菌屬細菌,對致病性弧菌進行通用性檢測,可以顯著提高檢測效率,進而增強水生生物和海產品的安全性。
反應體系中反應溫度以及Mg2+、dNTPs 和甜菜堿的濃度都會對LAMP 反應產生影響,濃度過高或過低都不利于反應的進行,甚至會終止反應,該研究對各反應條件進行優化,保證了方法的可靠性和特異性。整個LAMP 檢測反應時間為45 min,較之于傳統的檢測方法和其他常規分子檢測具有極大的優越性。優化后的LAMP 反應體系對溶藻弧菌、哈維氏弧菌、副溶血弧菌、創傷弧菌4 種弧菌檢測均為陽性,其他菌株則未發生擴增反應,表明該研究的LAMP 引物可以有效對弧菌做出特異性檢測。這是由于LAMP 反應需要在4 個不同序列的引物與模板發生特異性配對后才能啟動,故其具有高度的特異性。在靈敏度檢測中,當創傷弧菌核酸模板濃度為94 ng/μL ~940 fg/μL 時,每個濃度均可在紫外光下觀察到藍綠色且電泳結果也出現階梯狀條帶,當模板濃度降低到94 fg/μL 時未發生顯色反應,說明該體系檢測的靈敏度為940 fg/μL,而常規PCR 檢測的靈敏度為94 pg/μL,表明LAMP 檢測下限比常規PCR 法降低了2 個數量級。LAMP 檢測不需要對模板進行熱變性處理,節省了因溫度循環而消耗的時間,對儀器依賴性小,肉眼檢測即可得出結果,更適合于現場的實地診斷。
綜上所述,該研究開發了一種靈敏、快速、操作簡便的LAMP 通用檢測方法檢測水生生物中的弧菌,而且可以直觀地觀察反應進行情況,便于試驗室快速分析,也適用于養殖場的現場診斷,為實現致病性弧菌的早期診斷和現場即時檢測,從而有效預防和監測因弧菌感染引發的疾病提供了科學有效的方法。

