慢性腎臟病患者腎小球濾過率與甲狀腺素指標的相關性及并發甲狀腺功能異常的危險因素分析
王 潔,楊 勇,余 君
(1.浙江省湖州市第一人民醫院腎臟內科 313000;2.湖北科技學院醫學部健康醫學院,湖北咸寧 437100)
慢性腎臟病(chronic kidney disease,CKD)是指由多種原因(如高血壓、糖尿病、腎小球腎炎等)導致的慢性腎臟結構和功能障礙[1],其腎臟損害病史一般大于3個月[2]。CKD的全球患病率約14.3%,我國患病率約10.8%,且每年以8%的速度上升,該病預后差,治療成本高,是一個全球性的公共衛生問題[3]。甲狀腺激素是一組由甲狀腺濾泡上皮細胞合成的碘甲腺原氨酸,主要包括三碘甲狀腺原氨酸(triiodothyroxine,T3)和四碘甲狀腺原氨酸(tetraiodothyroxine,T4),具有促進生長發育、維持正常新陳代謝和神經系統功能等作用[4]。研究認為甲狀腺激素水平異常可能與CKD的發生和發展有關,腎功能障礙可能改變甲狀腺激素合成、代謝和調節,降低機體甲狀腺激素水平[5]。而甲狀腺功能減退又會降低腎小球濾過率(glomerular filtration rate,GFR),增加CKD發生和發展的風險[6]。本研究通過檢測不同CKD分期患者血清甲狀腺功能指標水平,分析GFR與甲狀腺功能指標之間的關系,探討CKD并發甲狀腺功能障礙的危險因素,為促進CKD的預防和治療,改善預后,提供科學依據,報道如下。
1 資料與方法
1.1 一般資料
選取2020年5月至2021年5月在湖州市第一人民醫院住院治療的CKD患者152例。患者均符合美國腎臟基金會的CKD臨床實踐(K/DOQI)指南[7]中關于CKD的相關診斷標準,均無甲狀腺疾病史。其中男91例,女61例;年齡27~89歲,平均(63.13±14.39)歲;病程0~41年,平均(14.08±5.27)年。患者簽署知情同意書,本研究獲得醫院醫學倫理委員會批準。
1.2 方法
患者入院時,收集臨床基本資料,包括年齡、性別、身高、體重、血壓(收縮壓和舒張壓)、吸煙史、飲酒史以及最早確診時間(計算病程)等指標,同時采集患者空腹靜脈血,分離血清,使用雅培CIL6200全自動生化分析儀檢測血尿素氮(BUN)、血肌酐(Scr)和血尿酸(SUA);使用美國雅培i2000全自動化學發光免疫分析儀檢測血清中總三碘甲狀腺原氨酸(total triiodothyroxine,TT3)、游離三碘甲狀腺原氨酸(free triiodothyroxine,FT3)、總甲狀腺素(total tetraiodothyroxine,TT4)、血清游離甲狀腺素(free tetraiodothyroxine,FT4)及促甲狀腺激素(thyroid stimulating hormone,TSH)的水平。
1.3 觀察指標及評價標準
采用改良MDRD公式[8-10]估算腎小球濾過率(glomerular filtration rate,GFR),并參照GFR值將慢性腎臟病分為5期[2],G1期:GFR≥90 mL·min-1·1.73 m-2,腎功能正常或增高;G2期:GFR 60~<90 mL·min-1·1.73 m-2,腎功能輕度降低;G3期:GFR 30~<60 mL·min-1·1.73 m-2,腎功能中度降低;G4期:GFR 15~<30 mL·min-1·1.73 m-2,腎功能重度降低;G5期:GFR<15 mL·min-1·1.73 m-2,腎衰竭。甲狀腺功能的判定[11-13]:TT3、FT3、TT4、FT4和TSH 5項指標均在正常范圍內則為甲狀腺功能正常,有1項或1項以上指標不在正常范圍內則為甲狀腺功能異常。TT3的正常范圍0.83~2.45 nmol/mL,FT3的正常范圍2.63~5.70 pmol/L,TT4的正常范圍62.68~150.80 nmol/L,FT4的正常范圍9.01~19.05 pmol/L,TSH的正常范圍0.35~4.94 mIU/L。
1.4 統計學處理

2 結 果
2.1 一般資料比較
不同CKD分期患者性別、年齡、病程、體重指數(BMI)和SUA差異無統計學意義(P>0.05),而Scr、BUN和GFR差異有統計學意義(P<0.05),Scr和BUN水平呈遞增趨勢,GFR呈遞減趨勢,見表1。

表1 不同CKD分期患者基本資料比較
2.2 各組患者甲狀腺功能異常率和甲狀腺素水平比較
不同CKD分期患者的甲狀腺功能異常率差異有統計學意義(P<0.05),G5期最高,為39.1%,G1期最低,為8.3%;不同CKD分期患者血清TSH水平差異無統計學意義(P>0.05),而血清TT3、FT3、TT4和FT4水平差異有統計學意義(P<0.05),其中TT3隨G1~G5期呈遞減趨勢,TT4和FT4呈先增后減趨勢,見表2。

表2 不同CKD分期患者的甲狀腺功能和甲狀腺素水平比較
2.3 CKD患者甲狀腺功能正常組與異常組的甲狀腺素水平比較
與甲狀腺功能正常組比較,甲狀腺功能異常組的TT3、FT3、TT4和FT4水平下降,而TSH水平上升(P<0.05),見表3。

表3 CKD患者甲狀腺功能正常組與異常組的甲狀腺素水平比較分析
2.4 CKD患者GFR與甲狀腺激素水平的相關性分析
使用Spearman秩相關檢驗分析患者GFR與甲狀腺激素水平之間的相關性。CKD患者GFR與血清TT3、FT3水平呈正相關(P<0.05),其線性散點圖見圖1、2;與血清TSH水平呈負相關(P<0.05),其線性散點圖見圖3;與血清TT4、FT4水平無直線相關關系(P>0.05),其線性散點圖見圖4、5。
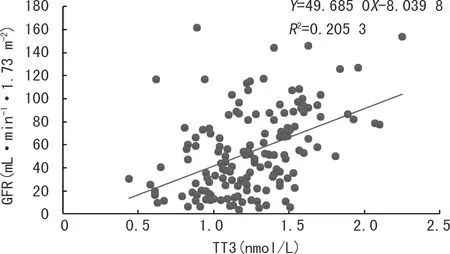
圖1 CKD患者GFR與TT3的相關性散點圖

圖2 CKD患者GFR與FT3的相關性散點圖

圖3 CKD患者GFR與TSH的相關性散點圖

圖4 CKD患者GFR與TT4的相關性散點圖
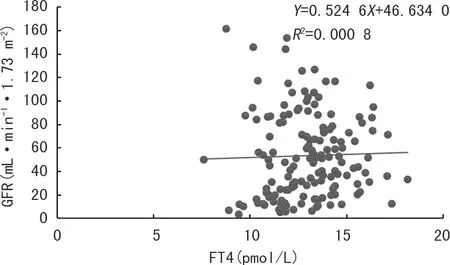
圖5 CKD患者GFR與FT4的相關性散點圖
2.5 CKD患者甲狀腺功能異常的單因素分析
不同性別CKD患者甲狀腺功能異常率有統計學差異,女性高于男性(P<0.05);不同CKD分期患者甲狀腺功能異常率有統計學差異,G3、G4和G5期顯著高于G1和G2期(P<0.05);而不同年齡、病程、體重、吸煙、飲酒和高血壓特征的CKD患者甲狀腺功能異常率無統計學差異(P>0.05),見表4。

表4 CKD患者甲狀腺功能異常的單因素分析

續表4 CKD患者甲狀腺功能異常的單因素分析
2.6 CKD患者甲狀腺功能異常的多因素logistic回歸分析
經二元logistic回歸分析,發現CKD分期為G3~G5期和女性是CKD患者出現甲狀腺功能異常的危險因素,差異有統計學意義(P<0.05);而年齡、病程、體重、是否吸煙、是否飲酒以及是否為高血壓等特征不是導致CKD患者甲狀腺功能異常的因素,差異無統計學意義(P>0.05),見表5。

表5 CKD患者甲狀腺功能異常的多因素logistic回歸分析
3 討 論
甲狀腺激素與人體代謝密切相關,可調節細胞糖類、脂類和蛋白質的合成與分解,具有促進細胞生長、組織形態分化等重要作用[14]。甲狀腺激素T3和T4由甲狀腺上皮細胞合成。生理狀態下,進入血液循環的TT3和TT4大部分(99%以上)會與血漿蛋白(甲狀腺素結合球蛋白)結合,而少部分以FT3和FT4的形式發揮激素作用,到達體細胞與特定受體結合(如甲狀腺素運載蛋白)發揮生理作用[15]。甲狀腺激素和腎臟二者之間相互作用并相互影響:一方面,甲狀腺激素可調節腎臟早期的生長發育、腎小球和腎小管重要功能;另一方面,腎臟又可調節甲狀腺激素的新陳代謝及消除[16]。當腎功能正常時,與血漿蛋白結合的甲狀腺激素不會被腎小球濾過,當發展為CKD時,腎小球濾過膜受損,血漿清蛋白濾過腎小球,機體大量丟失清蛋白,不僅影響甲狀腺激素的合成,還會降低原本合成的甲狀腺激素,最終導致血液甲狀腺激素水平下降[5,17]。本研究結果顯示,隨著GFR的下降,TT3和FT3呈逐漸下降的趨勢,且GFR與TT3、FT3均呈負相關,甲狀腺功能異常組的TT3、FT3、TT4和FT3均顯著降低。原因是CKD會影響甲狀腺功能,持續性腎功能不全可能導致甲狀腺功能減退[18]。在CKD的特殊類型中,如微小變異性腎病綜合征、局灶性節段性腎小球腎炎和膜性腎病,由于患者腎小球濾過膜受損,通常會出現大量蛋白尿,以至于甲狀腺激素可能會漏入尿液丟失[19];同時大量的血漿蛋白丟失會影響甲狀腺激素的合成和儲存;CKD患者腎臟排泄功能出現障礙,會降低無機碘的清除率,過量的碘可經Wolff-Chaikoff效應降低甲狀腺激素的合成[18]。本研究結果與胡蓉等[20]、REINHARDT等[21]和LI等[22]的結果很相似。
TSH被認為是一般人群中最敏感和最特異的甲狀腺功能減退的一項指標[18]。TSH由垂體腺分泌,可調節甲狀腺激素T3、T4的合成和分泌。當血中T3、T4水平降低時,通過反饋作用垂體細胞合成和分泌TSH,進而促進T3、T4的合成[15]。研究表明,即使在正常甲狀腺激素水平下,FT3和FT4水平下降及TSH水平上升可能增加腎病發生的風險[23]。本研究各CKD分期組患者TSH與GFR呈負相關關系,且TSH水平隨GFR的降低而呈升高趨勢,甲狀腺功能異常組的TSH水平顯著上升。TSH水平原因可能是患者腎小球濾過膜受損,體內TT3、FT3漏入尿液丟失、水平下降,進而反饋促進垂體細胞合成TSH;另外患者TSH糖基化不良,失去晝夜節律,生物活性受損也是原因之一;此外,TSH濃度增加還可能和TSH對促甲狀腺激素釋放激素(thyrotropin-releasing hormone,TRH)的反應遲鈍,TSH和TRH清除率下降有關[24-25]。本研究結果與胡愛娥[26]、LI等[22]的研究結果相似。雖然本研究患者CKD各分期TSH水平無統計學差異,但是TSH隨CKD進展呈增加趨勢,無統計學差異原因是本次觀察的樣本含量較少,加上個體間TSH值波動性大,采用正態性檢驗發現TSH值呈偏態分布,只能采用非參數秩和檢驗,導致檢驗效能不如參數檢驗,因此在今后的研究中要進一步增加樣本量,提高檢驗效能。
年齡、性別和CKD進展被認為是患者出現甲狀腺功能異常重要因素[18]。YUASA等[19]的研究顯示,CKD患者的年齡、GFR與甲狀腺功能減退相關,甲狀腺功能減退組患者的年齡顯著大于對照組,而GFR則顯著低于對照組;多因素分析結果顯示,高年齡(OR=1.04,95%CI:1.01~1.07)是CKD患者并發甲狀腺功能減退的危險因素,但是較高的GFR(OR=0.96,95%CI:0.95~0.99)是保護因素。HUANG等[27]的研究表明,55歲及以上的人群中,患有甲狀腺功能減退癥的人更容易患CKD,甲狀腺功能低下(OR=1.59,95%CI:1.52~1.66)和甲狀腺功能減弱(OR=1.12,95%CI:1.08~1.16)是CKD的危險因素。本研究未發現55歲及以上CKD患者甲狀腺功能異常率顯著高于55歲以下,原因可能是55歲以下患者人數偏少(44例),存在一定的選擇偏倚。一般認為,女性甲狀腺功能減退的發病率高于男性[28]。CHUANG等[29]的回顧性隊列研究表明,女性亞臨床甲狀腺功能減退與CKD風險增加相關(HR=1.22,95%CI:1.08~1.39)。本研究女性CKD患者甲狀腺功能異常率高于男性,與相關研究報道一致。CKD的進展與甲狀腺功能障礙有關。KHATIWADA等[30]的橫斷面研究結果表明,CKD 4期和5期CKD患者發生甲狀腺功能障礙的風險明顯高于3期患者,多因素分析結果顯示4期(OR=2.1,95%CI:1.28~3.42)和5期(OR=3.64,95%CI:1.94~6.85)CKD患者是甲狀腺功能障礙的危險因素。本研究發現CKD 3~5期是甲狀腺功能障礙的危險因素,與KHATIWADA等[30]的結果很相似。
多項臨床流行病學研究結果提示,不同程度甲狀腺功能異常與腎功能異常的發生、發展密切相關[31-33]。甲狀腺功能的下降可能會對CKD患者的腎臟造成進一步的損害。甲狀腺激素不足會影響蛋白質合成和細胞發育,導致腎臟變小[6]。另外,甲狀腺激素不足還可能降低腎臟血流量,進而誘發一系列并發癥,例如腎小球出現基底膜增厚、毛細血管壓增高和濾過膜損傷,以及腎小管排泄功能受損等問題[17]。甲狀腺功能異常在不需要長期透析治療的CKD患者中比較普遍,在不需要腎臟替代治療的CKD患者中,亞臨床甲狀腺功能減退和臨床甲狀腺功能減退的發生率約為18%~20%[18,34]。本研究CKD患者的甲狀腺功能總異常率為23.7%,其中G5期患者高達39.1%,甲狀腺功能異常發生率較高,說明CKD患者的甲狀腺功能異常是臨床常見并發癥,提示臨床醫生和護士應及時關注患者的甲狀腺功能,觀察甲狀腺激素水平波動對觀察患者病情進展的影響,結合患者游離T3和TSH情況進行干預,必要時進行營養干預,再考慮甲狀腺素補充治療。
本研究有一定的局限性,首先,這是一項橫斷面研究,因此無法確定因果關系;其次,研究數據不是全面篩查所得,因此可能高估了CKD患者中甲狀腺功能異常的真實患病率;最后,本研究缺乏關于CKD患者甲狀腺功能異常可能病因的詳細信息(如抗甲狀腺抗體、尿蛋白等)的測量,在解釋具體的發生機制方面缺乏證據。因此,今后可開展前瞻性隊列研究,闡明甲狀腺素與腎小球濾過率之間的作用關系,并更好地了解CKD患者中甲狀腺功能異常的真實患病率。
綜上所述,不同分期CKD患者血清甲狀腺功能指標可出現不同程度改變,CKD女性患者更易出現甲狀腺功能異常。建議臨床醫生密切監測CKD患者血清甲狀腺功能指標的水平,研究患者腎功能與甲狀腺功能之間的相互關系,未來使用更多明確的證據證實甲狀腺激素替代治療甲狀腺功能減退能否改善CKD預后。

