硫酸氨基葡萄糖脂質體的制備及其對骨關節炎的治療作用
紀帥帥, 閆潔, 王子吟, 楊夢婷, 胡嫚, 霍強, 程秀
(蚌埠醫學院藥學院藥物化學教研室,安徽 蚌埠 233030)
骨關節炎是一種常見的慢性疾病,據統計,我國約有50%的中老年人患有骨關節炎,這對于一個擁有2.6億中老年人的國家而言,對骨關節炎的治療刻不容緩[1]。目前還沒有較好的骨關節炎的治療手段,主要是以對癥治療為主,表現為緩解患者的疼痛、延緩關節軟骨退變、提高患者的生活質量等[2]。因此,開發有效的治療方法尤為重要。在目前的骨關節炎治療方法中,局部關節腔內注射給藥比口服給藥更有效,因為其降低了全身毒性[3]。但是,關節腔內注射給藥也有缺點,包括藥物停留時間短,藥物在關節腔中的濃度過高等[4]。因此,為了提高關節腔內注射給藥的治療效果,將抗炎藥物納入載體,實現藥物的長期持續釋放是一個可行的策略[5]。脂質體是一種優良的藥物載體,具有毒性低和生物相容性高等優點[6]。作為一種成熟的納米技術,已有多種相關制劑上市用于治療各類疾病[7]。硫酸氨基葡萄糖(glucosamine sulfate,GAS)作為一種廣泛用于骨關節炎的抗炎和軟骨保護的藥物,具有刺激軟骨細胞外基質的蛋白多糖和膠原合成,抑制促炎因子分泌的作用[8]。通常,GAS作為口服藥物使用,口服生物利用度僅為10%左右,治療效果不顯著。直接用于關節腔給藥,也存在局部濃度過高和停留時間短等問題[9]。本研究利用氫化磷脂酰膽堿構建包載GAS的脂質體(GAS-Lips),避免了口服利用度低與局部注射滯留時間短等缺點。GAS-Lips在關節腔內緩慢而持續地釋放GAS,并具有一定的潤滑性,能夠延緩關節磨損,發揮治療作用,為骨關節炎納米制劑的開發提供研究基礎。
1 材料與方法
1.1 主要試劑和儀器
氫化磷脂酰膽堿、膽固醇、十八胺、GAS、Cy3熒光染料(上海阿拉丁試劑有限公司);三氯乙醛水合物(上海麥克林生化科技有限公司);注射用青霉素鈉(江西省科達動物藥業有限公司);肝素鈉(辰欣藥業股份有限公司);大鼠TNF-α、IL-6 ELISA試劑盒(上海碧云天生物技術有限公司)。
馬爾文粒度分析儀(英國馬爾文儀器有限公司);UV-2700紫外可見分光光度計(島津儀器蘇州有限公司);WS-900恒溫搖床(北京維根技術有限公司);Tanon ABL X6動物活體成像分析儀(上海天能科技有限公司)。
1.2 動物培養
SPF級4周齡雄性SD大鼠,體重140~160 g,由湖南斯萊克景達實驗動物有限公司提供,飼養于蚌埠醫學院實驗動物中心,并獲得蚌埠醫學院實驗動物中心倫理批準。
1.3 制備GAS-Lips
精密稱取處方量的氫化磷脂酰膽堿30 mg,稱取膽固醇2 mg,分別溶于適量無水乙醇中,將其加入到50 mL的茄形瓶中旋轉蒸發成膜后,置真空干燥器中放置2 h,分別加入0.3 mL(1 mg/mL)十八胺和含有1 mg GAS的 pH 7.4 磷酸鹽緩沖液6 mL于茄形瓶中,充入氮氣密封并置于搖床中水化15 min,探頭超聲水浴10 min制備得到脂質體。
1.4 GAS-Lips的表征
1.4.1 脂質體和GAS-Lips粒徑分布及Zeta電位考察 取制備好的脂質體和GAS-Lips溶液,適度稀釋后,置于馬爾文四通石英樣品池中,采用DLS Zetasizer Nano-90測量樣品的粒徑和Zeta電勢,每次測量重復3次。
1.4.2 脂質體和GAS-Lips形態學考察 制備適宜濃度的脂質體和GAS-Lips溶液,分別取10 μL滴加在200目有碳支持膜的銅網上,常溫放置2 h,干燥后用透射電子顯微鏡觀察樣品的形態。
1.5 GAS-Lips的制劑學評價
1.5.1 GAS檢測波長的確定 稱取一定質量的GAS,去離子水稀釋至適宜濃度,紫外分光光度計檢測波長在200~600 nm時的最大紫外吸收峰。
1.5.2 標準曲線的制備 精密稱取2.5 g GAS,去離子水溶解后轉移至25 mL容量瓶中定容,配制成濃度為100 mg/mL的GAS儲備液。用移液管精密量取0.25、0.5、1.0、1.5、2.0、2.5 mL儲備液置于25 mL容量瓶中,稀釋定容得到濃度為10、20、40、60、80、100 mg/mL的標準溶液。以去離子水溶液作為空白對照,測定各標準溶液275 nm處光密度(D)值。以GAS的濃度為橫坐標,D值為縱坐標,繪制GAS標準曲線。
1.5.3 包封率與載藥量的測定 包封率和載藥量是評價納米遞藥系統處方及制備工藝的兩個重要指標。通過薄膜分散法用不同濃度GAS制備GAS-Lips,在4 ℃條件下以12 000 r/min離心20 min,收集上清液,通過紫外分光光度計在275 nm處測定相對應的D值,按下列公式計算包封率和載藥量:
包封率/%=(Wtotal-Wfree)/Wtotal×100%
載藥量/%=(Wtotal-Wfree)/Ntotal×100%
其中,Wtotal是系統中的藥物總質量;Wfree是溶液中游離的藥物總質量,Ntotal是總納米粒的質量。
1.5.4 釋藥性分析 采用動態膜透析法研究GAS-Lips的體外釋放行為。精密吸取一定量的GAS和GAS-Lips,加到截留分子量為3 500 Da透析袋中,再將透析袋放入含有100 mL pH 7.4的磷酸鹽緩沖液的燒杯中,并在37 ℃恒溫搖床中以100 r/min進行體外釋放實驗。于0.5、1、2、4、6、8、10、12 h分別取樣2 mL并補充相同體積的磷酸鹽緩沖液,4 ℃條件下8 000 r/min離心10 min收集上清液。所取樣品用紫外分光光度計在275 nm處測定D值,并帶入“1.5.2”標準曲線計算累積釋放量。
1.6 體內滯留性考察
將Cy3與Cy3-Lips注射到膝關節腔后,分別在1、6、12 h時使用動物活體成像分析儀觀察Cy3與Cy3-Lips在大鼠膝關節部位的熒光信號分布,并進行半定量分析。
1.7 GAS-Lips的體內藥效評價
對飼養1周后的大鼠進行前交叉韌帶橫斷術(anterior cruciate ligament transection,ACLT),構建大鼠骨關節炎模型。通過水合氯醛麻醉大鼠,并對其腿部進行剃毛。找到髕韌帶與副韌帶中間的位置,切開關節囊,找到關節腔所在部位,將脛骨向內側進行錯位。用剪刀將前交叉韌帶剪斷,后將髕韌帶復位并縫合,最后肌肉注射青霉素抗菌,連續3 d。實驗分為4組,分別為假手術組、ACLT+未給藥組、ACLT+GAS組、ACLT+GAS-Lips組,每組6只,共24只。實驗周期為8周,手術后第3周的第1天開始關節腔注射給藥,每周給藥1次,1次100 μL(5 mg/kg),共給藥6次。
1.7.1 治療過程中大鼠體重稱定 從第1次給藥開始稱量各組大鼠體重并記錄,之后每周測定大鼠體重變化,持續6周,以時間為橫坐標,體重為縱坐標,繪制大鼠體重變化曲線。
1.7.2 關節炎大鼠膝關節部位離體形態觀察 給藥6周后,處死骨關節炎大鼠,觀察膝關節部位形態變化,并剪除周圍肌肉與筋膜組織,用磷酸鹽緩沖液清洗干凈,拍照記錄。
1.7.3 Micro-CT觀察膝關節軟骨損傷變化 給藥6周后,處死并切取骨關節炎大鼠的后肢,磷酸鹽緩沖液沖洗干凈后立即用4%多聚甲醛固定,用Micro-CT對樣品進行成像。
1.7.4 ELISA法檢測大鼠血清中炎癥因子的表達差異 給藥6周后,通過大鼠眼眶取血。每只大鼠眼眶取血1~2 mL。將裝有血樣的EP管于4 ℃條件下5 000 r/min離心20 min,收集上清液。按照ELISA試劑盒進行實驗,在450 nm處測定D值,計算血清中TNF-α、IL-6的含量。
1.8 統計學分析
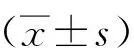
2 結果
2.1 GAS-Lips的表征
2.1.1 脂質體和GAS-Lips粒徑分布及Zeta電位檢測 粒徑和Zeta電位結果如圖1所示。脂質體和GAS-Lips粒徑分別為(220.24±2.82)nm和(255.02±3.64)nm,隨著GAS加入,粒徑增大,表明藥物成功載入脂質體中。由于氫化磷脂酰膽堿與膽固醇形成的脂質體表面攜帶少量負電荷,而GAS是一種帶正電荷的單糖,與所形成的脂質體結合,逆轉脂質體表面的負電荷,因此GAS-Lips脂質體Zeta電勢為正電荷。

圖1 空脂質體與載藥脂質體粒徑分布與Zeta電勢
2.1.2 脂質體和GAS-Lips形態學考察 透射電鏡結果如圖2所示,脂質體呈球形或類球形,無粘連,分散均一。空白脂質體粒徑為(163.25±2.91)nm,GAS-Lips粒徑為(214.56±3.76)nm。在脂質體制備過程中,粒徑增大,說明GAS載入脂質體中。

圖2 脂質體和GAS-Lips透射電鏡結果
2.2 GAS-Lips的制劑學評價
2.2.1 GAS檢測波長的確定 紫外可見分光光度計掃描200~600 nm波長范圍內紫外吸收,結果如圖3所示,確定其紫外吸收峰在275 nm處。

圖3 GAS紫外吸收峰
2.2.2 GAS標準曲線的建立 以GAS的濃度為橫坐標,D值為縱坐標,對測定結果做線性回歸曲線,得到GAS的標準曲線。如圖4所示,GAS的標準曲線為y=0.003 6x-0.003 1,R2=0.999 6,GAS濃度在0~100 mg/mL范圍內線性關系良好。

圖4 GAS標準曲線
2.2.3 GAS-Lips載藥量和包封率的測定 如圖5所示,在GAS低濃度時,具有較高的包封率和較低的載藥量。隨著GAS濃度的增加,GAS-Lips的載藥量逐漸增加,包封率下降明顯,但載藥量增加到一定程度后幾乎不變,說明脂質體載藥量有限。在不改變配方的前提下,比較不同濃度GAS對載藥量和包封率的影響,GAS濃度為4 mg/mL時,具有較高的包封率和載藥量,分別為(78.62±1.01)%和(9.90±0.75)%,所以選擇GAS濃度為4 mg/mL用于后續實驗。

圖5 GAS-Lips載藥量和包封率的測定
2.2.4 釋藥性分析 采用動態膜透析法研究制劑的體外釋放行為,結果如圖6所示,GAS在pH 7.4的磷酸鹽緩沖液中,以快速方式進行釋放,2 h累計釋放量達到(99.61±0.63)%,基本全部釋放。相比于GAS,GAS-Lips在溶液中釋放速率緩慢,2 h累計釋放量為(48.57±2.01)%,12 h累計釋放量為(88.62±1.06)%,表明脂質體作為藥物載體具有一定的緩釋作用。

圖6 GAS-Lips體外釋放曲線
2.3 體內滯留性考察
熒光信號圖以及半定量結果如圖7所示,Cy3與Cy3標記的脂質體在1 h均在大鼠膝關節部位呈現較強的熒光強度,隨著時間的延長熒光強度逐漸減弱。與Cy3組相比,Cy3-Lips組在6 h和12 h時平均熒光強度增加,差異均有統計學意義(P<0.01)。表明脂質體可以增加藥物在關節腔部位的黏附和滯留性。

圖7 大鼠膝關節熒光信號以及半定量結果
2.4 體內實驗
2.4.1 治療過程中大鼠體重變化 各組大鼠體重變化曲線如圖8所示,各組大鼠生長狀況良好,體重穩定上升,給藥組大鼠與假手術組相比沒有明顯差異。

圖8 給藥過程中大鼠體重變化
2.4.2 大鼠膝關節離體形態考察 如圖9所示,假手術組大鼠膝關節軟骨損壞較輕,表面相對光滑,周圍無骨贅形成;與假手術組比較,其余各組大鼠關節軟骨出現損壞,表面出現不光滑現象。其中ACLT+未給藥組周圍骨贅生成明顯、軟骨損壞程度最高、表面更粗糙;與ACLT+未給藥相比,ACLT+GAS組與ACLT+GAS-Lips組軟骨損壞程度輕。與ACLT+GAS組相比,ACLT+GAS-Lips組軟骨表面損傷程度較輕,表面更光滑,表明GAS-Lips具有治療骨關節炎的作用,效果比游離藥物好。

圖9 大鼠膝關節形態圖
2.4.3 關節Micro-CT成像 如圖10所示,與其他各組相比,假手術組大鼠關節面軟骨表面較完整,表層基質塌陷區域最少,關節表面相對光滑。與假手術相比,ACLT+未給藥組表層基質塌陷區域最多,軟骨結構損傷嚴重,ACLT+GAS-Lips組和ACLT+GAS組軟骨表面表層基質塌陷區域較少,軟骨結構破壞較輕。與ACLT+GAS組相比,ACLT+GAS-Lips組軟骨表面更光滑,表明GAS-Lips具有良好的治療骨關節炎的作用。

圖10 關節Micro-CT成像
2.4.4 大鼠血清中炎癥因子的表達差異 ELISA法檢測大鼠血清中TNF-α、IL-6表達水平,見圖11。與ACLT+GAS-Lips組相比,ACLT+未給藥組和ACLT+GAS組炎癥因子TNF-α、IL-6表達均增高,差異有統計學意義(P均<0.01)。表明GAS-Lips具有良好的抗炎作用,利于骨關節炎的治療。

圖11 大鼠血清中TNF-α、IL-6的含量
3 討論
骨關節炎是一種嚴重影響患者生活質量的關節退行性疾病,伴有關節軟骨侵蝕、硬化、滑膜炎癥、骨贅(骨刺)和顯著的骨質改變[10]。目前構建骨關節炎模型的方法主要有關節腔注射藥物(Ⅱ型膠原酶、木瓜蛋白酶、完全弗氏佐劑等)和手術(前交叉韌帶切除術、半月板切除術等)兩種,由于藥物注射成功率低,不穩定[11],因此本研究采用前交叉韌帶剪斷的方法構建大鼠骨關節炎模型。
炎癥因子過表達會加劇軟骨的退變,關節腔內炎癥反應產生的TNF-α、IL-6會加劇組織的損傷,因此,抑制TNF-α、IL-6等炎癥因子的過表達有利于骨關節炎的修復。GAS是一種帶電荷的氨基單糖,通過抑制疼痛相關基因和基質金屬蛋白酶的活性,降低促炎因子的分泌水平,廣泛用于骨關節炎的治療[12]。在退行性關節疾病中,含有脂質體納米顆粒的藥物在骨關節炎治療中的作用已被廣泛研究。脂質體是一種優良的藥物載體,具有穩定藥物物理化學性質、增加藥物攝取、延長藥物釋放等多種優勢[13-14]。但是部分脂質體由于載藥量低,限制了其在骨關節炎方面的臨床治療,因此,制備更有效的載藥脂質體納米粒子可以為臨床治療骨關節炎提供良好的基礎。本文所制備的GAS-Lips與其他脂質體相比,具有較高的載藥量以及良好的緩釋效果。局部注射脂質體,可以更好地增加游離藥物的靶向性和滯留性,減少藥物體內代謝,達到更好的治療效果。
本研究選取氫化磷脂酰膽堿與膽固醇作為制備脂質體的材料,其具有一定的潤滑和延緩關節磨損的作用,同時采用常規骨關節炎治療藥物GAS,通過降低促炎因子分泌的作用,達到保護軟骨和抗炎的作用。
總之,本研究通過薄膜分散法制備脂質體,制備工藝較為簡單。負載游離藥物GAS,增加藥物在骨關節炎部位的緩釋作用,增強藥效,為骨關節炎藥物的開發提供研究基礎。

