全球新型冠狀病毒肺炎治療藥物臨床試驗注冊現狀調查*
盧 巖,陳 娟,嚴 舒,楊瀟逸,歐陽昭連
(中國醫學科學院醫學信息研究所,北京 100020)
2020年3月11日,世界衛生組織(WHO)評估認為新型冠狀病毒肺炎(簡稱新冠肺炎)具有大流行特征。截至2022年5月11日,全球新冠肺炎確診病例超5.18億,死亡人數超625萬[1],造成了前所未有的公共衛生和經濟危機。新冠肺炎流行伊始,全球各國相繼啟動新冠肺炎治療藥物研發、篩選和臨床研究工作,涵蓋化學藥(阻止病毒進入宿主細胞的藥物、阻斷病毒復制過程的藥物和阻斷病毒蛋白生成的藥物等)、中藥(口服制劑、注射劑等)和生物制品(重組蛋白質與多肽藥物、抗體治療和細胞治療等)[2]。目前,美國食品藥物管理局(FDA)已批準或緊急使用授權(EUA)吉利德公司的瑞德西韋、輝瑞公司的Paxlovid和羅氏制藥公司的托珠單抗等多款新冠肺炎治療藥物,我國國家藥品監督管理局(NMPA)于2021年12月8日應急批準騰盛華創醫藥技術(北京)有限公司安巴韋單抗(BRII-196)和羅米司韋單抗(BRII-198)聯合療法的注冊審批,上述兩藥成為我國首款獲批的自主知識產權新型冠狀病毒中和抗體聯合治療藥物;此外,歐盟、日本等國家/地區已批準包括瑞德西韋等在內的多款新冠肺炎治療藥物。藥物臨床試驗的目的是確定藥物的療效與安全性,是新藥獲批上市的最關鍵一步。現基于ClinicalTrials.gov臨床試驗注冊數據,調查新冠肺炎治療藥物臨床試驗注冊情況,梳理獲批的新冠肺炎治療藥物的臨床試驗證據,為該類藥物研發和臨床應用提供參考。現報道如下。
1 資料與方法
1.1 數據來源
檢索策略:以“COVID-19”和“(Drug OR(Biological NOT(Biological sample OR Biological sampling OR Biological collection OR Biological hazard OR Biological data)))NOT(Vaccine OR Dietary Supplement OR Diagnostic Test)”為檢索式,分別輸入ClinicalTrials.gov[3-6]的“Condition or disease”和“Intervention/treatment”字段,進行合并檢索,納入所有國家/地區的數據,檢索日期為2021年12月10日。
納入標準:受試者為新冠肺炎患者,干預措施為藥物,包括化學藥、中藥和治療用生物制品,主要目的為治療新冠肺炎。
排除標準:受試者為新冠肺炎患者,但干預措施是維生素、益生菌等膳食補充劑,針灸、瑜伽及虛擬護理和遠程監控等行為干預,或血液等生物樣本采集且主要目的為診斷新冠肺炎;受試者為新冠肺炎合并糖尿病、高血壓等其他疾病患者,研究目的為評估藥物治療其他疾病的療效;擴展使用(針對患有立即威脅生命的疾病或嚴重疾病/癥狀的患者獲得試驗性醫療產品,在沒有可比較或令人滿意的替代療法可供選擇時,用于臨床試驗以外的治療[7]);其他不符合納入標準的臨床試驗。
1.2 方法
采用文獻計量學方法,借助Excel軟件,從臨床試驗注冊數量年度分布、地區和國家分布、申辦者類型構成、試驗完成情況及結果發布情況、研究類型及方法等角度,調查全球新冠肺炎治療藥物臨床試驗注冊情況;采用文獻調研法,梳理安巴韋單抗和羅米司韋單抗聯合療法、莫努匹韋、瑞德西韋和Paxlovid等新冠肺炎治療藥物獲批時依據的臨床試驗。
本研究定義的臨床試驗年份是指試驗開始年份,地區和國家是指臨床試驗開展地,試驗完成情況、結果發布情況、研究類型及方法根據ClinicalTrials.gov中相應字段,其將試驗分期劃分為0期、Ⅰ期、Ⅰ/Ⅱ期、Ⅱ期、Ⅱ/Ⅲ期、Ⅲ期、Ⅳ期及N/A(未能明確分期)。本研究中將Ⅰ/Ⅱ期和Ⅱ期合并為Ⅱ期,Ⅱ/Ⅲ期和Ⅲ期合并為Ⅲ期。
2 結果
2.1 檢索結果
初始獲得新冠肺炎治療藥物臨床試驗2 328項,最終納入1 861項,占ClinicalTrials.gov中新冠肺炎相關臨床試驗的26.13%。詳見圖1。
2.2 新冠肺炎治療藥物臨床試驗注冊情況
年度分布及地區分布:截至2021年12月10日,在ClinicalTrials.gov注冊的新冠肺炎治療藥物臨床試驗共1 861項,其中70.55%開始于2020年,54.70%開展于美洲,與全球新冠肺炎確診病例分布情況基本一致,詳見表1(由于部分臨床試驗開始年份數據缺失,故“年度分布”項僅展示2020年及2021年的數據;由于有國際多中心臨床試驗,同一臨床試驗在不同地區會重復統計,故不同地區的臨床試驗存在重疊)。全球共103個國家開展新冠肺炎治療藥物臨床試驗,其中美國、巴西、西班牙和法國開展臨床試驗數量均超過100項,我國以92項暫居第6。詳見表2。
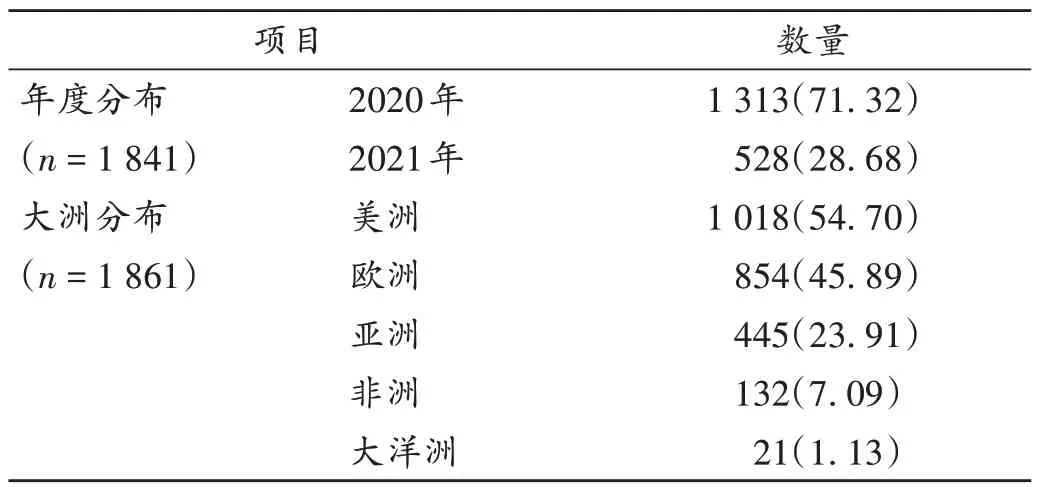
表1 全球新冠肺炎治療藥物臨床試驗注冊數量年度及地區分布[項(%)]Tab.1 Annual and regional distribution of the number of clinical trial registrations of anti-COVID-19 drugs in worldwide[item(%)]
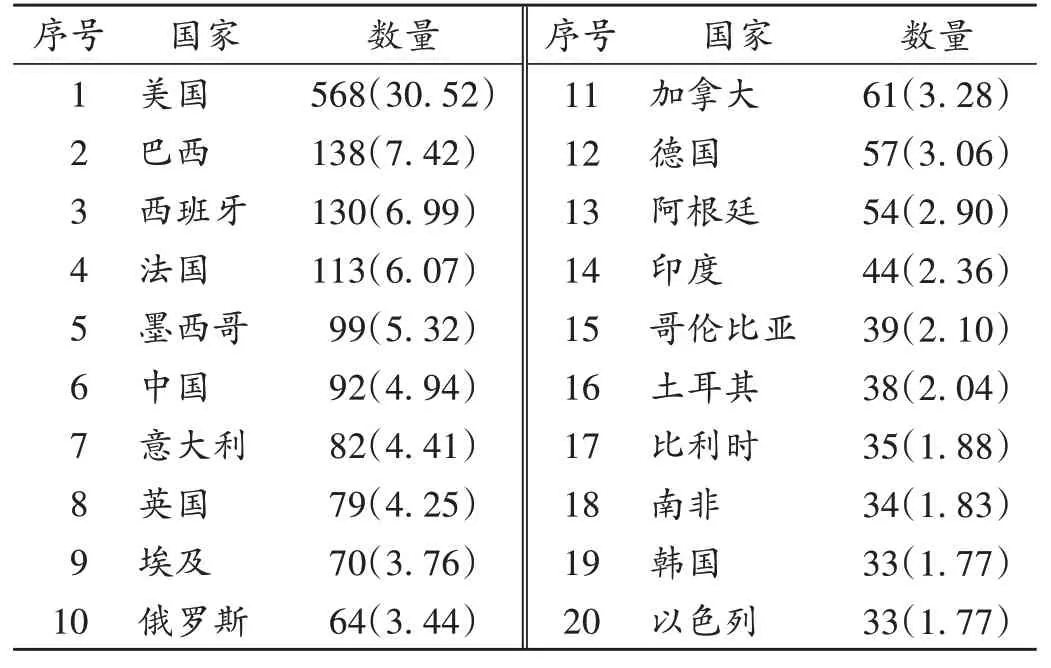
表2 全球新冠肺炎治療藥物臨床試驗注冊數量排名前20的國家[項(%),n=1 861]Tab.2 Top 20 countries in worldwide in terms of the number of clinical trial registrations of anti-COVID-19 drugs[item(%),n=1 861]
申辦者類型構成:全球共1 153個機構、組織或個人發起新冠肺炎治療藥物臨床試驗,48.22%是高校/醫院,34.26%是企業,詳見圖2。巴黎公共援助醫院(法國)、坦塔大學(埃及)、美國國家過敏和傳染病研究所(美國)等多所高校/醫院積極發起新冠肺炎治療藥物臨床試驗。Sorrento Therapeutics公司(美國)、再生元制藥公司(美國)、輝瑞公司(美國)等多家企業加入新冠肺炎治療藥物的研發行列,并發起多項臨床試驗。
完成及結果發布情況:1 861項新冠肺炎治療藥物臨床試驗中,26.11%已完成,4.73%已在ClinicalTrials.gov中發布結果,詳見表3。已發布結果的新冠肺炎治療藥物臨床試驗的主要完成日期和發布日期的間隔中位數為8個月,明顯短于該數據庫中所有已發布結果的臨床試驗的2個日期間隔的中位數(2.0年)[8]。究其原因,為使臨床試驗結果更快、更大范圍地指導新冠肺炎臨床治療,臨床試驗責任方加快了結果提交,同時/或者美國國家醫學圖書館(NLM)加速了結果審查及發布。

表3 全球新冠肺炎治療藥物臨床試驗完成及結果發布情況[項(%),n=1 861]Tab.3 Status of completion and results release of anti-COVID-19 drugs in worldwide[item(%),n=1 861]
研究類型及方法:1 861項新冠肺炎治療藥物臨床試驗中,95.06%是實驗性研究,其中79.96%是隨機對照試驗,循證醫學證據級別高。在1 769項新冠肺炎治療藥物實驗性研究中,792項處于Ⅱ期,533項處于Ⅲ期。多個臨床試驗機構合作可提高臨床試驗結果可信度及臨床試驗效率[9],全球新冠肺炎治療藥物臨床試驗中有38.85%為多中心試驗,詳見表4。參加機構最多的臨床試驗有366個機構;有9.67%為國際多中心臨床試驗,參與國家最多的臨床試驗有29個國家。
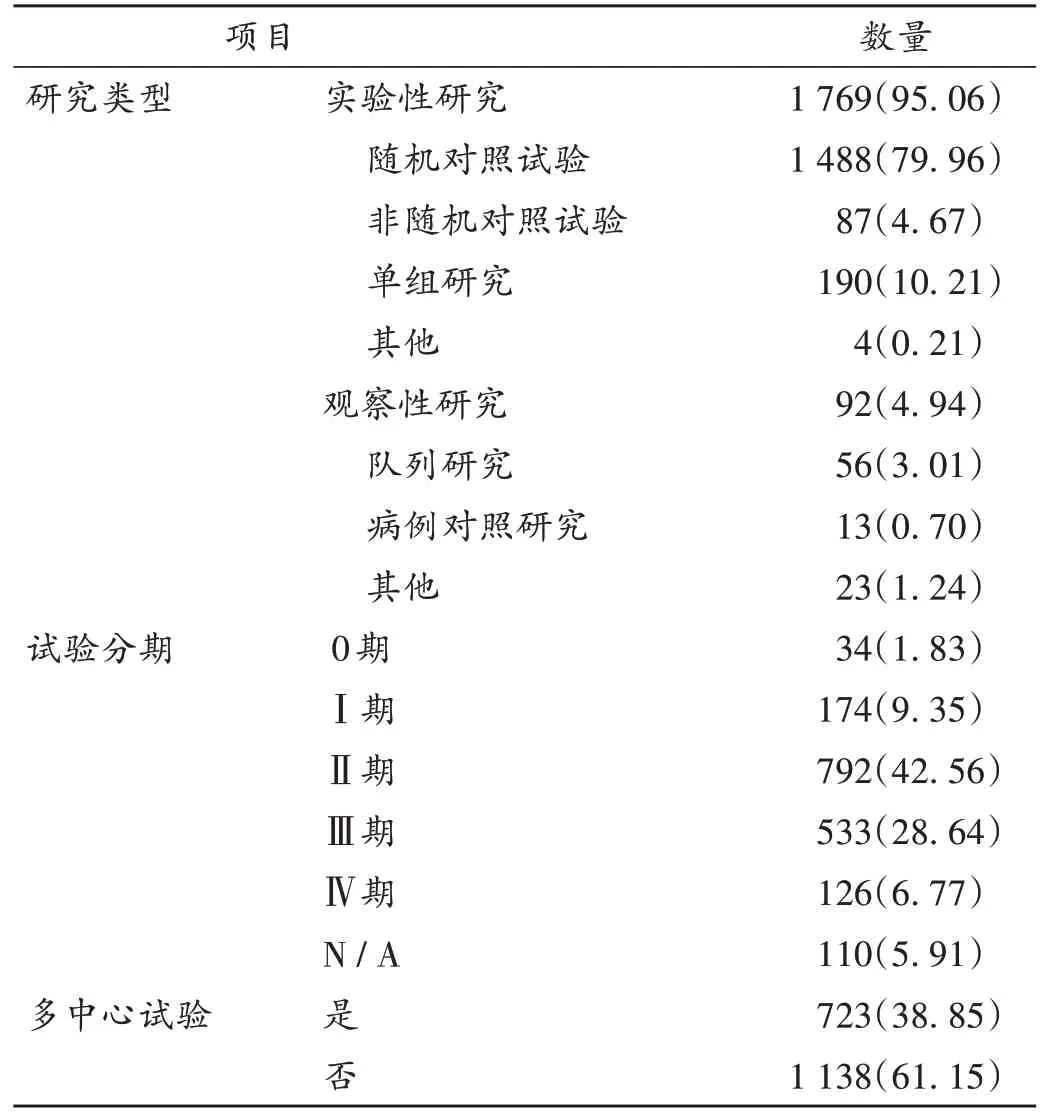
表4 全球新冠肺炎治療藥物臨床試驗研究類型及方法[項(%),n=1 861]Tab.4 Study types and design of clinical trials of anti-COVID-19 drugs in worldwide[item(%),n=1 861]
2.3 新冠肺炎治療藥物審批的臨床試驗證據
正式批準上市的藥品:1)安巴韋單抗和羅米司韋單抗聯合療法于2021年12月8日在我國獲批上市,依據為一項隨機對照試驗[10]。2)莫努匹韋于2021年11月4日在英國獲批上市,成為第一個獲批治療新冠肺炎的口服抗病毒藥物,依據為一項隨機對照試驗[11]。3)瑞德西韋于2020年10月22日在美國獲批上市,成為第一個獲批治療新冠肺炎的藥物,依據為3項隨機對照試驗[12],其中1項臨床試驗結果發表于《美國醫學會雜志》,2項臨床試驗結果發表于《新英格蘭醫學雜志》。詳見表5。

表5 全球正式批準上市的新冠肺炎治療藥物臨床試驗證據Tab.5 Evidences of clinical trials for anti-COVID-19 drugs officially approved for marketing in worldwide
獲得EUA的藥品:1)Paxlovid于2021年12月22日在美國獲得EUA,依據為一項隨機對照試驗[14]。2)托珠單抗于2021年6月24日在美國獲得EUA,依據為4項隨機對照試驗[15],其中1項臨床試驗結果發表于《柳葉刀》,2項臨床試驗結果發表于《新英格蘭醫學雜志》。3)索托維單抗于2021年5月26日在美國獲得EUA,依據為1項隨機對照試驗[16],其臨床試驗結果發表于《新英格蘭醫學雜志》。4)巴尼韋單抗和埃特司韋單抗雙抗體療法于2021年2月9日在美國獲得EUA,依據為2項隨機對照試驗[17],臨床試驗結果分別發表于《新英格蘭醫學雜志》《美國醫學會雜志》。5)REGEN-COV于2020年11月21日在美國獲得EUA,依據為2項隨機對照試驗[18],臨床試驗結果均發表于《新英格蘭醫學雜志》。6)巴瑞替尼+瑞德西韋聯合治療于2020年11月19日在美國獲得EUA,2021年7月28日,FDA對此進行修訂,授權巴瑞替尼單獨用于治療新冠肺炎患者,依據為2項隨機對照試驗[19],臨床試驗結果分別發表于《新英格蘭醫學雜志》《柳葉刀-呼吸醫學》。詳見表6。
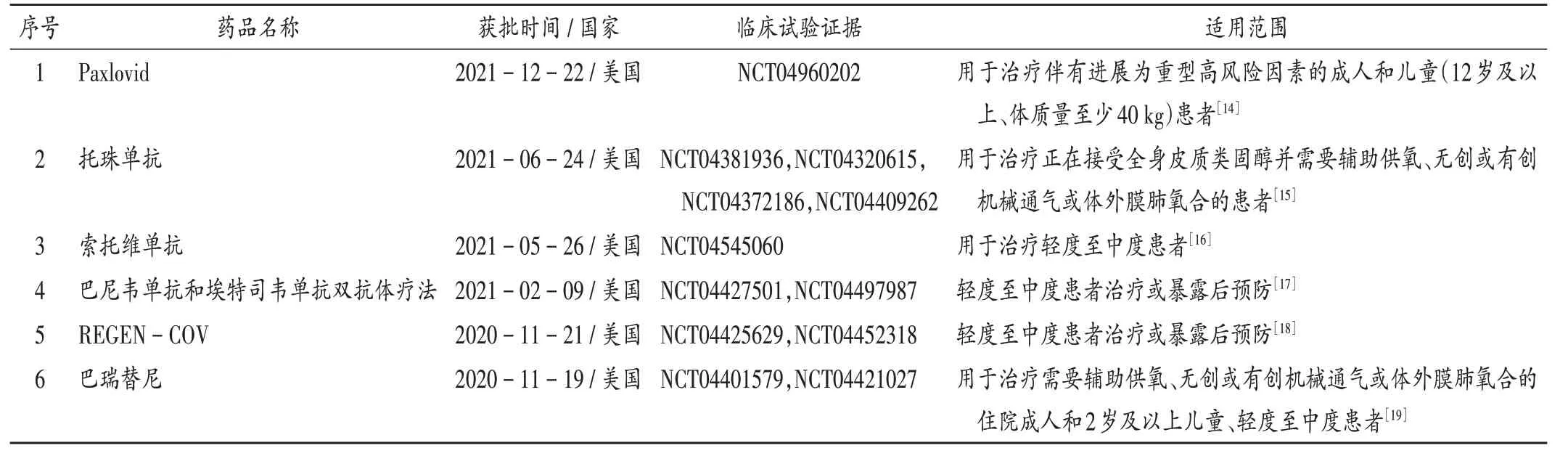
表6 全球獲得EUA的新冠肺炎治療藥物臨床試驗證據Tab.6 Evidences of clinical trials for anti-COVID-19 drugs obtained EUA in worldwide
3 討論
為應對新型冠狀病毒的快速突變,除堅持做好個人防護并接種新型冠狀病毒疫苗外,開展新冠肺炎治療藥物臨床試驗以盡快發現有效治療藥物至關重要。本研究結果顯示,全球超1/4的新冠肺炎相關臨床試驗是評估新冠肺炎治療藥物的安全性和有效性,“老藥新用”和創新藥物研發兩種思路在新冠肺炎治療藥物臨床試驗中均有體現。
臨床試驗注冊情況,新冠肺炎治療藥物臨床試驗多始于2020年,開展于美洲,其中美國數量最多;新冠肺炎治療藥物臨床試驗申辦者以高校/醫院為主,企業表現較突出;在新冠肺炎治療藥物臨床試驗中,超1/4已完成,已完成臨床試驗中約1/5提交了臨床試驗結果;絕大多數新冠肺炎治療藥物臨床試驗是實驗性研究,其中Ⅱ期臨床試驗數量最多,Ⅲ期臨床試驗數量接近1/3。需關注的是,多中心試驗在新冠肺炎治療藥物臨床試驗中占比較大(約1/10為國際多中心臨床試驗)。
關于藥物審批的臨床試驗證據,安巴韋單抗和羅米司韋單抗聯合療法、莫努匹韋、瑞德西韋等新冠肺炎治療藥物的獲批,至少依據了1項Ⅲ期臨床試驗結果數據。
本研究的局限性在于,僅從ClinicalTrials.gov中提取新冠肺炎治療藥物臨床試驗注冊數據。該數據庫存在檢索字段不完整、大部分信息非結構化等問題,加之部分臨床試驗研究者選擇在WHO國際臨床試驗注冊平臺的一級注冊中心(包括中國臨床試驗注冊中心)、Citeline Trialtrove等臨床試驗注冊平臺進行注冊[20],因此本研究中依據的臨床試驗數據集未能包含全球所有的新冠肺炎治療藥物臨床試驗,研究結果或與真實世界研究存在偏差。但本研究中分析了全球新冠肺炎治療藥物臨床試驗注冊概況,并梳理出新冠肺炎治療藥物審批所依據的臨床試驗,可為企業進行新冠肺炎治療藥物研發,醫師開展新冠肺炎治療藥物臨床研究,資助機構進行研究資金有效分配,以及公眾了解新冠肺炎治療藥物相關信息,提供有價值的參考。

