三亞礁區普哥濱珊瑚對海水懸浮物的生理適應
蔡文啟,唐 佳,吳川良,張開典,周 智
(1.海南大學 海洋學院,海口 570228; 2.三亞珊瑚礁生態研究所,三亞 572000)
珊瑚礁生態系統擁有較高的初級生產力和生物多樣性,為人類提供了極具價值的生態服務功能,比如豐富的漁業和旅游資源[1?2]。作為珊瑚礁生態系統的主要框架生物,造礁石珊瑚的生長得益于共生蟲黃藻提供的光合作用產物,其能滿足珊瑚的大部分能量需求。作為交換,造礁石珊瑚能為共生蟲黃藻提供光合作用所需的二氧化碳(CO2)、無機營養和穩定的環境。但是,近年來表層海水升溫和海洋環境污染威脅著造礁石珊瑚與蟲黃藻的共生關系,共生關系的破裂將進一步導致珊瑚白化或死亡,珊瑚礁生態系統呈不斷退化趨勢[3?5]。隨著人類對海岸帶的開發日益加劇,海水懸浮物(Suspended solid)已經成為近岸珊瑚礁生態系統的主要脅迫因子之一。大量陸源顆粒物質隨地表徑流輸入珊瑚礁區,造成海水懸浮物濃度顯著升高,同時水體濁度也明顯增加。海水懸浮物會產生遮蔽效應,降低共生蟲黃藻的光合效率[6?7]。懸浮物還會緩慢釋放出氮、磷等營養物質,促進水體中其他藻類的爆發生長,進一步加劇該遮蔽效應。海水懸浮物濃度的升高能對造礁石珊瑚的生存產生諸多消極影響,從而不利于珊瑚礁生態系統的穩定性,但相關了解仍然十分有限。
本研究于2020年5?9月期間調查了3個礁區(崖州灣、鳳凰島和西島)的海水懸浮物質量濃度,并測定了礁區中普哥濱珊瑚(Porites pukoensis)的共生蟲黃藻密度、葉綠素a+c2含量,以及共生雙方的超氧化物歧化酶(Superoxide dismutase,SOD)、過氧化氫酶(Catalase,CAT)、谷胱甘肽 S-轉移酶(Glutathione S-transferase,GST)、一氧化氮合酶(Nitric oxide synthase,NOS)和酚氧化物酶(Phenoloxidase,PO)的活力,進而分析礁區懸浮物質量濃度差異對普哥濱珊瑚生理活性的影響,以期揭示造礁石珊瑚對高濃度懸浮物的的生理適應機制。此外,本研究還挑選了敏感生物標志物構建綜合評價指標,旨在用以評估懸浮物對普哥濱珊瑚的影響程度。
1 材料與方法
1.1 礁區取樣于 2020 年 5?9 月期間,每月在三亞崖州灣(18°19′13″N,109°8′47″E)、鳳凰島(18°14′27″N,109°29′05″E)和西島(18°14′28″N,109°21′54″E)3 個礁區進行取樣。每次每個站點用采水器取5份1.5 L表層海水,同時潛水員下潛至水下3 m左右,用錘子和鑿子鑿取5塊不同親本的普哥濱珊瑚樣品。海水裝在卡蓋式采樣瓶內低溫避光保存,珊瑚立即置于鋁箔袋并在干冰中保存。海水和珊瑚樣品均于當日運回實驗室開展后續實驗。取樣位置見圖1。
1.2 實 驗 試 劑磷 酸 鹽 緩 沖 溶 液 (PBS, 377 mmol·L?1NaCl, 2.7 mmol·L?1KCl, 8.09 mmol·L?1Na2HPO4, 1.47 mmol·L?1KH2PO4 ,pH7.4 ) ,100%丙酮,4% 甲醛,10 mmol·L?1左旋多巴(L-DOPA)溶液,總SOD測定試劑盒(A001-1-1,南京建成生物工程研究所有限公司),CAT測定試劑盒(A007-1-1,南京建成生物工程研究所有限公司),GST測定試劑盒(A004-1-1,南京建成生物工程研究所有限公司),總NOS測定試劑盒(A014-2-2,南京建成生物工程研究所有限公司),BCA蛋白質定量檢測試劑盒(C503021-0500,上海生工生物工程股份有限公司)。
1.3 海水懸浮物濃度的測定海水中的懸浮物濃度的測定嚴格按照《海洋監測規范》(GB 17378.4-2007)[8]第4部分進行。先將0.45 μm孔徑的濾膜(TJMF60,天津市津騰實驗設備有限公司)放置于50 ℃恒溫干燥箱中6~8 h烘干至恒重,然后用電子分析天平(BSA224S-CW,賽多利斯科學儀器有限公司)稱重,并放入硅膠干燥器中保存。過濾時,用不銹鋼鑷子將烘干濾膜取出,放置在搭配有隔膜真空泵(GM-0.5A,天津市滕津實驗設備有限公司)的濾器內。過濾1 L表層海水后,將濾膜置于50 ℃恒溫干燥箱中充分干燥,再用電子分析天平稱量濾膜質量。海水懸浮物質量濃度計算公式:
1.4 共生蟲黃藻的密度測定使用裝有過濾海水(經0.22 μm孔徑的濾膜過濾)的Waterpik洗牙器(WP-462EC,潔碧有限公司)沖洗普哥濱珊瑚的表面組織。取 1 mL 沖洗液,7 204 r·min?14 ℃ 離心 10 min,將共生蟲黃藻沉淀重懸于 0.2 mL 4%甲醛溶液中,在光學生物顯微鏡(E100,尼康儀器有限公司)下使用Sedgwick-Rafter計數板進行計數[9]。采用鋁箔紙包裹法[10]計算被沖洗的珊瑚骨骼表面積。共生蟲黃藻密度計算公式:
1.5 共生蟲黃藻的葉綠素含量測定取上述 2 mL沖洗液,7 204 r·min?14 ℃ 離心 10 min,然后用 PBS清洗共生蟲黃藻沉淀,重復離心清洗直至鏡檢無珊瑚組織碎屑。向共生蟲黃藻沉淀中加入2 mL 100% 丙酮溶液,4 ℃ 下萃取 24 h。最后,11 617 r·min?1離心 15 min,采用可見分光光度計(UV-1100,上海美譜達儀器有限公司)分別在630 nm和663nm處測量萃取液的吸光值[11]。葉綠素a+c2的總含量參照JEFFREY等[12]的方程計算,每個共生蟲黃藻的葉綠素含量表示為 pg·cell?1[13]。
1.6 普哥濱珊瑚及其共生蟲黃藻的酶活指標測定用裝有預冷 PBS(4 ℃)的洗牙器沖洗普哥濱珊瑚的表面組織,取 6 mL 沖洗液于 7 204 r·min?14 ℃ 離心 10 min,取上清液用于珊瑚酶活的檢測。然后用2 mL PBS重懸共生蟲黃藻沉淀,重復離心清洗直至鏡檢無珊瑚組織碎屑。加入0.5 g氧化鋯破碎珠(0.5 mm 粒徑,11079105z,上海睿鉑賽生物科技有限公司)和1 mL預冷PBS,用生物樣品均質儀(Bioprep-24,杭州奧盛儀器有限公司)徹底破碎共生蟲黃藻細胞,參數為振幅 6 m·s?1,每破碎 1 min 冰浴 3 min。最后,7 204 r·min?14 ℃離心10 min,取上清液用于共生蟲黃藻酶活的檢測。使用SOD、CAT、NOS和GST檢測試劑盒測定上述上清液中的總酶活力。珊瑚的PO總活性測定參考PALMER[14]描述的方法,將珊瑚上清液與L-DOPA溶液反應后于490 nm處測定吸光值用以表示其總酶活力。最后,采用BCA蛋白定量檢測試劑盒測定上清液中的總蛋白濃度。將普哥濱珊瑚及其共生蟲黃藻的總酶活力除以蛋白濃度,計算得出相應的酶比活力(U·mg?1或 ΔOD490mg?1·min?1)。
1.7 數據處理所有數據以平均值 ± 標準差表示。采用雙因素方差分析不同站點的海水懸浮物濃度差異。采用PCA分析普哥濱珊瑚及其共生蟲黃藻的各項生理活性指標主效應,采用Spearman秩方法分析海水懸浮物濃度與各生理指標之間的相關性。綜合生物標志物響應(Integrated Biomarker Response)指數分析參照文獻[15]的方法。統計分析的顯著差異定義為P< 0.05。
2 結果與分析
2.1 3 個礁區的海水懸浮物質量濃度2020 年 5?9月,崖州灣礁區的海水懸浮物月平均質量濃度為 13.7~19.4 mg·L?1,總平均質量濃度為 16.3 mg·L?1;鳳凰島礁區的海水懸浮物月平均質量濃度為 1.9~8.8 mg·L?1,總平均質量濃度為 5.3 mg·L?1;西島礁區的海水懸浮物質量濃度最低,月平均質量濃度為 0.7~5.3 mg·L?1,總平均質量濃度為 2.6 mg·L?1。雙因素方差分析結果顯示,崖州灣的海水懸浮物質量濃度顯著高于鳳凰島和西島(P< 0.05)(圖2)。
2.2 普哥濱珊瑚和共生蟲黃藻的生理活性指標從表1可見,普哥濱珊瑚SOD、CAT、NOS、GST和PO活力的平均值分別為111.60、119.83、9.46、253.99 U·mg?1和 0.087 ΔOD490mg?1·min?1,SOD、NOS和PO活力的最高月平均值均來自6月份崖州灣,而CAT和GST活力的最高月平均值分別來自8月份西島和5月份崖州灣。共生蟲黃藻的平均密度為 2.97×106cells·cm?2,葉綠素 a+c2的平均含量為 5.87 pg·cell?1,兩者的最高月平均值都在7月份崖州灣。此外,共生蟲黃藻SOD、CAT、NOS和GST活力的平均值分別為205.69、141.89、20.50 和 939.58 U·mg?1,SOD 與 NOS 活力的最高月平均值均見于6月份鳳凰島,而CAT和GST活力的最高月平均值分別見于8月份鳳凰島和5月份西島。
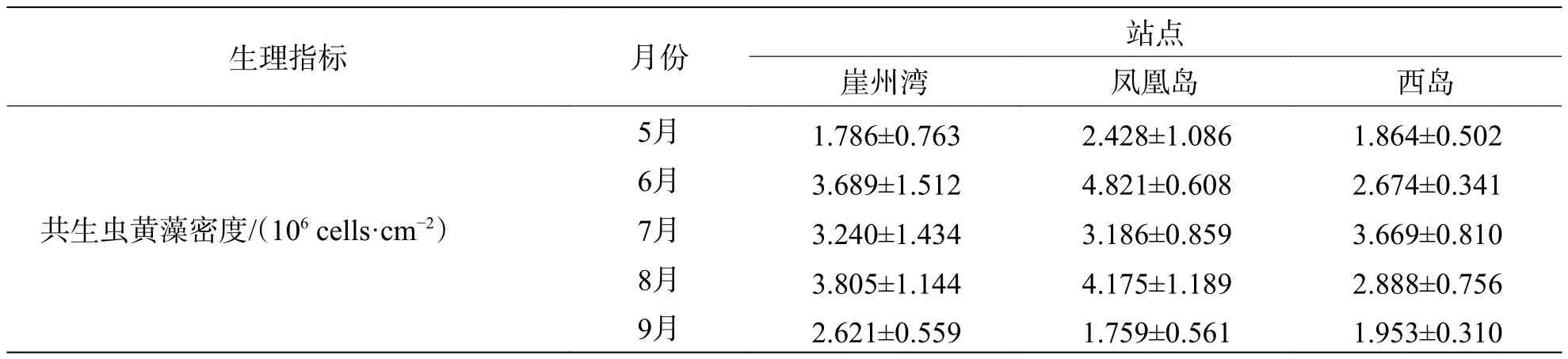
表1 3個礁區普哥濱珊瑚和共生蟲黃藻生理指標結果
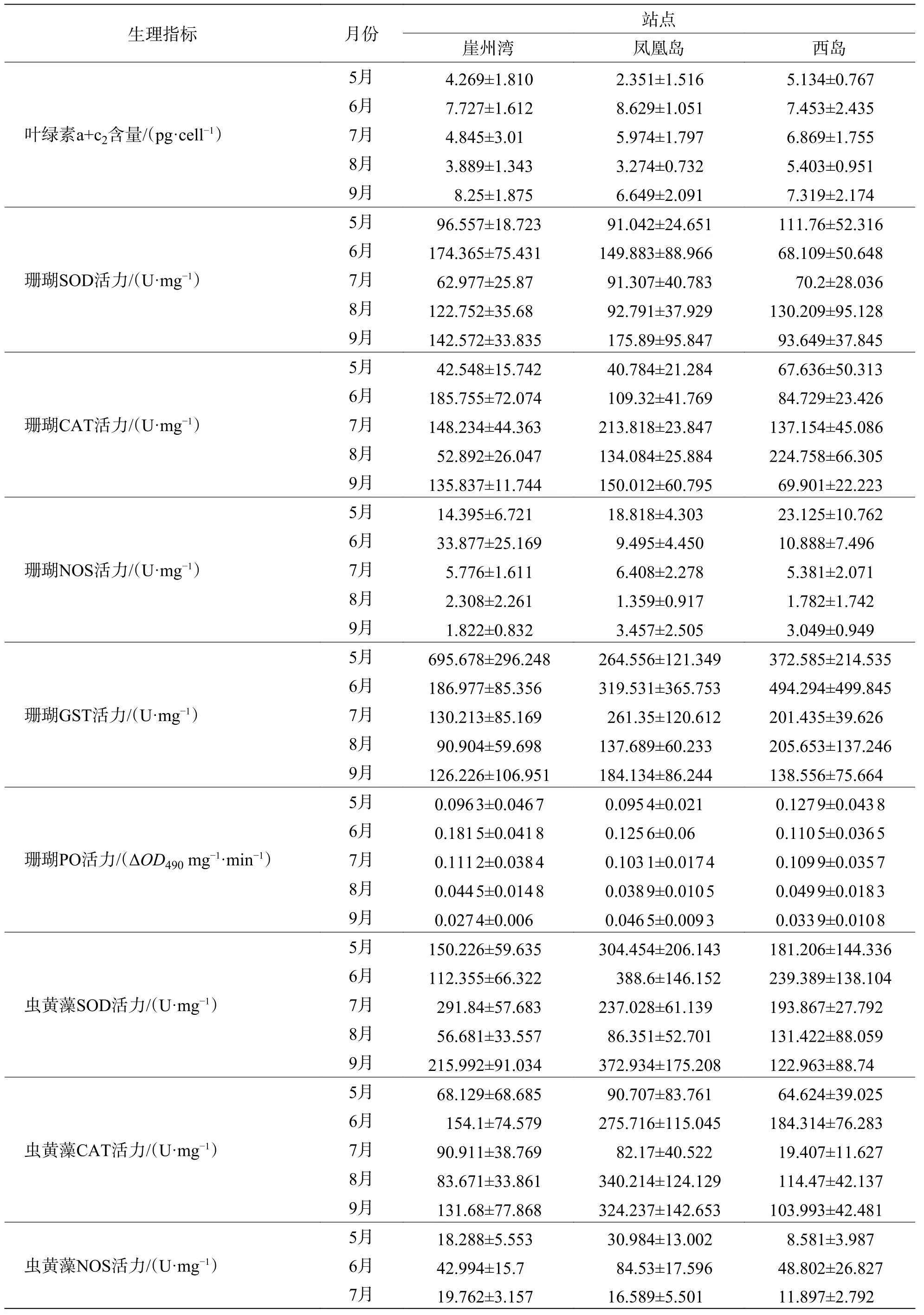
續表1
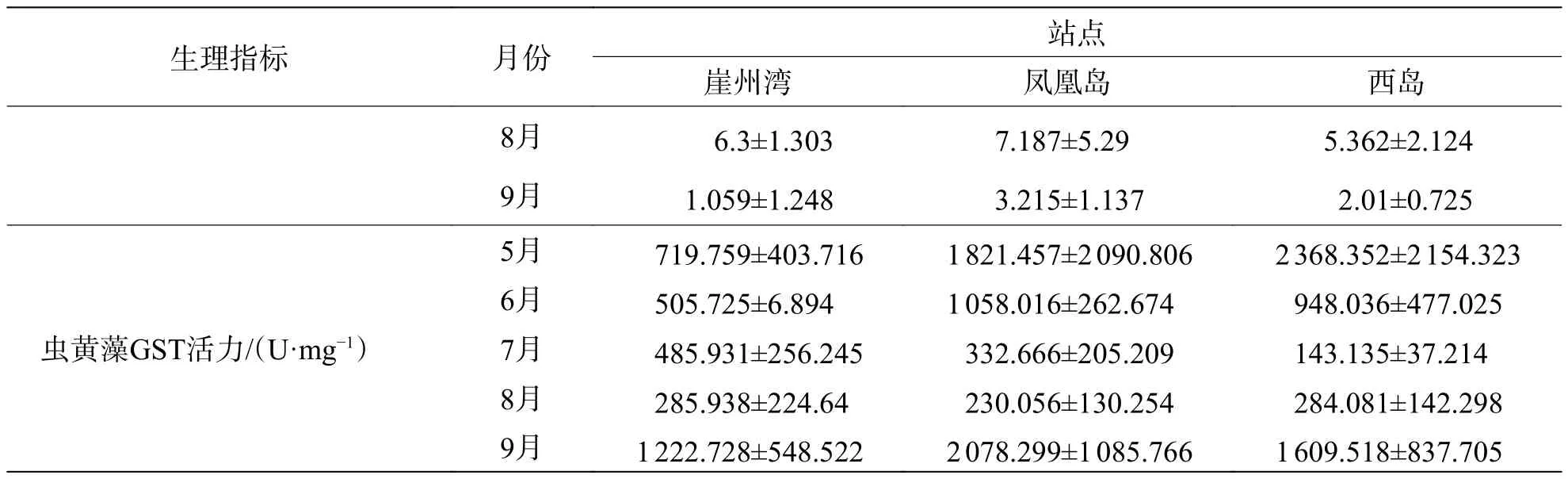
續表1
2.3 海水懸浮物濃度與生理活性指標的關聯分析采用主成分分析方法(PCA)探索普哥濱珊瑚及其共生蟲黃藻的各項生理活性指標的主效應。如圖3所示,PC1占20.2%,PC2占15.3%,兩者總和為35.5%,主效應不顯著。同時,對各礁區海水懸浮物質量濃度與普哥濱珊瑚及其共生蟲黃藻的各項生理活性指標進行關聯分析。結果發現,海水懸浮物質量濃度與共生蟲黃藻的密度和NOS活力均呈顯著性正相關(R= 0.27,P< 0.05;R= 0.27,P< 0.05),而與共生蟲黃藻的 GST 活力呈顯著負相關(R= ?0.26,P< 0.05)(圖4)。
2.4 普哥濱珊瑚的 IBR 指數分析選與海水懸浮物質量濃度相關性相對高(R≥ 0.1 或R≤ ?0.1)的生理活性指標(普哥濱珊瑚的SOD和GST活力,以及共生蟲黃藻的密度、SOD、NOS和GST活力),計算和分析3個礁區(崖州灣、鳳凰島和西島)普哥濱珊瑚的綜合生物標志物響應指數,繪制了生物標志物星狀圖。崖州灣普哥濱珊瑚的綜合生物標志物響應指數值最高,為0.060 5,鳳凰島為 0.021 3,西島僅為 0.017 4(圖5)。
3 討 論
近年來,隨著人類對濱海的不斷開發與利用,近海礁區水質明顯下降,已嚴重威脅到珊瑚礁生態系統的健康和安全[16?17]。有研究表明,海水懸浮物濃度的升高是近岸珊瑚礁不斷退化的原因之一[18?19],也有研究表明,在懸浮物濃度較高的海區一些珊瑚可以長時間生存[20]。為了揭示自然礁區中海水懸浮物對造礁石珊瑚的生理影響,本研究在三亞選取海水懸浮物濃度存在顯著差異的3個礁區(崖州灣、鳳凰島和西島),調查了海水懸浮物濃度的月際變化規律,檢測了在3個礁區均分布的普哥濱珊瑚的生理活性,以期闡明造礁石珊瑚對高濃度懸浮物環境的適應機制。
筆者在調查中發現,崖州灣礁區的海水懸浮物質量濃度長期高于 10 mg·L?1,超過了一類海水的相關標準[21]。崖州灣附近分布著大量水產養殖高位池,養殖過程中產生的殘餌、排泄物、死亡生物和漁民生活污水等直接流入附近的珊瑚礁區;灣內南山港碼頭是三亞市的主要貨運碼頭,來往大型貨運船經常卷起底部沉積物,兩者可能共同導致了崖州灣礁區海水懸浮物質量濃度的較高水平。鳳凰島毗鄰臨春河入海口,有城市污水的不斷輸入[22],這可能導致了鳳凰島礁區海水懸浮物質量濃度略高于西島。因此,海水懸浮物污染已成為或將成為三亞近岸珊瑚礁的威脅因素之一。
趙美霞等[23]的調查結果表明,普哥濱珊瑚正逐漸成為三亞近岸珊瑚礁中的優勢種,在海水懸浮物濃度較高的崖州灣礁區更是唯一幸存的珊瑚種。為了深入解析海水懸浮物對造礁石珊瑚的生理影響,本研究檢測了3個礁區中普哥濱珊瑚的共生蟲黃藻密度和葉綠素a+c2含量,以及珊瑚宿主和共生蟲黃藻中環境脅迫相關酶(SOD、CAT、GST、NOS和PO)的活力。PCA分析發現,普哥濱珊瑚及其共生蟲黃藻中多項生理活性指標的主效應并不顯著。相關性分析表明,海水懸浮物質量濃度與共生蟲黃藻的密度和NOS活力顯著正相關,而與共生蟲黃藻的GST活力顯著負相關。與海水懸浮物質量濃度顯著相關的指標均是共生蟲黃藻的生理指標,表明普哥濱珊瑚通過調控共生蟲黃藻的生理活性來適應高海水懸浮物濃度的礁區環境。三亞礁區海水懸浮物濃度(0.7~19.4 mg·L?1)的升高誘導了普哥濱珊瑚共生蟲黃藻密度的增加,這與JONES等[24]的研究結果一致。這種誘導作用可歸因于懸浮物對普哥濱珊瑚的遮蔭效應,海水懸浮物質量濃度越高,共生蟲黃藻獲得的光照越不足,隨之導致其光合作用產物減少。因此,普哥濱珊瑚能通過增加共生蟲黃藻的密度來滿足自身的能量需求,從而適應高海水懸浮物質量濃度環境。此外,海水懸浮物質量濃度的升高增加了共生蟲黃藻的NOS活力,但抑制了其GST活力。因為共生蟲黃藻的SOD和CAT活力與海水懸浮物質量濃度未呈顯著相關性,NOS活力的上升可能并未導致胞內的過氧化水平,而是經由NO通路調節藻體的生理活性[25]。GST活性的下降可能會抑制共生蟲黃藻的解毒水平,這可能是普哥濱珊瑚宿主降低共生蟲黃藻的解毒耗能,而增加其對自身的能量供應[26]。因此,普哥濱珊瑚可能通過增加共生蟲黃藻的密度和NOS活性,而降低其GST活力來適應高海水懸浮物質量濃度的崖州灣礁區環境。這種對不同海水懸浮物質量濃度的適應性調節與普哥濱珊瑚的綜合生物標志物響應指數相一致,崖州灣的普哥濱珊瑚指數值> 鳳凰島 > 西島。綜上所述,普哥濱珊瑚能生存于較高海水懸浮物質量濃度環境的機制在于對共生蟲黃藻生理的調控,包括對其密度和NOS活力的誘導,以及對GST活力的抑制。
筆者比較了三亞3個礁區的海水懸浮物濃度,分析了海水懸浮物濃度與普哥濱珊瑚及其共生蟲黃藻的各項生理指標間的關系,并構建了3個礁區普哥濱珊瑚的綜合生物標志物響應指數,發現崖州灣礁區海水懸浮物濃度最高,普哥濱珊瑚可能通過誘導共生蟲黃藻的密度和NOS活力以及抑制共生蟲黃藻的GST活力,來適應崖州灣礁區的較高懸浮物環境。此外,本研究構建的綜合評價指標能夠評估懸浮物對普哥濱珊瑚的影響程度,以期為珊瑚礁生態風險評估提供理論基礎。

