杜仲LBD基因家族全基因組鑒定與進化表達分析
劉 俊,李 龍,陳玉龍,吳耀松,劉 燕,任閃閃,董誠明
杜仲基因家族全基因組鑒定與進化表達分析
劉 俊1, 4, 5,李 龍3,陳玉龍1,吳耀松1,劉 燕1,任閃閃1,董誠明2
1.河南中醫藥大學 中醫藥科學院,河南省中醫方證信號傳導重點實驗室,河南 鄭州 450046 河南中醫藥大學 河南省道地藥材生態種植工程技術研究中心,河南 鄭州 450046 西北農林科技大學林學院,陜西 楊凌 712100 國際竹藤中心 國家林業和草原局竹藤科學與技術重點開放實驗室,北京 100102 國際竹藤中心 安徽太平試驗中心,安徽 黃山 245716
通過對杜仲基因家族進行全面鑒定,以期為基因功能深入研究提供依據。以杜仲基因組數據庫為基礎,利用生物信息學方法,對杜仲基因家族進行全面鑒定和表達模式分析。從杜仲基因組中共鑒定到19個,分為Class I與Class II 2大類,進一步劃分為6個亞家族(Ia、Ib、Ic、Id與IIa、IIb)。理化性質分析顯示:EuLBDs編碼152~293個氨基酸,理論等電點分布于4.62~9.91,相對分子質量區域為17 420~31 820,均為親水性蛋白,以α-螺旋和不規則卷曲為主,亞細胞定位于細胞核中。EuLBD基因家族含有類鋅指、亮氨酸拉鏈和甘氨酸-丙氨酸-絲氨酸(GAS)保守結構域。表達模式分析顯示,參與杜仲葉片發育,隨著葉片發育,水平逐漸降低,基因表達不受葉片膠含量的影響。從杜仲基因組水平對基因家族進行了全面鑒定和生物信息學分析,為進一步研究杜仲基因功能奠定基礎。
杜仲;LBD基因家族;系統進化;基因表達;
杜仲Oliver為杜仲科杜仲屬落葉喬木,是中國特有的單科、單屬、單種的名貴中藥材,集“經濟、生態、社會效益于一體[1],為我國二級保護植物。杜仲主要以樹皮入藥,具有抗疲勞、抗腫瘤、預防太空骨質疏松,還具有利膽止血、抗菌、利尿、免疫鎮靜等作用[2]。LBD蛋白(lateral organ boundaries domain/ASYMMETRIC LEAVES2- Like)是植物特有的一類轉錄因子[3-6],-末端含有由100個氨基酸殘基3個基序(C-block、GAS-block和leu zipper coiled coil)組成的保守LOB結構域。C-block由4個半胱氨酸殘基(CX2CX6CX3C)組成,主要參與DNA與順式作用元件結合,GAS-block由49個氨基酸殘基組成,以FX2VH序列開始,DP(V/I)序列結束[7],Leu zipper coiled coil包含1個“LX6LX3LX6C”序列的亮氨酸拉鏈結構,主要參與蛋白質二聚化過程[8]。基因家族分為Class I和Class II 2大類,研究報道顯示,Class I類基因主要在側生器官的原基邊緣表達,調控根、葉、花和胚胎生長發育[9];Class II類基因主要參與植物花青素的合成以及氮代謝調控[10-17]。
自第一個基因從擬南芥中發現以后,其他物種LBD蛋白也相繼被報道。研究顯示,LBD轉錄因子參與植物側生器官發育、激素調節、氮素代謝等多種生物學過程[5,18]。在擬南芥中,1(36)、4()和5(12)參與分生組織側枝器官發育[8,19-20],29(16)、18(20)和16(18)主要在側根中表達[21-22];18和33形成異源二聚體,激活下游基因轉錄[23],促使根部側生分生組織細胞進入細胞周期,影響擬南芥側根發育[24-25]。41在擬南芥葉片發育中發揮重要作用[20],2主要在幼嫩花器官近軸面特異表達[6,26],調控花器官發育[27]。基因特異性調控小麥組織發育,Class Ib亞家族主要參與鹽脅迫響應[28]。丹參23異源轉化擬南芥,導致轉基因植株花青素和總酚酸含量降低,干擾植株葉中黃酮含量升高,根中黃酮含量降低;16導致轉基因擬南芥花青素和總酚酸含量升高,由此說明,丹參基因參與花青素和總酚酸代謝調控[5,29]。
隨著分子生物學的發展,基因已在多個物種中進行了研究(表1),然而杜仲基因家族還未報道。本研究以杜仲基因組數據[30]為基礎,從基因組水平對基因家族進行全面鑒定、理化性質分析、進化關系、保守基序以及表達模式分析,以期為進一步探索杜仲基因功能奠定基礎。
1 材料
杜仲材料種植于西北農林科技大學苗圃(陜西楊凌),經西北農林科技大學李龍博士鑒定為杜仲Oliver。取生長正常,長勢一致的2年生“秦仲1號”“Qinzhong 1”杜仲幼苗的葉芽(莖尖)、生長葉(3 cm 長葉片)、幼葉(完全展開的新葉)、老葉(完全展開60 d葉片);采集高產膠杜仲品種“秦仲2號”“Qinzhong 2”和低產膠杜仲品種“小葉”“Xiaoye”成熟葉片,設置3個生物學重復,經液氮處理后凍存于?80 ℃ 冰箱,用于RNA提取。無菌水、乙醇、TRIzol、液氮、反轉錄試劑盒、qRT-PCR SYBR試劑盒等。

表1 不同物種LBD基因家族分布
2 方法
2.1 杜仲LBD基因家族鑒定及理化性質分析
從杜仲基因組數據庫Genome Warehouse(https://bigd.big.ac.cn/gwh/Assembly/13/show)中下載LBD蛋白候選序列,利用NCBI在線分析軟件[Conserved Domain Search Service(CD Search)]分析序列的結構域,保留含有完整LOB結構域的蛋白序列。通過在線軟件ProtParam(http://web.expasy.org/protparam/)分析蛋白的理化性質,使用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/ plant-multi/)預測EuLBDs蛋白的亞細胞定位,利用在線工具ExPASY(https://www.expasy.org/tools)預測EuLBDs氨基酸數量、相對分子質量、理論等電點[45],通過Expasy(https://web.expasy.org/ protscale/)軟件分析蛋白的親疏水性,利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage= npsa_sopma.html)[46]和Phyre 2 (http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)[47]軟件分別預測蛋白的二級結構和三級結構。
2.2 杜仲LBDs蛋白系統發育樹構建
通過Clustal X1.83[48]軟件對杜仲、水稻、擬南芥和毛果楊LBDs氨基酸序列進行多序列比對,利用MEGA 6.0的鄰接法(neighbor-joining,NJ)構建系統發育樹,重復次數設置為1000次,其他參數為默認值[49]。
2.3 保守基序及啟動子分析
為了分析EuLBDs蛋白的保守基序,通過MEME(http://meme-suite.org/)在線軟件對基因家族成員進行基序分析(參數為any number of Repetitions(anr),maximum number of Motifs=10,minimum width≥6,and maximum width≤50)[50]。為了解析啟動子區域順式作用元件,對基因ATG上游2000 bp的序列進行查找分離,利用Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/htmL/)軟件進行啟動子分析[51]。
2.4 杜仲EuLBD基因家族表達模式分析
從NCBI的Short Read Arshive(SRA)數據庫中下載杜仲葉片不同發育時期(葉芽、初生葉、幼葉、老葉)[52]及不同膠含量(低含量、高含量)[53]轉錄組數據,基因在不同組織中的相對表達豐度用FPKM值表示,對該數值取對數(Log2)進行統計分析,通過MeV4-9-0工具繪制基因表達圖譜,表達量最高的用紅色方框表示,表達量最低的用綠色方框表示。
2.5 杜仲LBDs蛋白互作網絡預測
利用STRING軟件(https://string-db.org/)上傳EuLBDs蛋白序列,選擇擬南芥數據庫進行序列比對,根據已知擬南芥蛋白互作關系,通過Blast比對杜仲同源蛋白,通過Cytoscape 3.7.0軟件進一步分析,對EuLBD基因家族蛋白互作信息進行評估和預測[54]。
3 結果與分析
3.1 杜仲LBD基因家族鑒定及理化性質分析
利用Genome Warehouse數據庫,通過生物信息學方法,從杜仲基因組中鑒定到19個基因(表2),通過Pfam和NCBI的Conserved Domain Search在線分析軟件對EuLBDs蛋白結構域進行檢測。結果顯示,19個EuLBDs蛋白均含有保守LOB特征結構域,分別命名為EuLBD1~EuLBD19。通過ExPASy工具,對EuLBD家族成員進行蛋白質理化性質分析,最長蛋白EuLBD12編碼293個氨基酸,最短蛋白EuLBD3編碼152個氨基酸,相對分子質量分布區域為17 420~31 820,等電點范圍是4.62(EuLBD8)~9.91(EuLBD9)。亞細胞定位預測結果顯示,EuLBDs均定位在細胞核中(表2)。
3.2 杜仲LBD轉錄因子親疏水性分析
利用ProtScale在線軟件分析杜仲LBDs轉錄因子的親疏水性。結果如圖1所示,19條EuLBDs蛋白均存在明確的親疏水區域,親水區域多于疏水區域,表明EuLBDs多肽鏈均為親水性蛋白。EuLBD1的最低值為?2.133,在218位,最高值為2.011,位于第47氨基酸殘基處;EuLBD2在145位處于最低值為?3.489,于88位氨基酸殘基處達到最高值是1.922,其他蛋白的最低值、最高值及具體位置見圖1。
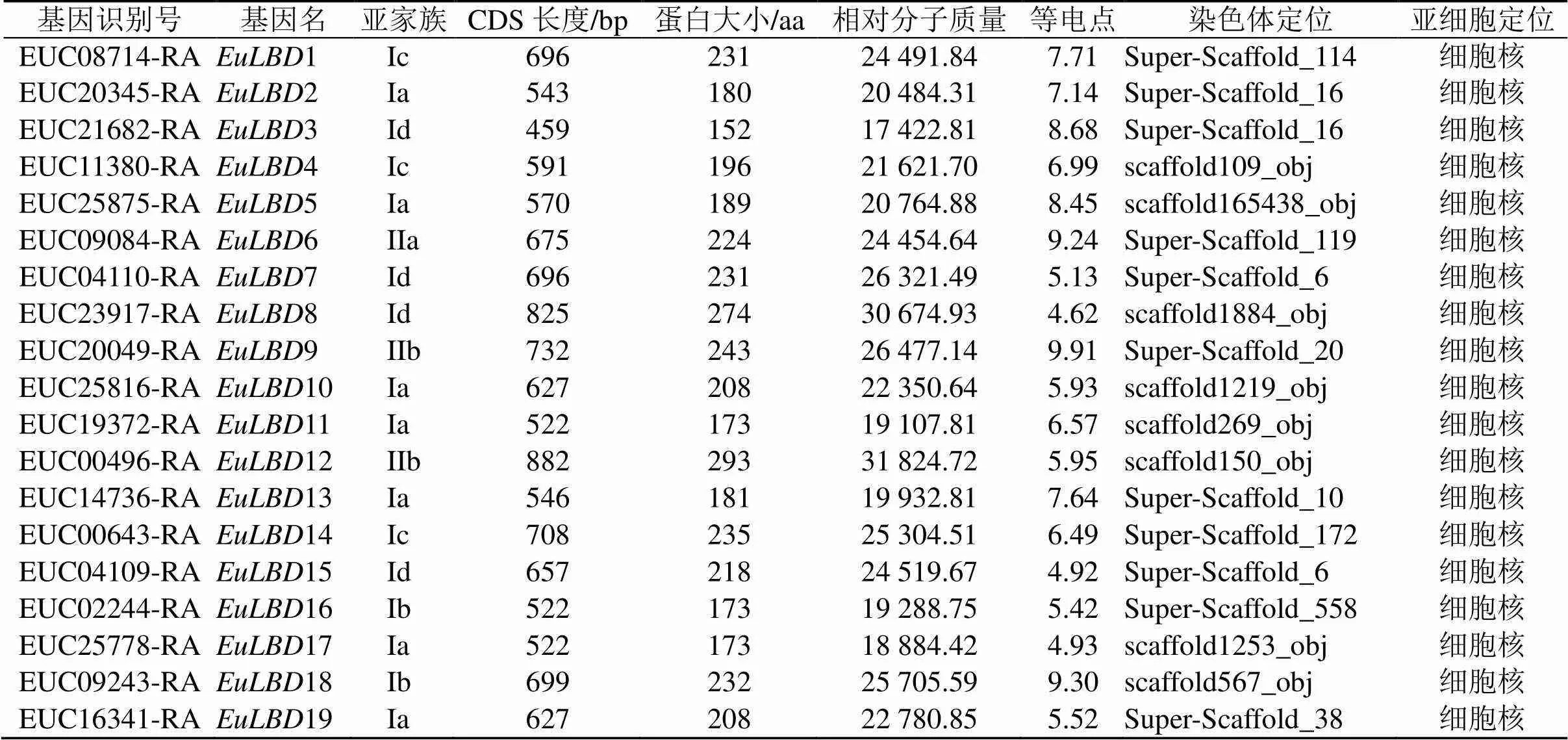
表2 杜仲LBD基因家族基本信息
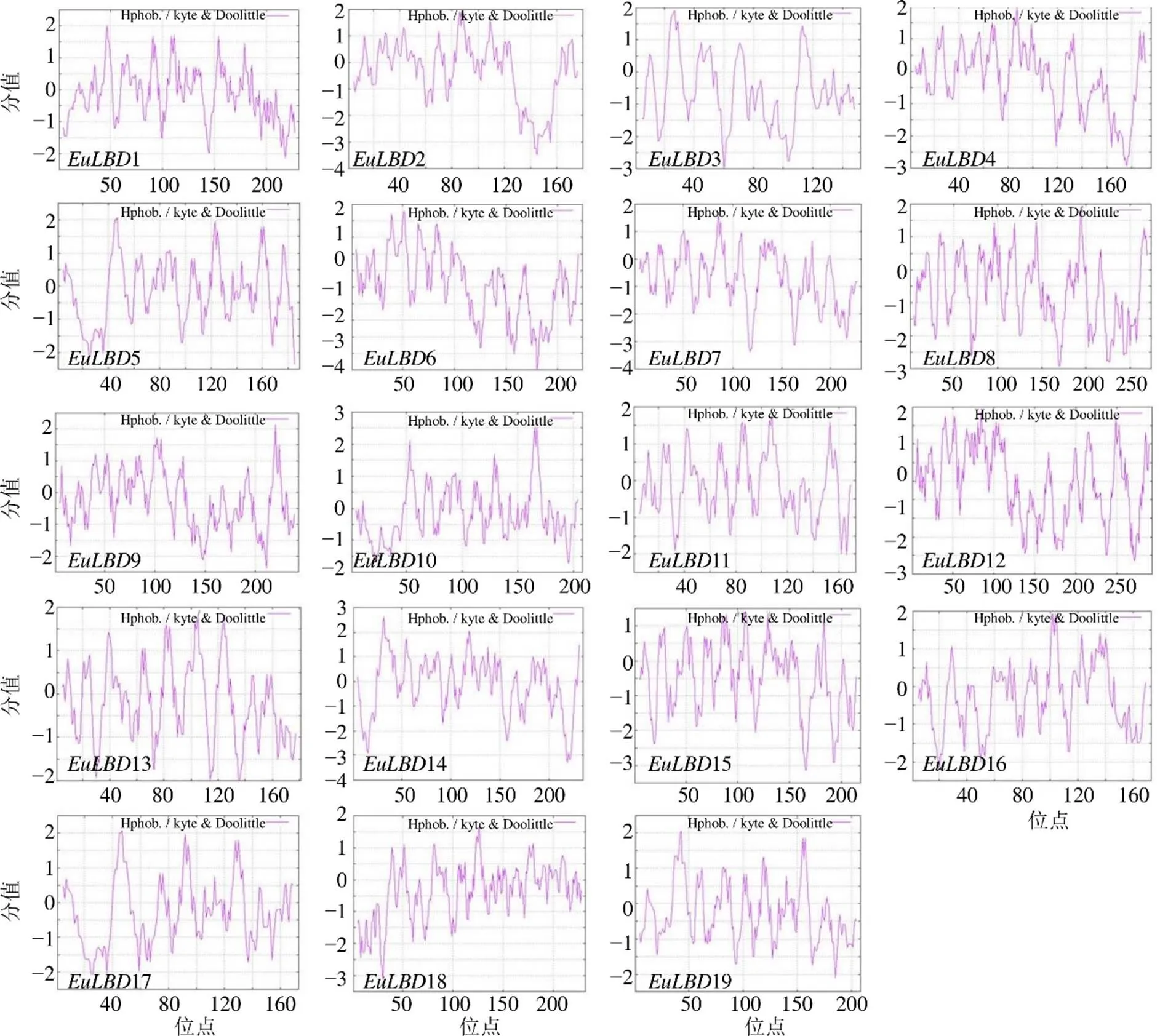
圖1 杜仲LBDs轉錄因子親疏水性預測
3.3 杜仲LBDs蛋白結構分析
EuLBDs蛋白二級結構分析顯示,α-螺旋、無規則卷曲、延伸鏈和β-轉角在杜仲LBD蛋白家族中均有分布。α-螺旋在DNA結合基序中發揮重要作用,無規則卷曲易受側鏈相互作用,構成活性部位和功能部位。杜仲LBDs蛋白二級結構有2種類型,其中α螺旋>無規則卷曲>延伸鏈>β轉角的數量最多,有11個基因,所占比例為57.89%;8個基因二級結構順序為無規則卷曲>α螺旋>延伸鏈>β轉角,比例是42.11%,具體情況見表3。
采用Phyre2在線軟件進行杜仲LBDs蛋白高級結構同源建模預測,結果如圖2所示,除EuLBD17三級結構出現特異性外,其余蛋白三級結構非常相似,均由α-螺旋、β-折疊和隨機卷曲等組成,19個EuLBDs中隨機卷曲所占比例最大,空間結構不同,決定EuLBDs蛋白功能的差異。
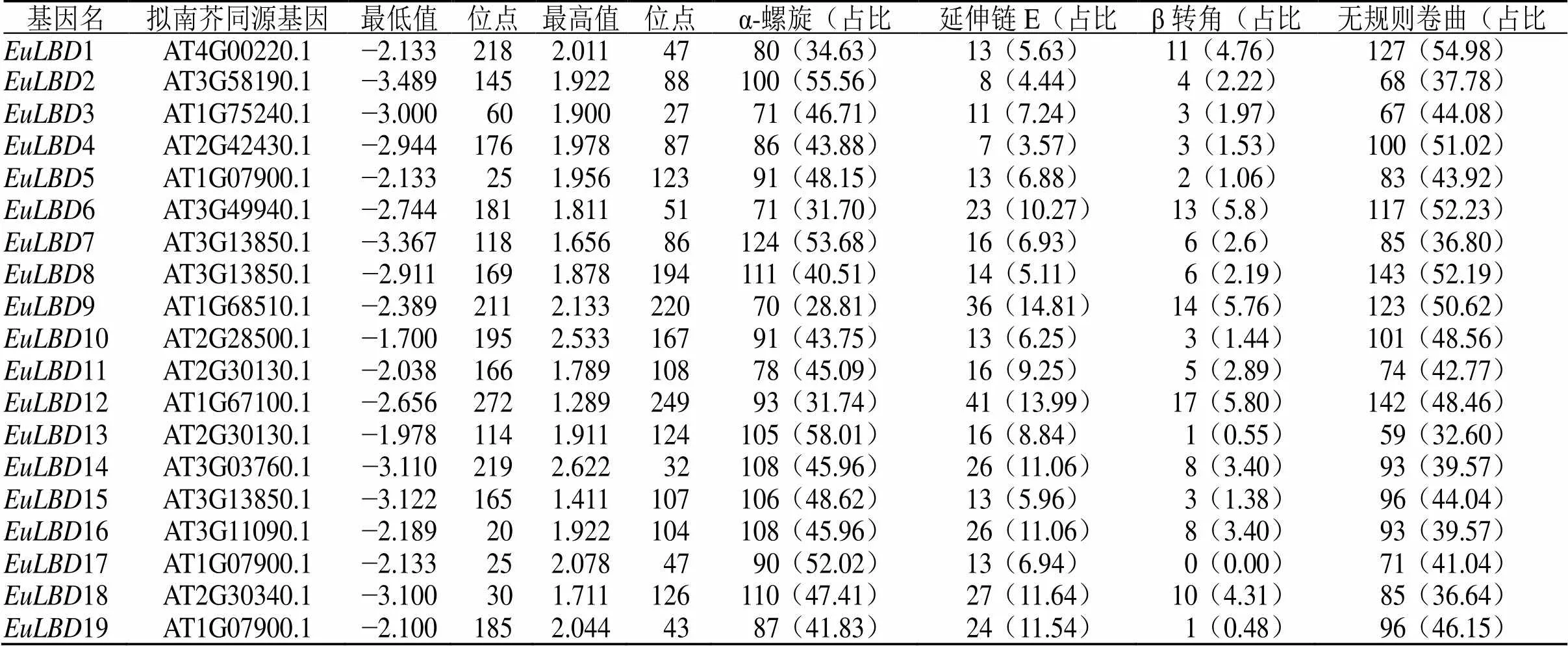
表3 杜仲LBD基因家族二級結構分析
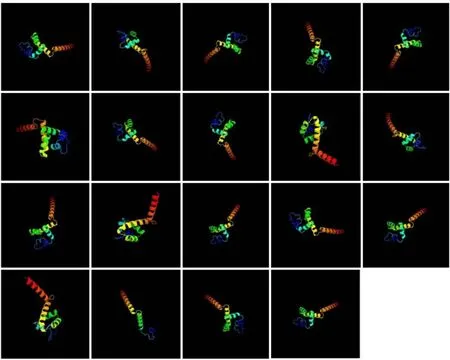
圖2 杜仲LBDs蛋白三級結構預測
3.4 杜仲LBDs蛋白系統進化分析
利用MEGA 6.0分析軟件,對19個杜仲EuLBDs,35個水稻OsLBDs[31],43個擬南芥AtLBDs[8]和57個毛果楊PtLBDs[55]蛋白進行1000次重復搜索,構建系統進化樹。結果如圖3所示,154個LBDs蛋白分為Class I和Class II 2個大亞家族,其中Class I亞家族進一步劃分為:Ia、Ib、Ic、Id和Ie小亞家族;Class II亞家族劃分為:IIa和IIb。154個LBDs蛋白共分為7個小亞家族(如圖3所示),Class Ia亞家族所含LBDs成員數量最多,共有37個LBDs蛋白,分別包含3個EuLBDs,13個AtLBDs,8個OsLBDs和13個PtLBDs蛋白;其次是Class Id亞家族,由31個LBDs蛋白組成,Class Ib亞家族含有28個LBDs蛋白;29個LBDs蛋白屬于Class Ic亞家族,Class Ie亞家族所含蛋白數量最少,僅有3個AtLBDs;Class IIa和Class IIb亞家族分別含有14、13個LBDs。EuLBDs在Class Ic亞家族中的分布最多,有7個蛋白,所占比例為36.8%,除Class Ic亞家族外,EuLBDs在7個亞家族中的蛋白數量最少,這可能與EuLBDs在4個物種中數量最少有關。
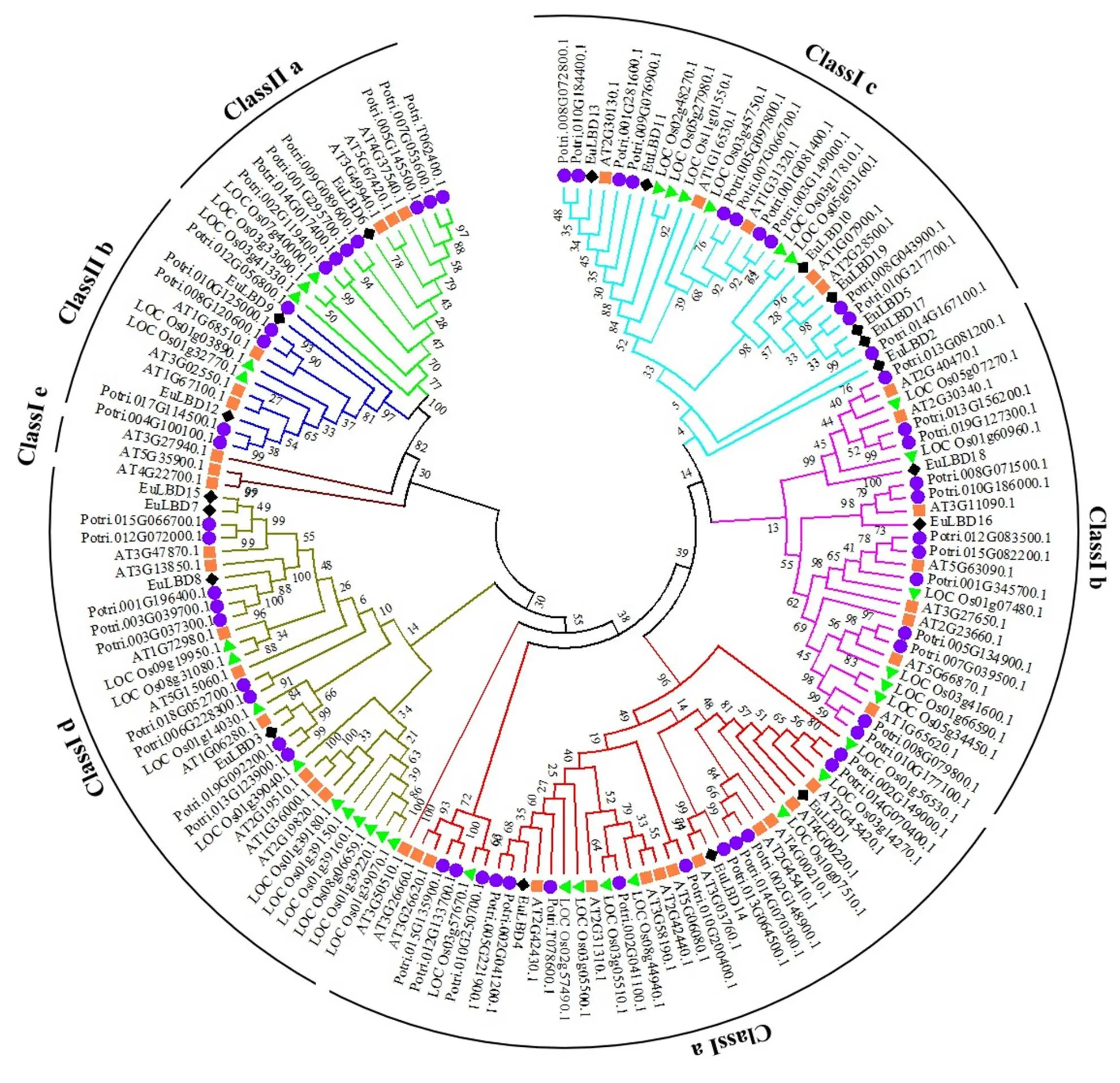
利用MEGA 6.0的鄰接法構建系統進化樹,不同物種的LBDs蛋白用不同顏色點標記,紅色方形代表擬南芥,綠色三角形代表水稻,紫色圓形代表毛果楊,杜仲LBDs蛋白由黑色菱形標記
3.5 杜仲LBD轉錄因子基序分析
為了解析基因結構多樣性和進化關系,利用MEME在線分析軟件,對19條EuLBDs蛋白保守結構域進行分析。結果如圖4所示,EuLBDs蛋白由1~10個Motifs組成(表4),均含有保守LOB結構域(Motif 1和Motif 2),表明19個EuLBDs均屬于LBD家族成員。EuLBDs蛋白(除EuLBD5外)均含有Motif 3,有些Motifs只存在于特定亞家族,Motif 5僅在Class Ib亞家族中存在,Motif 4、Motif 7和Motif 10只存在于Class Ic亞家族,只有Class IIa亞家族含有Motif 9,這可能與不同亞家族功能不同相關。
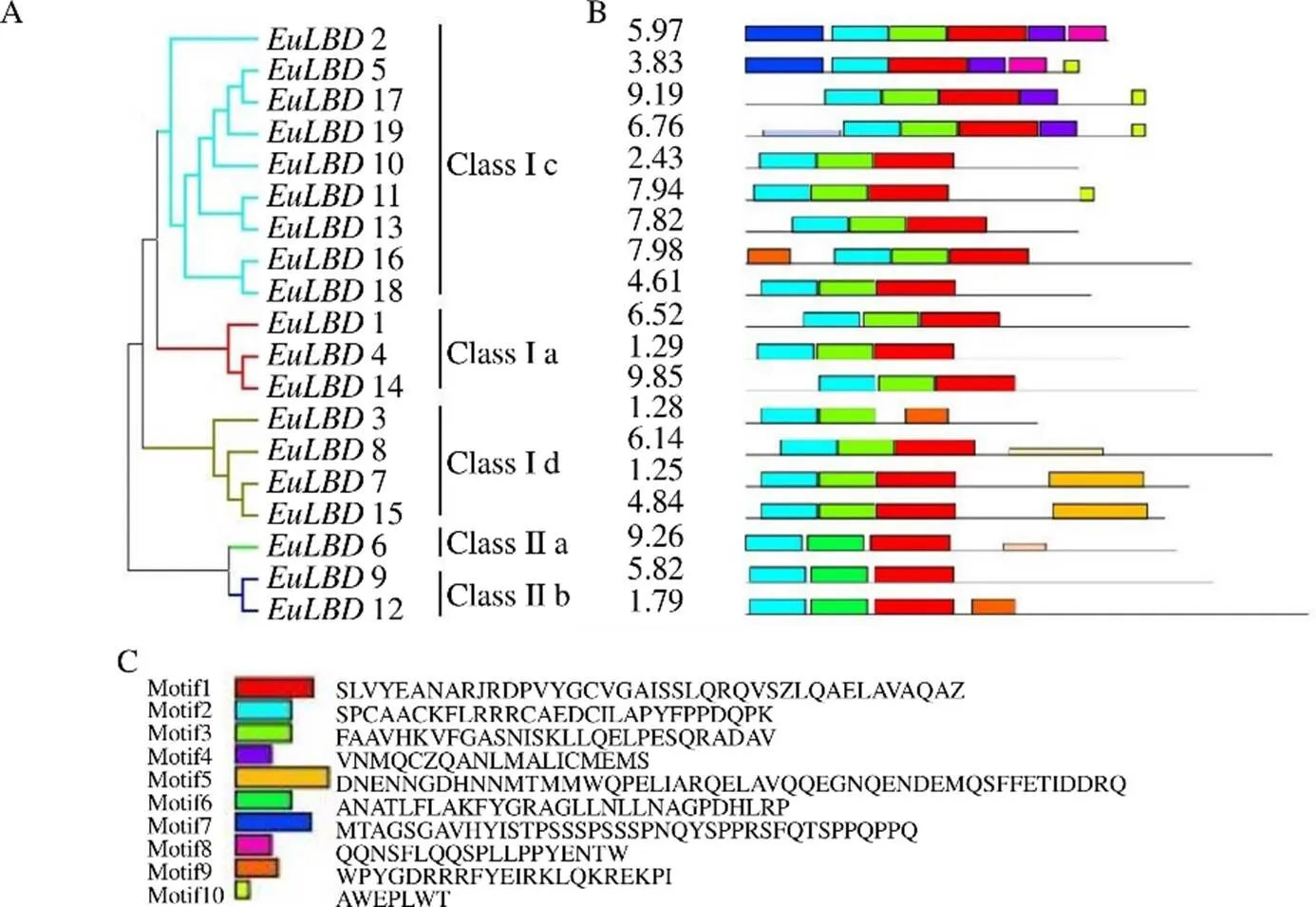
A-利用MEGA 6.0的鄰接法構建EuLBD基因家族系統進化樹B-EuLBDs基因結構分析 C-保守基序氨基酸分布

表4 杜仲LBDs蛋白保守基序分布
3.6 杜仲LBDs蛋白序列保守性分析
利用DNAMAN7.0工具對19個EuLBDs蛋白保守結構域進行比對,結果如圖5所示,EuLBDs蛋白N端均含有1個由15個氨基酸殘基組成的CX2CX6CX3C保守基序,暗示其可能與下游基因順式元件的結合有關,Class II類蛋白C端含有賴氨酸組成的類似亮氨酸拉鏈(LX6LX3LX6L)二級結構(圖5),參與轉錄因子二聚化。Class Ia、Ib和Ic亞家族含有1個GAS模塊(GAS-block),該模塊C端含有保守的脯氨酸(P)和甘氨酸(G),脯氨酸在LBD基因家族生物學功能中發揮重要作用[56]。

圖5 杜仲LBDs蛋白保守結構域序列比對
3.7 杜仲LBDs啟動子順式作用元件分析
為了探索基因的功能和表達調控模式,利用PlantCARE在線軟件對起始密碼子(ATG)上游2000 bp進行順式作用元件分析,結果如圖6所示,啟動子不僅含有基本順式作用元件,還存在3種類型元件:(1)生長發育調控元件,如赤霉素響應元件ABRE;生長素響應元件AuxRR-core;水楊酸響應元件CGTCA-motif;(2)脅迫響應調控元件,如干旱脅迫響應元件MBS、低溫響應元件LTR和厭氧脅迫相關元件ARE;(3)光響應元件,如GT1-motif、GATA-motif、Sp1、G-Box和ACE等,推測可能在杜仲生長發育、逆境脅迫以及光周期調控中發揮重要作用。基因中光響應元件數量最多,共有232個,包含55個Box 4,34個G-box元件,暗示s基因的轉錄可能受光周期調控。基因啟動子區域含有48個ABRE元件,表明可能參與ABA調控。
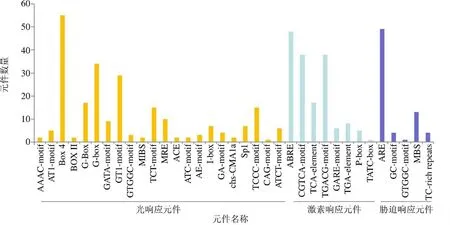
圖6 杜仲LBDs啟動子順式作用元件分析
3.8 杜仲LBD基因家族表達模式分析
為了探索基因在杜仲葉片不同發育時期及杜仲膠形成中的功能,根據轉錄組數據,檢測基因表達模式(圖中顯示基因編號與文中基因命名一致)。結果如圖7和8所示,不同基因在杜仲葉片不同發育時期及杜仲膠含量中表達豐度存在顯著差異,大部分基因在杜仲葉片發育中表達豐度較低,其中有4個基因(3、9、13和15)在杜仲葉片中不表達,表明3、9、13和15在杜仲葉片發育中不發揮作用。基因隨著杜仲葉片發育,表達水平逐漸降低,12FPKM值在葉芽中是357.0,幼葉中為62.0,成熟葉中是2.2,老葉中僅為0.2,表明大部分基因參與杜仲葉片發育,特別在葉片發育的早期階段。

T1-1~T1-3-葉芽 T2-1~T2-3-初生葉 T3-1~T3-3-幼葉 T4-1~T4-3-老葉,熱圖右側為色標,綠色表示低表達豐度,紅色表示高轉錄水平
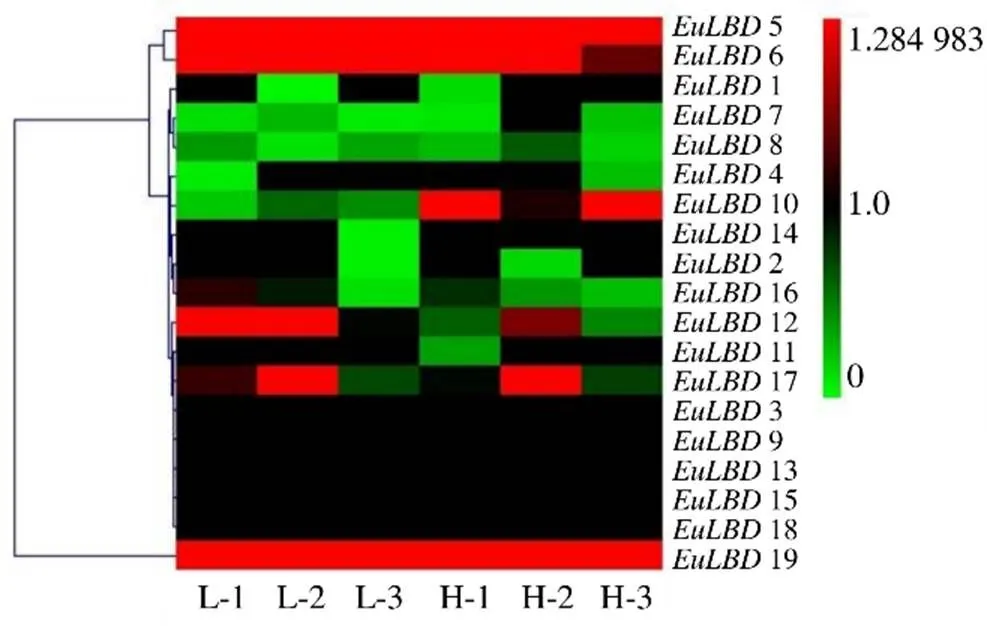
L-1~L-3:低膠含量葉片;H-1~H-3:高膠含量葉片。熱圖右側為色標,綠色表示低表達豐度,紅色表示高轉錄水平
為了檢測在杜仲膠形成中發揮的作用,利用不同膠含量的轉錄組數據,檢測的表達水平。結果如圖8所示,基因在杜仲不同膠含量中的表達水平均較低,幾乎檢測不到,轉錄水平不隨膠含量的高低而改變,由此說明在杜仲膠形成過程中發揮的作用較小,這可能與在杜仲成熟葉中表達量較低有關。
3.9 杜仲LBDs蛋白互作網絡預測
表達模式分析顯示,6和19在杜仲葉片不同發育階段和杜仲膠形成中表達量較高,表明6和19在杜仲葉片發育和膠形成過程中發揮重要作用。為了檢測EuLBD6和EuLBD19與其他蛋白的互作關系,利用STRING數據庫,預測EuLBD6和EuLBD19互作蛋白。結果如圖9-A所示,EuLBD6可以與10個蛋白發生相互作用,其中8個屬于EuLBD家族,一個是MYB-like轉錄因子,另一個為NLP7蛋白;EuLBD19可與5個蛋白產生互作關系(圖9-B),其中3個為EuLBD蛋白,一個Auxin-like轉錄因子,一個MYB-like蛋白,暗示EuLBD6和EuLBD19可能參與杜仲生長素信號調控。
為了探索基因家族潛在調控關系,構建了EuLBD家族共表達調控網絡。結果如圖10所示,調控網絡中共有14個節點(代表EuLBDs蛋白)和19條邊(代表蛋白質之間的相互作用),表明19個EuLBDs中有14個蛋白表現出共表達相關性,其中EuLBD12互作蛋白數量最多,可與8個EuLBDs蛋白發生互作關系,暗示EuLBD12可能是EuLBD基因家族的核心蛋白,EuLBD6、EuLBD4和EuLBD1,分別可以與4個EuLBDs蛋白互作,其余EuLBDs蛋白互作關系較少。
4 討論
杜仲全基因組測序完成以后,已有多個基因家族進行了分析報道,例如[57]、[58]、[59]、[60]、[61]、[62]基因家族等。LBD轉錄因子是植物特有的一類轉錄因子,在植物側生器官發育、激素響應、逆境脅迫、花青素和氮素代謝等途徑中發揮了重要作用[63]。本研究以杜仲基因組數據為基礎,通過全基因組查找和生物信息學分析,鑒定出19個含有完整LOB結構域的LBD轉錄因子,基因數量均少于二穗短柄草(28個)[34]、擬南芥(43個)[8]、水稻(35個)[31]、玉米(44個)[32]、楊樹(57個)[6]、番茄(46個)[4]、辣椒(56個)[37]、煙草(45個)[40]、葡萄(98個)[42],杜仲基因組大小是1.18 Gb[64],是水稻(441 Mb)[65]的2倍多,為二穗短柄草(300 Mb)[66]的3倍多,是擬南芥(164 Mb)的7倍,為番茄(850 Mb)的1倍多,然而基因數量與基因組大小不成正比,這可能與杜仲和雙子葉共同祖先發生分化后,進行全基因組復制(WGD)及基因丟失事件有關。
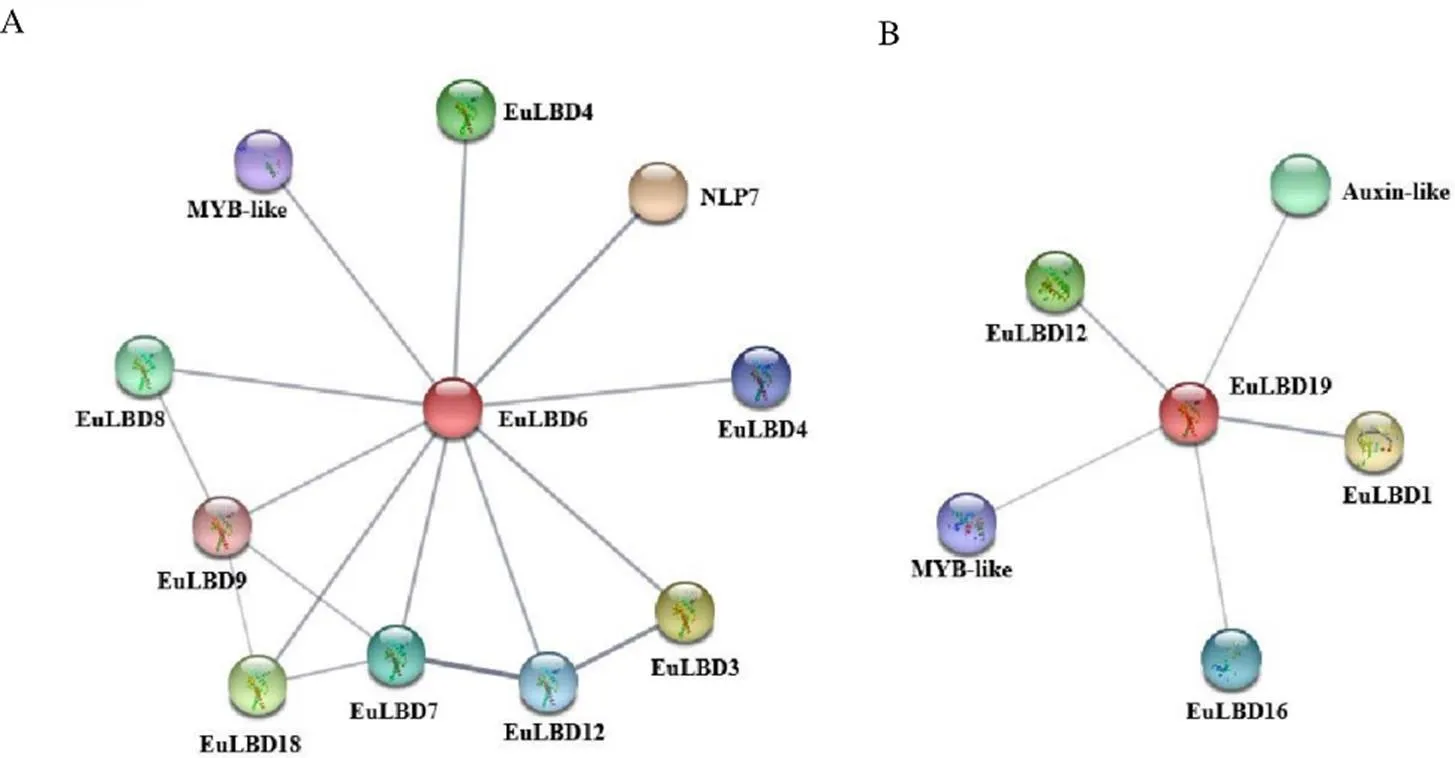
圖9 EuLBD6 (A) 和EuLBD19 (B) 蛋白相互作用網絡
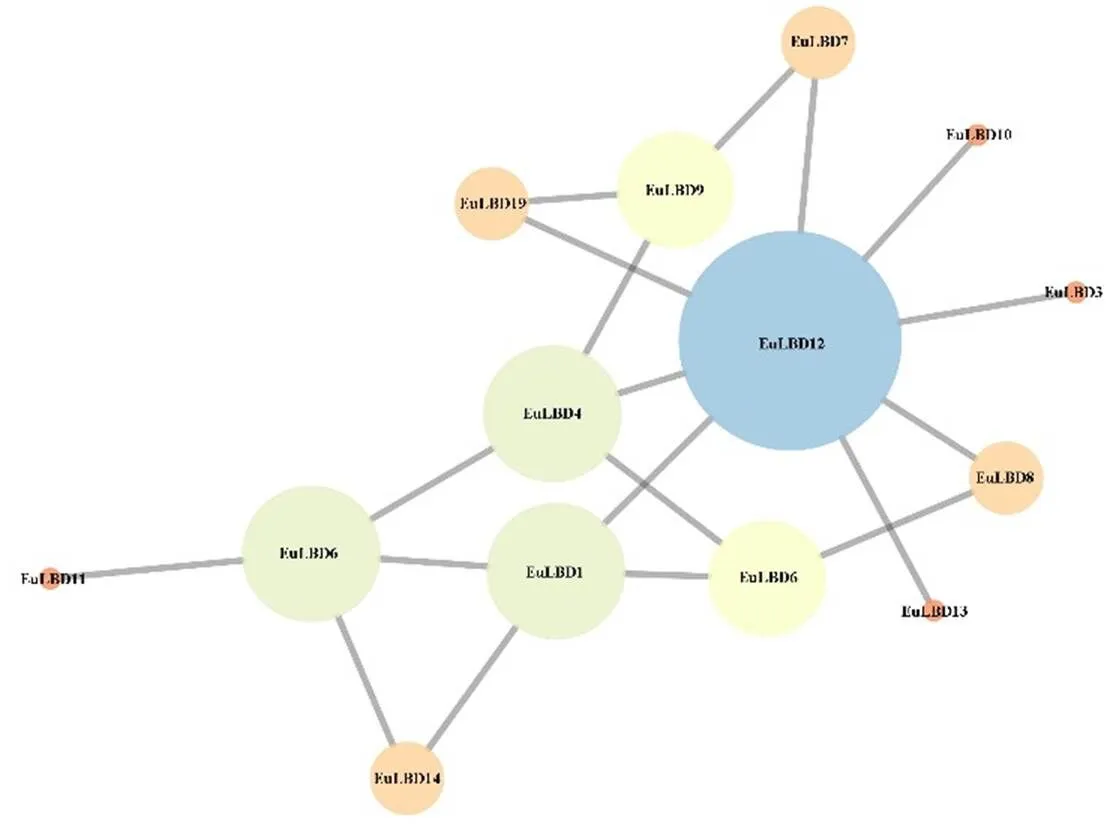
圖10 EuLBD基因家族蛋白互作網絡
擬南芥、水稻、杜仲和毛果楊LBD蛋白聚類分析結果顯示,19個EuLBDs分為2個大亞家族,分別是Class I和Class II,進一步劃分為7個小亞家族(Ia、Ib、Ic、Id、Ie、IIa和IIb)(圖3)。Class I大亞家族含有16個EuLBDs蛋白,Ia亞家族中所含EuLBDs蛋白數量最多,有7個EuLBDs,Ie亞家族不含EuLBDs。Class II大亞家族含有3個EuLBDs(分別是EuLBD6、EuLBD9、EuLBD12)。系統進化結果顯示,杜仲EuLBD5、EuLBD6、EuLBD11和EuLBD15與擬南芥AtLBD37(AtASL39)、AtLBD38(AtASL40)和AtLBD39(AtASL41)聚為一支,屬于Class II大亞家族。37、38和39參與擬南芥花青素合成和氮代謝[5,13,23],推測5、6、11和15可能具有功能相似性。14是6的同源基因,6(2)參與擬南芥花序發育調控[67],暗示14在杜仲花序發育中可能發揮重要作用。16(18)、17(15)和9(16)與杜仲1和13互為同源基因,16(18)、17(15)和9(16)誘導愈傷組織形成,參與植物的再生過程[68-69],表明1和13在杜仲愈傷組織形成中可能具有相似的功能。
基因結構決定基因功能,EuLBDs蛋白結構分析發現,同一亞家族含有相似的結構域,LX6LX3LX6L結構域(Motif 1)存在于所有EuLBDs轉錄因子中,表明EuLBDs轉錄因子結構具有保守性。不同EuLBDs轉錄因子結構存在差異,除EuLBD4和EuLBD11不含CX2CX6CX3C結構域(Motif 2)外,其他EuLBDs蛋白均含有Motif 2,Class I大亞家族基因結構較為復雜,不僅含有保守的LOB結構域,還含有特異結構域,這可能與基因功能的多樣性有關。
研究報道,水稻、小麥、擬南芥、毛果楊、番茄、辣椒、巨桉等物種LBD蛋白參與植物葉片發育、側生根形成、次生木質部和韌皮部發育、細胞分裂素、生長素以及非生物脅迫等生物學過程[15, 24, 43, 70-71]。基因表達與其功能特征密切相關,利用轉錄組數據,分析基因在杜仲葉片不同發育時期(圖7)以及杜仲膠含量中的表達模式(圖8)。結果顯示,基因在杜仲葉芽中轉錄水平最高,隨著葉片發育,表達水平逐漸減低,推測參與杜仲葉片發育,特別是葉芽形成期。6、12和16在葉片4個發育階段表達量均較高,表明6、12和16在杜仲葉片生長發育中發揮重要作用,這為進一步探索基因在杜仲葉片發育中的功能提供了重要的候選基因。4、9、13、15和18轉錄水平較低,在各發育階段表達豐度幾乎為0,暗示4、9、13、15和18在杜仲葉片中發揮的作用較小。6參與擬南芥旗葉形成,超表達6導致轉基因植株葉片細小、卷曲[12]。在水稻中,降低37和38表達水平,影響水稻抽穗時間關鍵基因1的表達,導致水稻延遲抽穗[72]。在巨桉中,37在韌皮部高量表達[6],超表達37導致轉基因植株次生木質部增厚,韌皮纖維增多[73],表明LBD基因家族在植物葉片發育、花序形成、次生發育等過程發揮重要作用。
進化分析顯示,6是擬南芥38的同源基因,在N/NO3缺失條件下,超表達38強烈抑制花青素合成關鍵調控因子PAP1和PAP2,以及類黃酮合成過程中花青素特異基因的表達;相反,38突變體在N/NO3充足條件下積累花青素,組成性表達花青素生物合成基因,38抑制多種氮應答基因表達,表明38是花青素生物合成和氮有效性利用的新抑制因子[74]。蛋白互作網絡結果顯示,EuLBD6不僅可以與LBD蛋白發生相互作用,還可與MYBL2蛋白互作,在擬南芥中mir858a通過翻譯抑制花青素生物合成關鍵負調控因子MYBL2的表達,是擬南芥幼苗花青素生物合成的正調控因子[75],推測6在杜仲花青素合成中可能也發揮重要作用。19與1互為同源基因,1在韌皮部和形成層中表達量最高,顯性抑制因子PtaLBD1通過與抑制因子SRDX區域融合,減少楊樹直徑增長,抑制韌皮部發育,并且高度不規則,表明1在楊樹次生木質部生長過程中具有廣泛的調控作用[76],暗示19在杜仲次生生長過程中可能也發揮重要作用。
綜上所述,本研究以杜仲全基因組數據為背景,對杜仲LBD轉錄因子家族進行了全面的生物信息學分析,共鑒定出19個基因,分為Class I與Class II 2大類,劃分為6個亞家族(Ia、Ib、Ic、Id與IIa、IIb)。理化性質分析顯示:EuLBDs編碼152~293個氨基酸,理論等電點分布于4.62~9.91,相對分子質量區域為17 420~31 820,均為親水性蛋白,以α-螺旋和無規則卷曲為主,亞細胞定位于細胞核中。EuLBDs蛋白含有類鋅指、亮氨酸拉鏈和甘氨酸-丙氨酸-絲氨酸(GAS)保守結構域。表達模式分析顯示,參與杜仲葉片發育,隨著葉片發育,轉錄水平逐漸降低,基因表達不受葉片膠含量的影響,本研究為深入研究杜仲基因功能奠定了理論基礎。
利益沖突 所有作者均聲明不存在利益沖突
[1] 程娜.剝皮對杜仲生長期內生理特性及次生代謝物含量的影響 [D].楊凌: 西北農林科技大學, 2009.
[2] Li Z Y, Gu J, Yan J,.Hypertensive cardiac remodeling effects of lignan extracts fromOliv.bark: A famous traditional Chinese medicine [J]., 2013, 41(4): 801-815.
[3] Husbands A, Bell E M, Shuai B,.LATERAL ORGAN BOUNDARIES defines a new family of DNA-binding transcription factors and can interact with specific bHLH proteins [J]., 2007, 35(19): 6663-6671.
[4] 王小非, 劉鑫, 蘇玲, 等.番茄LBD基因家族的全基因組序列鑒定及其進化和表達分析 [J].中國農業科學, 2013, 46(12): 2501-2513.
[5] 王美艷.兩種LBD轉錄因子及其DNA結合結構域的表達與純化 [D].楊凌: 西北農林科技大學, 2013.
[6] 蘆強.巨桉、毛果楊、雷蒙德氏棉LBD基因家族的研究 [D].北京: 中國林業科學研究院, 2017.
[7] Lin W C, Shuai B, Springer P S.Thelateral organ boundaries-domain gene asymmetric leaves2 functions in the repression ofgene expression and in adaxial-abaxial patterning [J]., 2003, 15(10): 2241-2252.
[8] Shuai B, Reynaga-Pe?a C G, Springer P S.The lateral organ boundaries gene defines a novel, plant-specific gene family [J]., 2002, 129(2): 747-761.
[9] 任楊柳.玉米側生器官分化基因轉化擬南芥的功能分析 [D].鄭州: 河南農業大學, 2017.
[10] Semiarti E, Ueno Y, Tsukaya H,.Thegene ofregulates formation of a symmetric, establishment of venation and repression of meristem-related homeobox genes in leaves [J]., 2001, 128(10): 1771-1783.
[11] Taramino G, Sauer M, Stauffer J L Jr,.The maize (L.)gene encodes a LOB domain protein that is a key regulator of embryonic seminal and post-embryonic shoot-borne root initiation [J]., 2007, 50(4): 649-659.
[12] Matsumura Y, Iwakawa H, Machida Y,.Characterization of genes in the asymmetric leaves2/lateral organ boundaries (As2/lob) family in, and functional and molecular comparisons between As2 and other family members [J]., 2009, 58(3): 525-537.
[13] Rubin G, Tohge T, Matsuda F,.Members of the LBD family of transcription factors repress anthocyanin synthesis and affect additional nitrogen responses in[J]., 2009, 21(11): 3567-3584.
[14] Albinsky D, Kusano M, Higuchi M,.Metabolomic screening applied to rice FOXlines leads to the identification of a gene-changing nitrogen metabolism [J]., 2010, 3(1): 125-142.
[15] Bell E M, Lin W C, Husbands A Y,.lateral organ boundaries negatively regulates brassinosteroid accumulation to limit growth in organ boundaries [J]., 2012, 109(51): 21146-21151.
[16] Thatcher L F, Powell J J, Aitken E A B,.The lateral organ boundaries domain transcription factor LBD20 functions inwilt susceptibility and jasmonate signaling in[J]., 2012, 160(1): 407-418.
[17] Kim M J, Kim M, Lee M R,.Lateral organ boundaries domain (lbd)10interacts with sidecar pollen/lbd27 to control pollen development in[J]., 2015, 81(5): 794-809.
[18] 湯瑋婧.LBD轉錄因子家族的起源與進化 [D].楊凌: 西北農林科技大學, 2013.
[19] Nakazawa M, Ichikawa T, Ishikawa A,.Activation tagging, a novel tool to dissect the functions of a gene family [J]., 2003, 34(5): 741-750.
[20] Chalfun-Junior A, Franken J, Mes J J,.ASYMMETRIC LEAVES2-LIKE1 gene, a member of the/family, controls proximal-distal patterning inpetals [J]., 2005, 57(4): 559-575.
[21] 張嬌嬌, 江力, 楊杰, 等.擬南芥抗旱突變體的篩選和鑒定 [J].合肥工業大學學報: 自然科學版, 2012, 35(4): 531-535.
[22] Berckmans B, Vassileva V, Schmid S P C,.Auxin-dependent cell cycle reactivation through transcriptional regulation ofE2Fa by lateral organ boundary proteins [J]., 2011, 23(10): 3671-3683.
[23] 李艷艷.紅豆杉韌皮部分化、發育關鍵基因的克隆及功能分析 [D].北京: 中國林業科學研究院, 2015.
[24] Okushima Y, Overvoorde P J, ARIMA K,.Functional genomic analysis of the auxin response factor gene family members in: Unique and overlapping functions of arf7 and arf19 [J]., 2005, 17(2): 444-463.
[25] Laplaze L, Parizot B, Baker A,.GAL4-GFP enhancer trap lines for genetic manipulation of lateral root development in[J]., 2005, 56(419): 2433-2442.
[26] Lee H W, Kim N Y, Lee D J,.LBD18/ASL20 regulates lateral root formation in combination with LBD16/ASL18 downstream of ARF7 and ARF19 in[J]., 2009, 151(3): 1377-1389.
[27] Lee H W, Kim N Y, Lee D J,.LBD18/ASL20 regulates lateral root formation in combination with LBD16/ASL18 downstream of ARF7 and ARF19 in[J]., 2009, 151(3): 1377-1389.
[28] 孫亭亭.煙草分枝異常類型突變體基因鑒定及相關家族分析[D].北京: 中國農業科學院, 2015.
[29] Iwakawa H, Ueno Y, Semiarti E,.The ASYMMETRIC LEAVES2 gene of, required for formation of a symmetric flat leaf, encodes a member of a novel family of proteins characterized by cysteine repeats and a leucine zipper [J]., 2002, 43(5): 467-478.
[30] 邢光偉.小麥LBD轉錄因子家族的鑒定、系統進化及表達分析 [D].楊凌: 西北農林科技大學, 2018.
[31] 馮書超.丹參轉錄因子SmLBD23和SmLBD16的克隆及功能研究 [D].西安: 陜西師范大學, 2018.
[32] Wuyun T N, Wang L, Liu H M,.The hardy rubber tree genome provides insights into the evolution of polyisoprene biosynthesis [J]., 2018, 11(3): 429-442.
[33] Yang Y, Yu X B, Wu P.Comparison and evolution analysis of two rice sub species lateral organ boundaries domain gene family and their evolutionary characterization from[J]., 2006, 39(1): 248-262.
[34] Zhang Y M, Zhang S Z, Zheng C C.Genomewide analysis of lateral organ boundaries domain gene family in[J]., 2014, 93(1): 79-91.
[35] Guo B J, Wang J, Lin S,.A genome-wide analysis of the asymmetric leaves2/lateral organ boundaries (As2/lob) gene family in barley (L.) [J]., 2016, 17(10): 763-774.
[36] Gombos M, Zombori Z, Szécsényi M,.Characterization of the LBD gene family in: A phylogenetic and transcriptional study [J]., 2017, 36(1): 61-79.
[37] Wu J, Liu S Y, Guan X Y,.Genome-wide identification and transcriptional profiling analysis of auxin response-related gene families in cucumber [J]., 2014, 7: 218.
[38] Liu H Z, Cao M X, Chen X L,.Genome-wide analysis of the lateral organ boundaries domain (LBD) gene family in[J]., 2019, 20(21): 5360.
[39] 鄭忠凡, 張亞利, 胡燦, 等.辣椒全基因組中LBD轉錄因子的鑒定與表達分析 [J].園藝學報, 2016, 43(4): 683-694.
[40] Yang T Q, Fang G Y, He H,.Genome-wide identification, evolutionary analysis and expression profiles of lateral organ boundaries domain gene family inand[J]., 2016, 11(8): e0161901.
[41] 劉同金, 張曉雪, 張曉輝, 等.蘿卜全基因組中LBD基因家族成員的鑒定與分析 [J].植物遺傳資源學報, 2019, 20(1): 168-178.
[42] 孫亭亭, 龔達平, 張磊, 等.普通煙草LBD基因家族的全基因組序列鑒定與表達分析 [J].植物遺傳資源學報, 2016, 17(2): 316-325.
[43] Luo Y W, Ma B, Zeng Q W,.Identification and characterization of lateral organ boundaries domain genes in mulberry,[J]., 2016, 8: 44-50.
[44] Grimplet J, Pimentel D, Agudelo-Romero P,.The lateral organ boundaries domain gene family in grapevine: Genome-wide characterization and expression analyses during developmental processes and stress responses [J]., 2017, 7(1): 15968.
[45] Wang X F, Zhang S Z, Su L,.A genome-wide analysis of the lbd (lateral organ boundaries domain) gene family inwith a functional characterization of mdlbd11 [J]., 2013, 8(2): e57044.
[46] Yu Q, Hu S M, Du J C,.Genome-wide identification and characterization of the lateral organ boundaries domain gene family invar.[J]., 2020, 42(1): 52-60.
[47] Gasteiger E, Gattiker A, Hoogland C,.ExPASy: The proteomics server for in-depth protein knowledge and analysis [J]., 2003, 31(13): 3784-3788.
[48] Geourjon C, Deléage G.SOPMA: Significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments [J]., 1995, 11(6): 681-684.
[49] Kelley L A, Sternberg M J E.Protein structure prediction on the Web: A case study using the Phyre server [J]., 2009, 4(3): 363-371.
[50] Larkin M A, Blackshields G, Brown N P,.Clustal W and clustal X version 2.0 [J]., 2007, 23(21): 2947-2948.
[51] Tamura K, Stecher G, Peterson D,.MEGA6: Molecular evolutionary genetics analysis version 6.0 [J]., 2013, 30(12): 2725-2729.
[52] Bailey T L, Williams N, Misleh C,.MEME: Discovering and analyzing DNA and protein sequence motifs [J]., 2006, 34: W369-W373.
[53] Higo K, Ugawa Y, Iwamoto M,.Plant-acting regulatory DNA elements (PLACE) database: 1999 [J]., 1999, 27(1): 297-300.
[54] Li L, Liu M H, Shi K,.Dynamic changes in metabolite accumulation and the transcriptome during leaf growth and development in[J]., 2019, 20(16): 4030.
[55] Liu J, Cheng Z C, Li X Y,.Expression analysis and regulation network identification of the-like gene family in moso bamboo () under photoperiod treatments [J]., 2019, 38(7): 607-626.
[56] Lee H W, Kim M J, Park M Y,.The conserved proline residue in the LOB domain of LBD18 is critical for DNA-binding and biological function [J]., 2013, 6(5): 1722-1725.
[57] Jing T, Wang L, Liu H M,.Genome-wide identification of mitogen-activated protein kinase cascade genes and transcriptional profiling analysis during organ development in[J]., 2017, 7(1): 17732.
[58] 朱利利, 慶軍, 杜慶鑫, 等.杜仲脂氧合酶基因家族全基因組鑒定及其表達特性研究 [J].植物研究, 2019, 39(6): 927-934.
[59] 王淋, 烏云塔娜, 葉生晶.杜仲EuHMGRS基因家族的鑒定及生物信息學分析 [J].經濟林研究, 2013, 31(4): 16-24.
[60] 烏云塔娜, 王淋, 葉生晶.杜仲甲羥戊酸激酶(EuMK)基因鑒定及生物信息學分析 [J].經濟林研究, 2014, 32(1): 6-12.
[61] 烏云塔娜, 王淋, 葉生晶.杜仲EuACOTS基因家族的鑒定及生物信息學分析 [J].經濟林研究, 2013, 31(4): 1-8.
[62] 王淋, 烏云塔娜, 葉生晶.杜仲EuHMGS基因鑒定及生物信息學分析 [J].經濟林研究, 2014, 32(1): 13-20.
[63] 賈喜濤, 劉文獻, 謝文剛, 等.蒺藜苜蓿LBD轉錄因子基因家族全基因組分析 [J].西北植物學報, 2014, 34(11): 2176-2187.
[64] 王淋.杜仲基因組分析及適應性和橡膠生物合成的分子基礎研究 [D].北京: 中國林業科學研究院, 2017.
[65] Burr B.Mapping and sequencing the rice genome [J]., 2002, 14(3): 521-523.
[66] International B I.Genome sequence analysis of the model grass: insights into grass genome evolution [J]., 2009, 463(7282): 763-768.
[67] Xu B, Li Z Y, Zhu Y,.genes AS1, AS2, and JAG negatively regulate boundary-specifying genes to promote sepal and petal development [J]., 2008, 146(2): 566-575.
[68] Fan M Z, Xu C Y, Xu K,.Lateral organ boundaries domain transcription factors direct callus formation inregeneration [J]., 2012, 22(7): 1169-1180.
[69] Liu J C, Sheng L H, Xu Y Q,.WOX11 and 12 are involved in the first-step cell fate transition during de novo root organogenesis in[J]., 2014, 26(3): 1081-1093.
[70] Naito T, Yamashino T, Kiba T,.A link between cytokinin and asl9 (asymmetric leaves 2 like 9) that belongs to the As2/lob (lateral organ boundaries) family genes in[J]., 2007, 71(5): 1269-1278.
[71] Zentella R, Zhang Z L, Park M,.Global analysis of della direct targets in early gibberellin signaling in[J]., 2007, 19(10): 3037-3057.
[72] Li C N, Zhu S S, Zhang H,.OsLBD37 and OsLBD38, two class II type LBD proteins, are involved in the regulation of heading date by controlling the expression of Ehd1 in rice [J]., 2017, 486(3): 720-725.
[73] Lu Q, Shao F J, MacMillan C,.Genomewide analysis of the lateral organ boundaries domain gene family inreveals members that differentially impact secondary growth [J]., 2018, 16(1): 124-136.
[74] Rubin G, Tohge T, Matsuda F,.Members of the LBD family of transcription factors repress anthocyanin synthesis and affect additional nitrogen responses in[J]., 2009, 21(11): 3567-3584.
[75] Wang Y L, Wang Y Q, Song Z Q,.Repression of MYBL2 by both microRNA858a and HY5 leads to the activation of anthocyanin biosynthetic pathway in[J]., 2016, 9(10): 1395-1405.
[76] Yordan S, Yordanov, Sharon R,.Members of the LATERAL ORGAN BOUNDARIES DOMAIN transcription factor family are involved in the regulation of secondary growth in populus [J]., 2010, 22: 3662-3677.
Identification, evolution and expression analysis ofgene family in
LIU Jun1, 4, 5, LI Long3, CHEN Yu-long1, WU Yao-song1, LIU Yan1, REN Shan-shan1, DONG Cheng-ming2
1.Henan Key Laboratory of TCM Prescription and Syndrome Signaling, Academy of Chinese Medicine, Henan University of Chinese Medicine, Zhengzhou 450046, China Henan Province Genuine Medicinal Materials Ecological Planting Engineering Technology Research Center, Henan Universityof Chinese Medicine, Zhengzhou 450046, China College of Forestry, Northwest Agriculture and Forestry University, Yangling 712100, China Key Open Laboratory of Bamboo and Rattan Science and Technology, International Center for Bamboo and Rattan, China National Forestry and Grassland Administration, Beijing 100102, China Anhui Taiping ExperimentalStation of International Center for Bamboo and Rattan, Huangshan 245716, China
In order to provide a basis for further research on the function ofgene, thegene family ofwas comprehensively identified in this study.Based ongenome database, this study used bioinformatics methods to identify and analyzegene family.A total of 19were identified fromgenome, which were divided into Class I and Class II groups and further divided into six subfamilies (Ia, Ib, Ic, Id and IIa, IIb).EuLBDs encodes 152—293 amino acids, and the theoretical isoelectric points distribution were 4.62—9.91, molecular weight between 17 420—31 820 by physicochemical analysis, all of EuLBD proteins were hydrophilic proteins.α-Helix and irregular curl were the main structure of the secondary structure in thegene family which was mainly expressed in nucleus.gene family had sinusoidal structure, the leucine zipper and the glycine-alanine-serine (GAS) structure domain.Expression pattern analysis showed thatinvolved inleaves development, and the transcription level ofgradually decreased with leaf development, which were not affected by the leaf gum content.In this study, the members of the LBD family were comprehensively identified and bioinformatics analysis from the genomic level of,which laid a foundation for further functional research ofgenes.
Oliver; LBD gene family; phylogeny analysis; gene expression;
R286.12
A
0253 - 2670(2022)10 - 3142 - 14
10.7501/j.issn.0253-2670.2022.10.025
2021-10-03
河南省高等學校重點科研項目(22A360005);國家林業和草原局/北京市共建竹藤科學與技術重點實驗室開放基金(ICBR-2020-05);國際竹藤中心安徽太平試驗中心開放課題基金(1632021006-4);河南中醫藥大學博士科研基金資助項目(RSBSJJ2019-04)
劉 俊(1990—),女,助理研究員,博士,主要從事藥用植物分子生物學研究。E-mail: liujun_0325@163.com
[責任編輯 時圣明]

