新塔花查耳酮合成酶基因克隆及表達分析
程 波,滿爾哈巴·海如拉,何 江
? 藥材與資源 ?
新塔花查耳酮合成酶基因克隆及表達分析
程 波,滿爾哈巴·海如拉,何 江*
新疆維吾爾自治區(qū)藥物研究所 新疆維吾爾藥重點實驗室,新疆 烏魯木齊 830004
克隆新塔花黃酮類化合物生物合成途徑中關鍵酶查耳酮合成酶(chalcone synthase,)基因,對其進行組織表達特異性分析,構建原核表達載體并進行重組蛋白誘導表達。結合新塔花轉錄組數(shù)據(jù)設計特異性引物,通過RT-PCR克隆新塔花查耳酮合成酶基因,對其進行生物信息學分析,通過RT-PCR進一步分析其組織表達特異性,構建原核表達載體pET28a-chs,并轉化至BL21(DE3)感受態(tài)細胞,經異丙基-β--硫代半乳糖苷(IPTG)誘導重組蛋白的表達。基因長1226 bp,包含一個長度為1176 bp的開放閱讀框,編碼319個氨基酸,其理論相對分子質量為42 848.37。該編碼蛋白定位于細胞質中,不存在跨膜區(qū)及信號肽,為非分泌蛋白,有1個糖基化位點和31個磷酸化位點。α-螺旋是該蛋白多肽鏈中大量的結構元件,散布于整個肽鏈之中。系統(tǒng)進化樹分析表明,新塔花基因與丹參、藿香、紫蘇等親緣關系最為接近。RT-PCR結果顯示基因在各組織中均有所表達,在葉中表達量較高,花相對表達量次之,根、莖中表達量相對較低。原核表達載體pET28a-chs在BL21(DE3)感受態(tài)細胞表達系統(tǒng)中,經IPTG誘導后,有明顯的重組蛋白表達,其相對分子質量為42 800,與預測相符合。通過對基因的全長cDNA克隆、組織表達特異性分析和原核表達載體的構建,為進一步研究基因在新塔花黃酮類化合物生物合成與基因調控提供依據(jù),最終為該藥材品質的提升奠定基礎。
新塔花;查耳酮合成酶;基因克隆;RT-PCR;原核表達
新塔花Juz.為唇形科塔花屬植物,多年生半灌木草本,又名唇香草、小葉薄荷,在我國僅產于新疆,資源較為豐富,是當?shù)孛褡遽t(yī)傳統(tǒng)習用藥材,維語名為蘇則,哈語名為滔加布孜[1]。具有強心利濕、理氣化痰、消炎散結之功效,用于心臟病、氣短多汗、水腫等疾患[2];也用于感冒發(fā)熱、高血壓、心悸失眠等癥[3]。新塔花富含金合歡素、山柰素、槲皮素等黃酮類生物活性成分,在當?shù)囟嘤糜谛呐K相關疾病的預防及治療[4-6]。
查耳酮合成酶(chalcone synthase,CHS)在植物生長發(fā)育過程中有著重要的作用,是植物黃酮類化合物合成的第一個關鍵酶,催化1分子4-香豆酰輔A(4-coumaroyl-CoA)和3分子丙二酰輔酶A(malonyl-CoA)結合形成柚皮素查耳酮(naringenin chalcone),該產物進一步轉化生成各種類型黃酮類化合物[7]。CHS在植物中廣泛存在,其中人參[8]、百合[9]、紅花[10]等多種藥用植物CHS已經被成功克隆。
目前,對新塔花中黃酮類化合物的研究,主要集中在提取與分離等理化性質的研究上,新塔花查耳酮合成酶(zbCHS)在黃酮類生物合成中的重要作用及相關文獻在國內外鮮見報道。本研究初次克隆了基因,分析了其在不同組織部位的表達,構建原核表達載體并誘導重組蛋白表達,初步了解了該酶的相關特性,為進一步研究該酶在黃酮類化合物生物合成以及相關基因調控方面奠定了堅實的科研基礎。
1 材料與試劑
1.1 植物材料
2019年5月下旬,采自新疆烏魯木齊南山向陽坡地初花期的新塔花植株,每個生物學重復3~5株,經75%乙醇搽洗潔凈后,用滅菌醫(yī)用剪將根、莖、葉、花等不同組織部位剪切成適宜小段,迅速置于液氮罐中暫存,?80 ℃冰箱中長期保存,備用。其樣本種屬鑒定由新疆維吾爾自治區(qū)藥物研究所何江研究員鑒定為唇形科塔花屬植物新塔花Juz.,標本保存于新疆維吾爾自治區(qū)藥物研究所維吾爾藥重點實驗室標本室。
1.2 主要試劑
RNAprep Pure多糖多酚植物總RNA提取試劑盒(北京天根有限公司),反轉錄試劑盒PrimeScript? RT-PCR Kit(TAKARA),實時熒光定量SYBR?Premix Ex TaqTMII(TAKARA)。Taq酶(2.5 U/μL)、dNTPs(2.5 mmol/L)、DL2000 DNA Mark、DH5α等均購自北京天根有限公司。pMD-19T、JM109、pET28a(+)、BL21(DE3)等均購自TAKARA公司。Tryptone、Agar、Yeast extract、瓊脂糖(GENE Biowest),核酸染料(Geneview)等均購自北京鼎國有限公司。液氮、無水乙醇、NaCl等其他常規(guī)試劑均購自國產分析純。本實驗引物的合成及其基因測序由北京華大基因科技股份有限公司完成,引物相關信息見表1。

表1 實驗中用到的引物及序列
2 方法
2.1 總RNA提取及cDNA的合成
取約100 mg組織樣本在液氮中迅速研磨成粉末,總RNA的提取依據(jù)RNAprep Pure多糖多酚植物總RNA提取試劑盒操作說明書進行,總RNA經過DNase I處理,再經1%瓊脂糖凝膠電泳檢測其完整性后,儲存于?80 ℃冰箱中備用。取約1 μg總RNA,以Random為引物進行1st cDNA的合成,具體方法依據(jù)PrimeScript? RT-PCR Kit操作說明書進行,其反轉錄產物存放于?20 ℃,備用。
2.2 zbCHS基因克隆與測序
根據(jù)本課題組前期獲得的新塔花轉錄組數(shù)據(jù)相關信息,采用Premier Primer 6.0設計一對特異性引物chs-F和chs-R。反應體系為25 μL,體系包含Taq酶0.25 μL、10×Buffer 2.5 μL、dNTP 2.0 μL、正反向引物各0.5 μL、總DNA 3μL、ddH2O 16.25 μL。PCR反應體系條件為:94 ℃、3 min;94 ℃、30 s,58 ℃、30 s,72 ℃、1.5 min,34個循環(huán);72 ℃、7 min;12 ℃持續(xù)。取5 μL PCR擴增產物,經1%瓊脂糖凝膠電泳,染色,紫外凝膠成像系統(tǒng)進行觀察,成像。用普通瓊脂糖凝膠DNA回收試劑盒回收PCR產物后,連接至pMD-19T載體,轉化至大腸桿菌DH5α感受態(tài)細胞,涂布于LB(含Amp)固體培養(yǎng)基平板上,37 ℃培養(yǎng)過夜。挑取單菌落為模板,用菌落PCR法篩選出陽性結果并送北京華大基因科技股份有限公司測序驗證。
2.3 zbCHS基因生物信息學分析
基于基因的測序結果,應用NCBI的ORF finder工具進行開放閱讀框(open reading frame,ORF)的查找以及推導編碼氨基酸序列。采用ProtParam(http://web.expasy.org/protparam)分析zbCHS蛋白的理化性質;應用ProtScale(http://web.expasy.org/prots-cale)對zbCHS蛋白的親水性進行預測;利用TMHMM Server2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0)分析zbCHS蛋白序列跨膜結構域;使用SignalP 5.0 server (http://www.cbs.dtu.dk/services/SignalP)分析zbCHS蛋白信號肽;PSORT(http://psort.hgc.jp)預測蛋白亞細胞定位;使用NetNGlyc server (http://www.cbs.dtu.dk/services/NetNGlyc)分析zbCHS蛋白糖基化位點;使用NetPhos server (http://www.cbs.dtu.dk/ services/NetPhos)分析zbCHS蛋白磷酸化位點;使用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_ automat.pl?page=/NPSA/np-sa_sopma.html)和SWISS MODEL (https://swissmodel.expasy.org)預測zbCHS蛋白二級與三級結構。在NCBI數(shù)據(jù)庫中通過BlastP進行檢索,搜索出與zbCHS蛋白氨基酸同源的其他植物氨基酸序列,采用MEGA6.0軟件的鄰接法(neighobor-joining)構建系統(tǒng)進化樹。
2.4 RT-PCR
以反轉錄得到新塔花不同組織的根、莖、葉、花1st cDNA為模板,依據(jù)前期新塔花轉錄組數(shù)據(jù)(ID:c143126_g2)篩選得到的18S rRNA作為內參基因,設計合成內參引物為18S-F和18S-R。依據(jù)軟件Primer6.0設計一對實時熒光定量PCR引物realtime-F和realtime-R,檢測其在根、莖、葉、花組織中zbCHS基因相對表達量。Real-Time PCR依據(jù)SYBR?Premix Ex TaqTMII試劑盒說明書進行,25 μL反應體系如下:SYBR Premix 12.5 μL,上下游引物各1 μL,cDNA模板2 μL,ddH2O 8.5 μL。反應程序:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,40個循環(huán)。每個樣品3次生物學重復,利用2?ΔΔCt相對定量的方法來檢測基因在不同組織根、莖、葉、花中的相對表達水平。
2.5 原核表達載體的構建
根據(jù)新塔花基因序列在原核表達體系中大腸桿菌密碼子偏好性及其使用頻率,對zbCHS基因編碼序列進行密碼子優(yōu)化,并在首尾分別加上Bam HI/Hind III酶切位點,密碼子優(yōu)化及其基因合成由大連寶生物工程有限公司完成。在微量離心管中配制12 μL反應體系(包含Insert DNA 1 μL;pET28a(+) 2 μL;5×In Fusion HD Enzyme Premix 2 μL和ddH2O 6 μL),于50 ℃保溫15 min。取2.5 μL產物,42 ℃熱激法轉化至感受態(tài)細胞JM109,涂布于含卡那霉素的LB固體培養(yǎng)基上,挑取單菌落用T7通用引物PCR擴增篩選陽性克隆,提取質粒測序,將構建正確的表達載體命名為pET28a-chs。
2.6 IPTG誘導表達
將質粒pET28a-chs和pET28a各取l μL轉入BL21(DE3)感受態(tài)細胞中;使用LB/抗生素Kan(50 μg/mL)平板,50 μL轉化液涂布,37 ℃過夜培養(yǎng)。挑取單菌落至2 mL LB/抗生素Kan液體培養(yǎng)基中,37 ℃過夜培養(yǎng)。取100 μL培養(yǎng)菌液加到5 mL LB/抗生素Kan液體培養(yǎng)基中,37 ℃培養(yǎng)至吸光度(600)值約為0.6。添加150 mmol/L IPTG 34 μL(終濃度為1 mmol/L IPTG)進行誘導,37 ℃培養(yǎng)4 h后集菌。加入320 μL PBS懸濁后進行超聲波破碎,對菌體破碎液12 000 r/min離心5 min,進行蛋白質抽提。分別取全蛋白、上清、沉淀抽提液各8 μL,加入2 μL 4×SDS Loading Buffer,置沸水加熱10 min,進行SDS-PAGE(5%濃縮膠,12%分離膠)電泳檢測重組蛋白是否表達。
3 結果
3.1 zbCHS基因克隆及序列分析
RT-PCR擴增產物經1%瓊脂糖凝膠電泳后,成功擴增出一條明顯的單一特異性核苷酸片段,其長度大小約為1.2 kb(圖1),經華大基因科技股份有限公司測序得到基因的核苷酸序列,經過進一步分析,其基因大小為1226 bp,含有1個由1176 bp組成的ORF,共計編碼391個氨基酸(圖2)。測序結果已提交至NCBI,登錄號為MN599471。
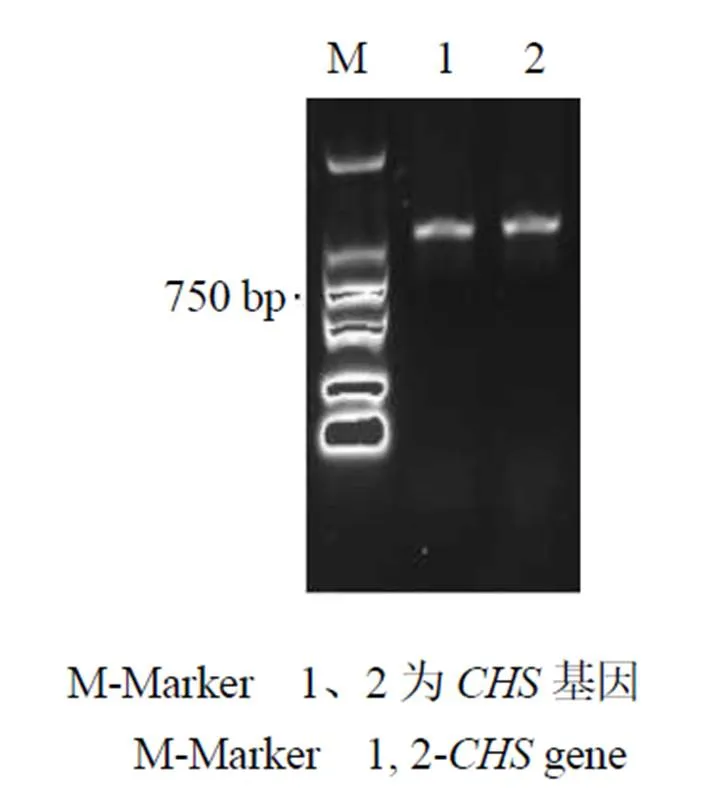
圖1 新塔花CHS基因PCR擴增
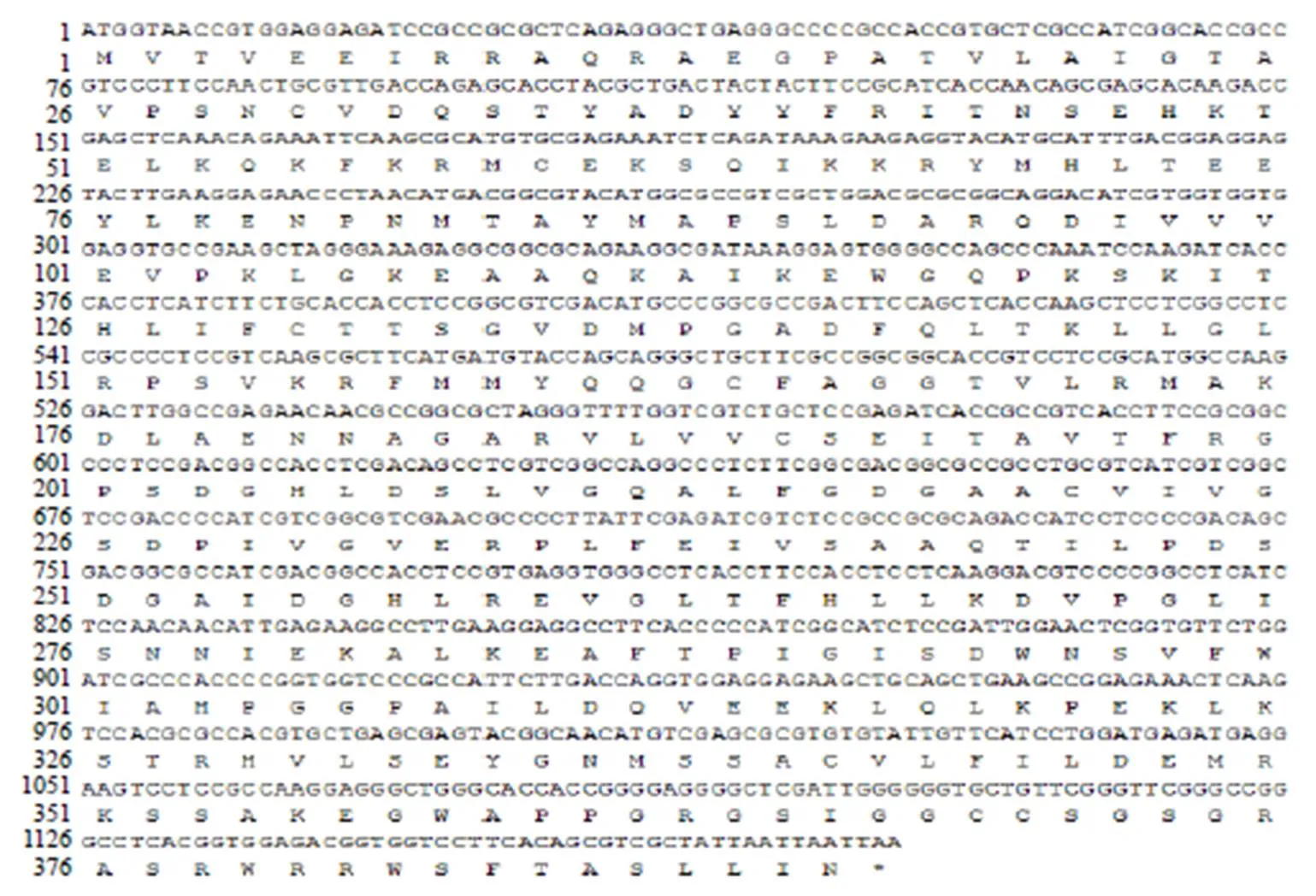
圖2 zbCHS基因ORF序列及相應氨基酸序列
3.2 zbCHS基因編碼蛋白理化性質分析
ProtParam分析預測基因編碼蛋白相對分子質量42 848.37,酸性氨基酸殘基(Asp+Glu)總數(shù)為43,堿性氨基酸殘基(Arg+Lys)總數(shù)為47,理論等電點8.48,化學式C1899H3033N527O560S20,脂肪指數(shù)86.32,不穩(wěn)定指數(shù)46.42,親水性指數(shù)(GRAVY)平均值為?0.159。ProtScale分析顯示該蛋白中氨基酸均勻分布于肽鏈中,其親水性氨基酸多于疏水性氨基酸,由此可推斷出該蛋白屬于不穩(wěn)定性親水蛋白。SignalP 5.0在線預測顯示該蛋白不存在明顯的信號肽,是一種非分泌蛋白。TMHMM 2.0在線預測該蛋白無明顯跨膜結構域。亞細胞定位結果顯示,該蛋白定位于細胞質中。NetNGlyc 1.0 Server在線預測該蛋白在82與336位置上各有1個糖基化位點。NetPhos 3.1 Server預測該蛋白具有31個磷酸化位點,其中絲氨酸為18個,蘇氨酸為10個,酪氨酸為3個,并存在著CKII、PKC、unsp、cdc2、EGFR、PKG、PKA、PKC等多種特異性蛋白激酶結合位點,見圖3。
3.3 zbCHS基因編碼蛋白的結構預測
結果(圖4)顯示,多肽鏈中α-螺旋(藍色部分)共計出現(xiàn)175個,占其總二級結構的含量為44.76%;無規(guī)則卷曲(紫色部分)共計出現(xiàn)125個,占其總二級結構的含量為31.97%;延伸鏈(紅色部分)共計出現(xiàn)65個,占其總二級結構的含量為16.62%;β-轉角(綠色部分)共計出現(xiàn)26個,占其總二級結構的含量為6.65%;α-螺旋是該蛋白多肽鏈中大量的結構元件,散布于整個肽鏈之中。以1d6f.1.B(chalcone synthase)為模板同源建模zbCHS三維結構,該編碼蛋白與模板相似性為77.49%,模型的GMQE值和QMEAN值分別為0.88和?0.88,建模可靠(圖5)。
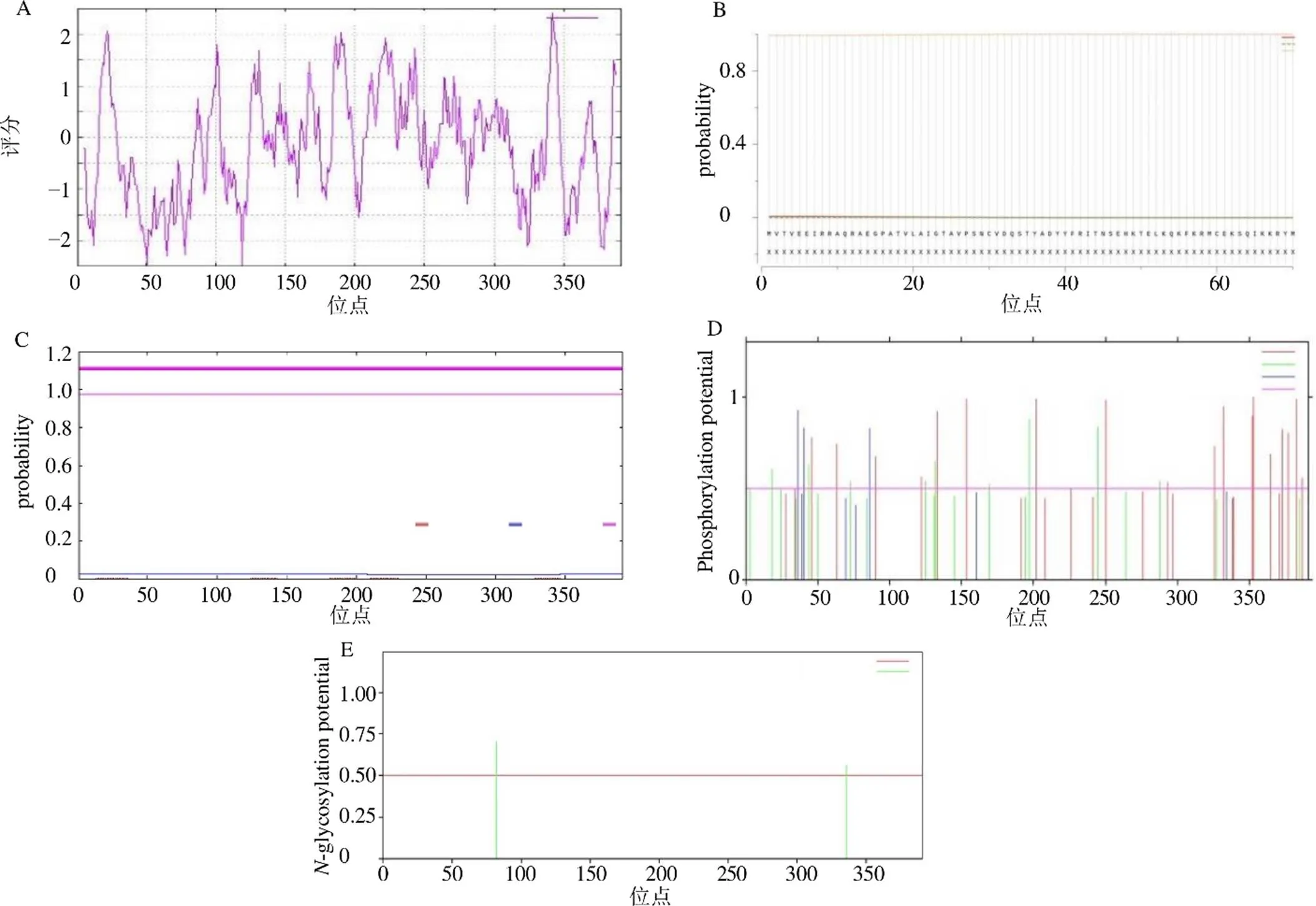
圖3 zbCHS蛋白親水性/疏水性(A)、蛋白信號肽(B)、蛋白跨膜結構域(C)、蛋白磷酸化位點(D)、蛋白糖基化位點(E)預測
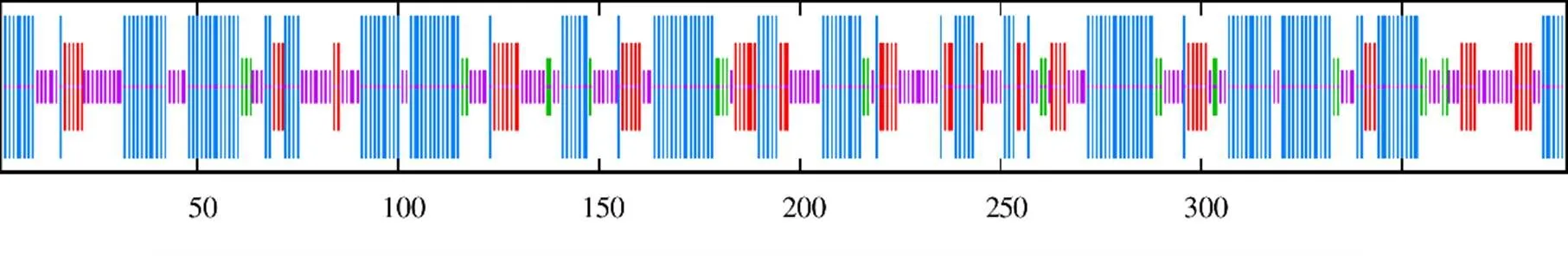
圖4 zbCHS編碼氨基酸序列二級結構預測
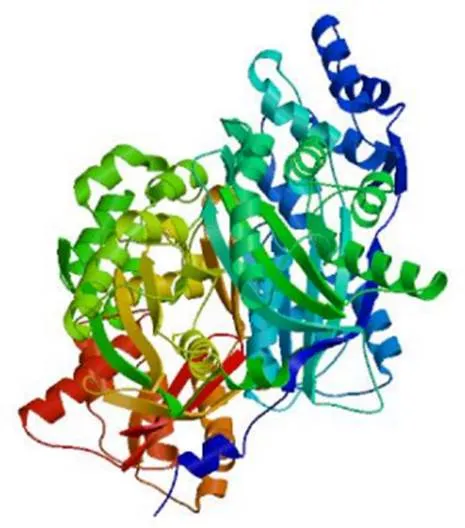
圖5 zbCHS基因編碼蛋白的三維結構預測
3.4 zbCHS編碼蛋白系統(tǒng)進化分析
利用NCBI的blastp功能將基因編碼蛋白序列與其他物種進行同源性比較,選取CHS序列一致性在80%~91%的彩葉草、紫蘇、藿香等13個植物,用MEGA6.0的鄰接法(neighbour- joining,N-J)對CHS編碼蛋白氨基酸序列構建系統(tǒng)進化樹(圖6),結果表明整個進化樹CHS蛋白進化為I、II、III 3大分枝,而新塔花基因則在第II支上,其與丹參、藿香、紫蘇等親緣關系最為接近。

圖6 不同植物CHS氨基酸序列分子進化分析
3.5 zbCHS mRNA在不同組織中相對表達分析
RT-PCR結果顯示(圖7),基因具有組織表達特異性,在新塔花的根、莖、葉、花組織中均有所表達,其中在葉中相對表達量較高,約是花中相對表達量的3倍。花相對表達量次之,根與莖中表達量相對較低。
3.6 zbCHS編碼蛋白誘導表達
根據(jù)大腸桿菌密碼子偏好性及其使用頻率,對基因編碼序列進行密碼子優(yōu)化后,通過人工合成基因序列(圖8)將構建表達載體pET28a-chs轉化至BL21(DE3)感受態(tài)細胞,挑取單克隆于37 ℃培養(yǎng)至600為0.6左右,加入終濃度為1 mmol/L IPTG進行誘導,37 ℃培養(yǎng)4 h,菌液超聲波破碎后經過SDS-PAGE電泳檢測,結果在42 800處菌液全細胞與沉淀都存在明顯的特異蛋白質條帶,而上清液中很弱或是無表達(圖9),zbCHS生物信息學預測的分子質量約為42 800,據(jù)此判斷其為誘導表達的zbCHS重組蛋白。以上結果表明,zbCHS重組蛋白主要是以包涵體的形式存在。
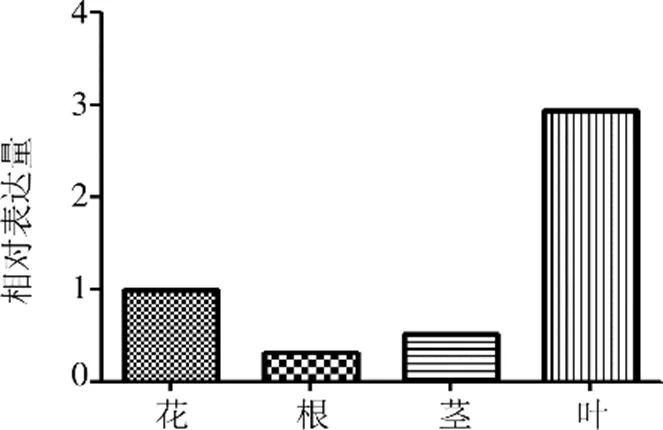
圖7 不同組織zbCHS mRNA水平表達分析(n=3)
4 討論
本研究成功克隆了基因,該基因具有1176 bp的開放閱讀框,編碼391個氨基酸。該蛋白屬于不穩(wěn)定性親水蛋白,不存在明顯的信號肽,是一種非分泌蛋白。無明顯跨膜結構域,定位于細胞質中,在82與336位置上各有1個糖基化位點,具有31個磷酸化位點,并存在著多種特異性蛋白激酶結合位點。α-螺旋是該蛋白多肽鏈中大量的結構元件,散布于整個肽鏈之中。系統(tǒng)進化樹分析表明,zbCHS與丹參、藿香、紫蘇等親緣關系最為接近。RT-PCR結果顯示基因在根、莖、葉、花中均有所表達,其中葉中相對表達量最高,花相對表達量次之,根、莖中相對表達量較低。通過IPTG成功的進行了原核重組蛋白的誘導表達。

圖8 zbCHS基因編碼序列的優(yōu)化
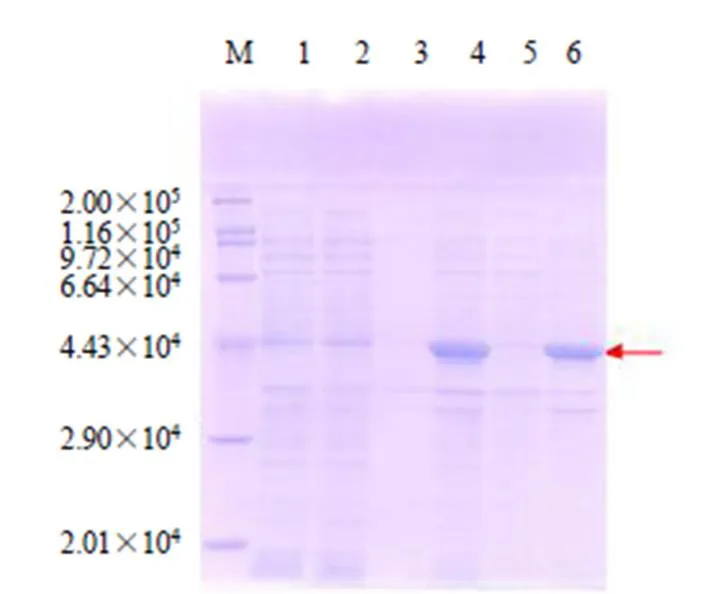
M-Marker 1-pET28a全細胞 2-pET28a上清 3-pET28a沉淀 4-pET28a-chs全細胞 5-pET28a-chs上清 6-pET28a-chs沉淀
植物CHS是黃酮類生物合成途徑中的一個重要的關鍵酶,廣泛存在于各類植物中,直接或間接影響植物代謝產物合成、抗性調節(jié)、花色形成等過程[11]。基因編碼區(qū)十分保守,cDNA全長約1200 bp,編碼390個左右氨基酸,基因家族成員間的氨基酸一致性達到80%[12]。這與本次研究結果相一致,說明其在相關結構及其功能方面具有一定的穩(wěn)定性,推測基因在參與體內重要黃酮類化合物的生物合成過程中,與其他植物的基因可能行使相同或相似的生物學功能。
隨著植物黃酮類生物合成途徑中相關酶的分離鑒定,利用相關的酶表達來改變黃酮類生物活性物質組成,將成為改良作物及其中藥品質的一種新手段。孟衡玲等[13]發(fā)現(xiàn)鐵皮石斛基因在不同時期分別參與激素運輸與器官形態(tài)建成和類黃酮物質合成。陳潔等[14]以百合為材料,采用農桿菌介導法獲得了轉正義基因的煙草植株,其黃酮含量升高14.0%~59.7%。柳忠玉等[15]成功構建了虎杖查耳酮合酶基因RNAi載體,獲得了干涉基因表達下調的轉化植株,抑制基因的表達,白藜蘆醇苷量均得到顯著提高,其中最高量是對照植株的3倍。Verhoeyen等[16]將基因和黃酮醇合酶基因共同轉化至番茄后,增加了番茄中黃酮醇的含量,提高了其抗氧化水平。以上相關研究報道表明將基因進行克隆對于提高中藥活性成分的量或品質具有十分重要作用。
RT-PCR分析結果顯示,新塔花基因在根、莖、葉、花中均有所表達,其中在葉中相對表達量最高,約為花中相對表達量的3倍,花相對表達量次之,而根、莖中相對表達量較低。植物中基因在不同的發(fā)育時期表達位置有所差異,一些早期發(fā)育階段的植物,基因出現(xiàn)在葉片組織中[17],而成熟植株中主要在花組織中表達[18]。而此次新塔花葉中表達較高,這可能是由于采摘時,正是新塔花初花期,花朵還沒有正式開放,養(yǎng)分大部分輸送給了葉,相關的代謝終產物積累在葉組織中,導致根與莖因養(yǎng)分供應相對不足,而出現(xiàn)表達量相對較低的現(xiàn)象。
利益沖突 所有作者均聲明不存在利益沖突
[1] 李偉, 趙翡翠.民族藥新塔花質量標準研究 [J].中國現(xiàn)代應用藥學, 2011, 28(3): 236-241.
[2] 劉勇民.維吾爾藥志-上冊 [M].修訂版.烏魯木齊: 新疆科技衛(wèi)生出版社(K), 1999: 263.
[3] 徐新, 巴哈爾古麗·黃爾汗.哈薩克藥志(第一卷)[M].北京: 民族出版社, 2009: 126.
[4] 楊偉俊, 哈木拉提, 孫玉華, 等.芳香新塔花對大鼠急性心肌缺血和乳鼠心肌細胞的保護作用 [J].現(xiàn)代藥物與臨床, 2010, 25(3): 194-198.
[5] 陳秋紅, 李欽, 楊偉俊, 等.芳香新塔花總黃酮對大鼠離體心臟缺血再灌注損傷的保護作用 [J].中國現(xiàn)代應用藥學, 2015, 32(3): 264-268.
[6] Yang W J, Liu C, Gu Z Y,.Protective effects of acacetin isolated fromLam.(Xintahua) on neonatal rat cardiomyocytes [J]., 2014, 9(1): 28.
[7] Koes R E, Quattrocchio F, Mol J N M.The flavonoid biosynthetic pathway in plants: Function and evolution [J]., 1994, 16(2): 123-132.
[8] 張變玲, 黃雪梅, 劉心怡, 等.人參查耳酮合成酶基因PgCHS1的克隆與表達分析 [J].中國細胞生物學學報, 2018, 40(12): 2010-2017.
[9] 楊麗, 劉雅莉, 王躍進, 等.百合查耳酮合成酶(CHS)基因的克隆與分析 [J].西北植物學報, 2006, 26(5): 933-936.
[10] 康亞蘭, 裴瑾, 劉薇, 等.紅花查耳酮合成酶基因的克隆、生物信息學分析及表達 [J].中草藥, 2014, 45(16): 2385-2389.
[11] 李苗, 李國旗.査爾酮合成酶基因及其分子進化研究進展 [J].中國農學通報, 2015, 31(18): 116-120.
[12] Han Y Y, Ming F, Wang W,.Molecular evolution and functional specialization ofsuperfamily fromorchid [J]., 2006, 128(1/2/3): 429-438.
[13] 孟衡玲, 張薇, 盧丙越, 等.鐵皮石斛查耳酮合酶基因克隆與表達分析 [J].南方農業(yè)學報, 2016, 47(12): 2015-2019.
[14] 陳潔, 安利清, 王濤, 等.百合查耳酮合成酶基因克隆及其轉化煙草的花色表達分析 [J].西北植物學報, 2012, 32(8): 1511-1517.
[15] 柳忠玉, 趙樹進.虎杖查耳酮合酶基因RNAi載體的構建及其遺傳轉化 [J].中草藥, 2015, 46(3): 412-417.
[16] Verhoeyen M E, Bovy A, Collins G,.Increasing antioxidant levels in tomatoes through modification of the flavonoid biosynthetic pathway [J]., 2002, 53(377): 2099-2106.
[17] Knogge W, Schmelzer E, Weissenb?ck G.The role ofin the regulation of flavonoid biosynthesis in developing oat primary leaves [J]., 1986, 250(2): 364-372.
[18] Koes R E, Spelt C E, Reif H J,.Floral tissue of(V30) expresses only one member of the chalcone synthase multigene family [J]., 1986, 14(13): 5229.
Cloning and expression analysis of chalcone synthase gene from
CHENGBo, MANERHABAHairula, HEJiang
Key Laboratory of Xinjiang Uighur Medicine, Xinjiang Institute of Materia Medica, Urumqi, 830004, China
To clone the key gene of chalcone synthase (zbCHS) in flavonoid biosynthesis pathway of, analyze tissue-specific expression of the chalcone synthase, construct the prokaryotic expression vector and induce the recombinant protein to express.Based on the transcriptome data of Zb in the previous study, the full-length cDNA of ZbCHS was cloned by RT-PCR and bioinformatics analysis was performed.The RT-PCR was used to analyze the tissue-specific expression of ZbCHS.The prokaryotic expression vector pET28a-CHS was constructed, transformed into BL21 (DE3) competent cells and the expression of recombinant protein was induced by IPTG.The size ofgene was 1226 bp, containing an open reading frame (ORF) of 1176 bp and encoding 319 amino acids.The theoretical molecular weight of ZbCHS protein was 42 848.37.The encoded protein was located in the cytoplasm without a transmembrane region and signal peptide.It was a non-secretory protein with one glycosylation site and 31 phosphorylation sites.The α-helix was a large number of structural elements in that polypeptide chain, which was scattered throughout the peptide chain.Phylogenetic analysis indicated that the sequence of the amino acids was most closely related to,, andof Real-Time PCR showed thatgene was expressed in all tissues, with a higher expression level and a relatively lower expression level in roots and stems.Prokaryotic expression vector pET28a-CHS was expressed in BL21(DE3) competent cell expression system after induction by IPTG, and its molecular weight was 42 800, which was consistent with the prediction.Through the full-length cDNA cloning ofgene, tissue-specific expression analysis and prokaryotic expression vector construction, we can provide the basis for further study on the biosynthesis and gene regulation of ZbCHS gene in, and finally lays the foundation for the improvement of the quality of this herb.
Juz.; CHS; gene clone; real-time PCR; prokaryotic expression
R282.12
A
0253 - 2670(2022)10 - 3134 - 08
10.7501/j.issn.0253-2670.2022.10.024
2021-09-06
國家自然科學基金資助項目(81860748);新疆維吾爾自治區(qū)自然科學基金資助項目(2017D01B45);國家中醫(yī)局青年岐黃學者項目
程 波,碩士,研究方向為植物功能基因組學及生藥學。E-mail: chengbo0417@163.com
通信作者:何 江,研究員,博士,研究方向為生藥與藥用植物資源。E-mail: hj_1211@163.com
[責任編輯 時圣明]

