重慶市臨床試驗機構研究協調員培訓現狀分析
曹麗亞,陳勇川,謝江川,潘辛梅,謝林利
(中國人民解放軍陸軍軍醫大學第一附屬醫院,重慶 400038)
臨床研究協調員(CRC)是研究者、申辦者和受試者間的紐帶,在研究中心協助研究者進行非醫學性判斷的事務工作,其專業化水平的高低直接影響臨床試驗的質量[1]。目前,暫無統一的CRC 資格認定或行業準入標準,不同公司CRC 的專業水平參差不齊,高質量的培訓顯得尤為重要。本研究中調查了CRC 的培訓現狀和需求,并分析了存在的不足,旨在為開展CRC 的高質量培訓提供參考。現報道如下。
1 資料與方法
1.1 調查對象
以重慶市22家臨床試驗機構在研臨床試驗項目中的CRC為調查對象,于2019年3月至9月對其發放問卷調查表,對回收問卷進行流水編號,錄入問卷數據庫,并對其進行統計與分析。
1.2 問卷內容
問卷設置單選題和多選題。針對調查對象,內容包括被調查對象的年齡、學歷、專業、工作經歷、單位性質等基本信息;針對培訓現狀,內容包括參加崗前培訓的形式、時間、上崗要求及勝任程度,上崗后培訓的形式、頻率、是否考核、滿意度等;針對培訓需求,內容包括工作難點、效率影響、欠缺的培訓內容、最實用的方式、影響參加培訓的原因等。
2 結果
2.1 被調查對象基本情況
共發放問卷140 份,回收有效問卷110 份,有效回收率為78.57%。被調查對象基本情況見表1。
2.2 CRC 培訓現狀
崗前培訓:CRC 崗前培訓形式和時間見表2,CRC認為崗前培訓能勝任的工作量見表3,CRC 獨立上崗的要求見表4。
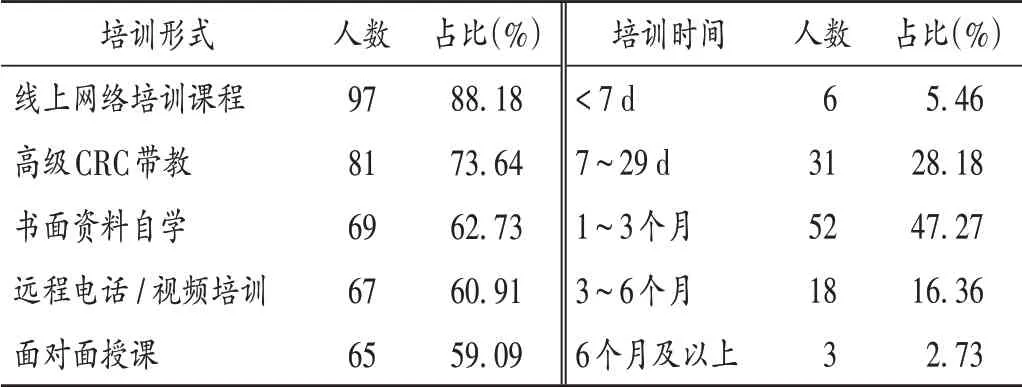
表2 CRC崗前培訓形式和時間(n =110)Tab.2 Model and time of the pre-job training for CRC(n=110)

表3 CRC認為崗前培訓能勝任的工作量(n=110)Tab.3 Amount of work that CRC believes they can do after the pre-job training(n=110)
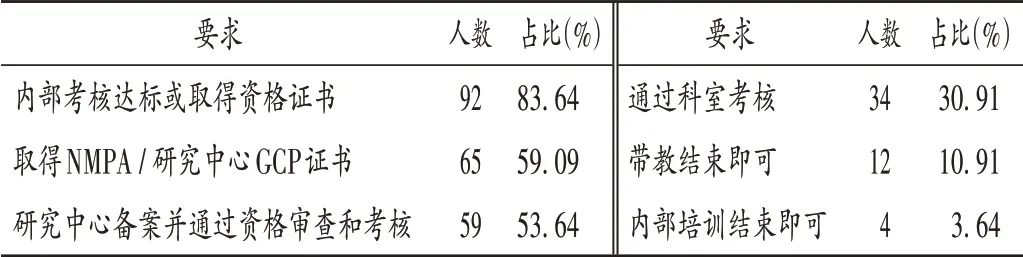
表4 CRC獨立上崗的要求(n=110)Tab.4 Requirements for independent employment of CRC(n=110)
上崗后培訓:CRC 上崗后培訓的主要來源見表5。CRC 上崗后接受所在公司繼續教育培訓的頻率為每1~2 周1 次的占45.45%(50/ 110),每月1 次的占39.09%(43/ 110),3 個月以上或新項目啟動時才培訓的占15.46%(17/110);僅65.45%(72/110)的CRC 表示繼續教育后會進行考核。

表5 CRC上崗后培訓的主要來源(n=110)Tab.5 Primaiy sources of the post-job training for CRC(n=110)
2.3 CRC 培訓需求
滿意度調查:CRC 對本單位培訓滿意和很滿意的占61.82%(68/ 110),不滿意的占38.18%(42/ 110),不滿意的原因包括培訓內容實用性不強、培訓過于簡單等;85.45%(94/110)的CRC 表示沒有固定頻率參加 其他單位組織的培訓,對其他單位或組織的培訓滿意和很滿意的CRC 占70.91%(78/ 110)。影響CRC 參加其他單位或組織培訓的原因中,64.55%(71/110)表示工作太忙而沒時間和精力,42.73%(47/110)表示地點太遠而無法協調,36.36%(40/ 110)表示培訓機會少;89.09%(98/110)表示本單位組織的業務培訓最實用,其次是研究中心機構內部的培訓和申辦方項目組的培訓,分別占75.45%(83/110)和64.55%(71/110)。
欠缺的培訓內容:見表6。
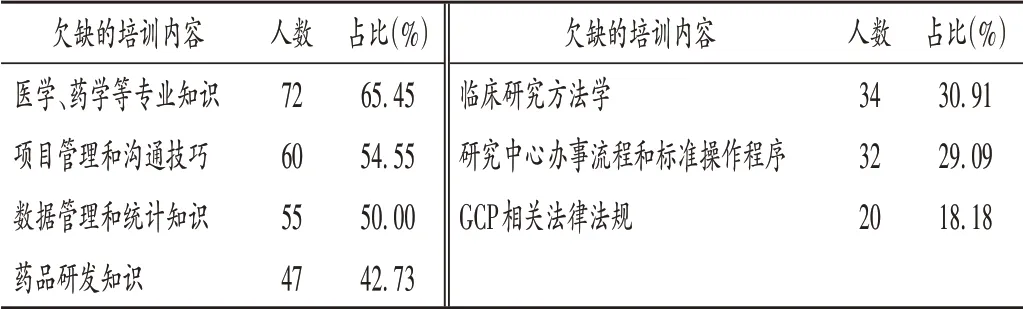
表6 CRC認為欠缺的培訓內容(n=110)Tab.6 Training content deemed insufficient by CRC(n=110)
工作難點:排在前3位的分別為與研究者和醫技等輔助科室合作、項目更換交接、協調安排各中心訪視,分別占50.00%(55/ 110)、44.55%(49/ 110)、39.09%(43/110)。
3 討論
3.1 CRC 屬新興行業且尚無統一準入標準
由表1 可知,CRC 從業人員年齡多為20~30 歲(87.27%),對學歷、專業和既往工作背景要求不嚴格,行業準入門檻不高,且由其他行業轉行做CRC的比例較高(10.00%),這主要與我國臨床試驗開展的數量增加和質量要求提高有關。CRC 主要工作場所在醫院,但絕大多數CRC 來自合同研究組織(CRO)或臨床機構管理組織(SMO),占93.64%,不同公司的準入門檻和管理能力參差不齊,目前并無統一的行業準入標準[2]。工作中偶有發現CRC無醫藥相關背景,甚至沒有經過系統培訓被派遣到臨床試驗機構開展工作,這將給受試者、臨床試驗機構和申辦方帶來巨大風險。
建議逐漸為CRC 職業設定專業人才培養機制,如在本科教育中開設相關專業或課程,或將臨床試驗的相關知識融入臨床醫學、藥學、護理學、生物學等專業的本科教育中,促進CRC 的規范化培養與高等教育的交叉融合;依托研究機構和企業建立聯合培養機制,培養專業的CRC 人才。目前,其他城市已有高校與醫院、企業合作,在傳統藥學專業課程中加入CRC 相關課程,結合實踐帶教,探索校、醫、教協同視域下的CRC 聯合培養機制[3]。同時,建議設定統一的行業準入標準,明確CRC 的教育程度、培訓內容和時長,并進行模擬實踐等,全部達標后,方可獲得行業準入資格。
3.2 尚無統一的CRC 培訓體系
由表2可知,各公司或單位培訓形式多樣,不同公司CRC獨立上崗前培訓的形式和時長不一,但總的培訓時間較短,培訓時間少于3 個月的占80.91%,多數培訓由CRC 所在公司完成,說明崗前培訓的強度和內容不夠。在當前行業發展背景下,快速上崗已成為臨床試驗參與各方的迫切需求,內部考核、機構培訓、實踐帶教等方式可在一定程度上幫助CRC快速上崗,但不同公司和研究機構對CRC 的培訓內容和強度不一。除取得《藥物臨床試驗質量管理規范》(GCP)證書外,目前尚無統一的資質規定,僅有GCP 證書并不能達到具體工作要求。上崗后的繼續教育培訓是更新專業知識和提高業務能力的重要組成部分。由表5可知,CRC的上崗后培訓主要由其所在公司或申辦方項目組組織,國家藥品監督管理局、醫院或相關組織每年組織的學習班或研修班受時間、精力、成本等因素影響,培訓強度和效果參差不齊。
本調查結果顯示,CRC 認為其所在SMO 公司、研究中心和申辦方的培訓最實用,側面反映相關監管部門或其他具有公信力的組織對CRC 的培訓不夠,缺乏權威、系統的培訓體系。目前,由臨床研究專業協會(ACRP)及社會臨床研究組織(SoCRA)提供的CRC 培訓及資格認證服務獲業界廣泛認可[4];其他城市已有高校、醫院和組織探索CRC 的規范化培訓,創建適合中國的CRC 規范化培訓和認證體系,但尚未建立官方或行業協會性質的CRC培訓及認證標準[5]。
3.3 CRC 培訓需求大且內容廣
在臨床試驗中,CRC 負責試驗藥品管理、物資管理、協調訪視、協助研究者進行醫學資料收集、安全事件上報等工作[6]。在我國專職臨床研究人員極其缺乏的現狀下,CRC 除具備良好的溝通協調能力外,還需掌握醫學、藥學、統計學等專業知識,具有良好醫藥背景的CRC在與研究者和受試者溝通協作時優勢明顯[7]。CRC通常被認為從事大量事務性工作,培訓內容主要包括GCP 相關法律法規、倫理、受試者保護等基礎內容,以及項目開展的具體事務工作要點,而針對醫學、藥學等專業知識的深度教育較欠缺。除專業技能的培訓外,作為申辦方、研究者、受試者和臨床試驗機構、倫理各方的紐帶,協調能力和溝通技巧等方面的培訓也較欠缺,加之絕大多數CRC 為第三方公司派遣到醫院開展工作,在與研究者、臨床試驗機構、倫理和醫技科室溝通協作時易產生孤立無援的感覺。故培訓中應增加職業教育,增強其工作自信心和職業歸屬感。此外,本次調查結果還顯示,臨床試驗機構培訓的實用性僅次于所在公司,但其對CRC 的培訓僅占30.91% ,說明臨床試驗機構對于CRC的培訓和管理還有待加強。
3.4 小結
重慶市醫藥研發事業正處于大力發展階段,已出臺多項相關政策鼓勵新藥研發,臨床試驗是其中至關重要的一環[8]。配備足量、高水平的CRC,保證臨床試驗及時、有效實施,已成為醫藥研發的迫切需求。規范化培訓是提升行業認知和提高從業人員整體水平的有效途徑。規范化的CRC 培訓系統需要政府引導、臨床試驗機構落地實施和臨床研究行業的協同與支持,多方協作建立滿足臨床試驗開展需求的培訓體系,促進重慶市乃至全國新藥臨床研究事業的發展。本研究中尚存在一些不足,如調查區域較單一,培訓內容受相關政策或法規影響,問卷設計未涉及相關內容,故其結論有一定局限性,后續將進一步研究。

