高遷移率族蛋白B1過表達對子宮內膜癌細胞增殖、周期和凋亡的影響及機制研究
趙 瑾,胡海燕,周艷紅
(西安醫學院第二附屬醫院,陜西 西安 710038)
子宮內膜癌是常見的婦科惡性腫瘤之一,是指原發于子宮內膜的一種上皮性惡性腫瘤,占女性生殖道惡性腫瘤1/4左右[1]。子宮內膜癌多見于圍絕經期或絕經后婦女,隨著人口的老齡化與體檢人群的擴大,子宮內膜癌的發病人數逐年增加,已成為一種比較嚴重的公共衛生問題[2]。手術為子宮內膜癌的首選治療方法,能顯著提高患者的生存率。但是由于各種因素的影響,很多子宮內膜癌患者在發病時已確診為中晚期子宮內膜癌,預后較差[3]。為此在臨床上與基礎醫學上需要進一步研究子宮內膜癌的發病機制,從而有利于尋找更好的子宮內膜癌治療靶點[4]。現代研究[5-6]表明,子宮內膜癌的發生與發展周期比較長,涉及的關鍵因子比較多,包括抑癌基因失活、細胞增殖失衡、細胞凋亡失衡、癌基因激活等。高遷移率族蛋白(High mobility group protein,HMG)為一種DNA結合非組蛋白,最先發現于牛胸腺細胞。HMGB1為HMG的主要家族成員,是一種重要的促炎性細胞因子[7]。在機體受到內外在各種因素的刺激時,HMGB1的表達量會顯著增加。B細胞特異性小鼠白血病病毒插入位點1(B-cell-specific moloney murine leukemia virus insertion site 1,Bmi-1)屬于多梳蛋白單位,可影響細胞染色質的結構,從而影響細胞的生長、增殖與凋亡等[8-9]。本文探討了HMGB1過表達對子宮內膜癌細胞增殖、周期和凋亡的影響,并闡述了相關機制。現報告如下。
1 材料與方法
1.1 實驗材料 子宮內膜癌細胞(Ishikawa細胞)購自于北京協和醫學院基礎醫學院細胞庫,100 U/ml青霉素(批號83516333)、0.1 mg/ml鏈霉素(批號184726222)、0.25%胰蛋白酶(批號28384414)購自Invitrogen公司,RPMI-1640培養基(批號72737214)購自Gibco公司,胎牛血清(批號8232176)購自Sciencell公司,pcDNA3.0-HMGB1載體與pcDNA3.0載體保存本院實驗室。
1.2 實驗方法
1.2.1 細胞分組與轉染:Ishikawa細胞均采用RPMI-1640培養基進行培養(100 U/ml青霉素+0.1 mg/ml鏈霉素+10%胎牛血清)進行培養,每2~3 d傳代1次,培養條件:37 ℃、5% CO2。Ishikawa細胞(對數生長期)隨機平分為三組:pcDNA3.0組、pcDNA3.0-HMGB1組與對照組。pcDNA3.0組、pcDNA3.0-HMGB1組分別轉染pcDNA3.0載體與pcDNA3.0-HMGB1載體,轉染濃度為50 nmol/L;對照組以等體積的磷酸鹽緩沖液進行轉染。轉染前12 h,于96孔培養板接種Ishikawa細胞。用250 μl磷酸鹽緩沖液稀釋5 μl Lipo2000 Transfection Reagen,靜置5 min。然后用25 μl 磷酸鹽緩沖液稀釋pcDNA3.0-HMGB1載體或pcDNA3.0載體,孵育5 min后混合Lipo2000 Transfection Reagen稀釋液,滴入RPMI-1640培養基中,轉染后6 h換液1次。
1.2.2 MTT法檢測細胞增殖指數:轉染后將對數生長期的Ishikawa細胞接種于無菌的96孔板中(密度為3×105細胞/孔),培養24 h后然后每孔加入5 mg/ml的20 μl MTT試劑,繼續培養4 h,加入200 μl的二甲基亞砜,在振蕩器上進行避光振蕩溶解10 min,測定與計算細胞增殖指數。
1.2.3 流式細胞儀檢測細胞凋亡與細胞周期:轉染后將對數生長期的Ishikawa細胞接種于無菌的6孔板中,采用Annexin V-FITC/PI細胞凋亡檢測試劑盒進行避光染色60 min,采用流式細胞儀(美國BD公司)檢測細胞凋亡指數。轉染后將對數生長期的Ishikawa細胞接種于無菌的6孔板中,培養24 h后,加入70.0%乙醇重懸細胞,4 ℃固定過夜,然后加入100.0 mg/L的碘化丙啶染色液,孵育15 min后上流式細胞儀檢測細胞周期。
1.2.4 Transwell小室檢測細胞侵襲與轉移指數:轉染后將對數生長期的Ishikawa細胞接種于Transwell小室的上室中(1×105細胞/孔),Transwell小室下室加入常規培養基,培養36 h后取出Tranawell小室,進行甲醛固定,然后加入0.1%結晶紫染色30 min,計算細胞轉移指數。在侵襲實驗中,實驗前24 h將基質膠置于室溫下溶解,小室內加入基質膠100 μl,后續處理同細胞轉移實驗,計算細胞侵襲指數。
1.2.5 Western blot法檢測蛋白表達:轉染后將對數生長期的Ishikawa細胞提取細胞總蛋白,定量蛋白濃度后進行蛋白電泳,采用Western blot法檢測Bmi-1、HMGB1表達水平(一抗稀釋濃度為1∶1000;二抗稀釋濃度為1∶2000,一抗孵育時間為12 h,二抗孵育時間為1 h),以β-actin作為內參,曝光后記錄與計算Bmi-1、HMGB1蛋白相對表達水平。
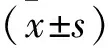
2 結 果
2.1 三組細胞增殖指數與凋亡指數對比 轉染后36、72 h,pcDNA3.0-HMGB1組的細胞增殖指數高于pcDNA3.0組與對照組(均P<0.05),細胞凋亡指數低于pcDNA3.0組與對照組(均P<0.05),見表1。

表1 三組細胞增殖指數與凋亡指數對比(%)
2.2 三組細胞周期比例對比 轉染后36、72 h,pcDNA3.0-HMGB1組的G0/G1期比例高于pcDNA3.0組與對照組(均P<0.05),S期和G2/M期比例低于pcDNA3.0組與對照組(均P<0.05),見表2。

表2 三組細胞周期比例對比(%)
2.3 三組細胞侵襲與轉移指數對比 轉染后36、72 h,pcDNA3.0-HMGB1組的細胞侵襲與轉移指數高于pcDNA3.0組與對照組,差異具有統計學意義(均P<0.05),見表3。

表3 三組細胞侵襲與轉移指數對比(%)
2.4 三組Bmi-1、HMGB1蛋白相對表達水平對比 轉染后36、72 h,pcDNA3.0-HMGB1組的Bmi-1、HMGB1蛋白相對表達水平高于pcDNA3.0組與對照組(均P<0.05),見表4。

表4 三組Bmi-1、HMGB1蛋白相對表達水平對比
3 討 論
由于各種因素的影響,近年來子宮內膜癌的發病率逐年增高,部分患者在出現癥狀時才進行就診,多數此時已確診為中晚期子宮內膜癌,導致預后比較差,也使得1年生存率與5年生存率一直居高不下[10]。此早期發現子宮內膜癌侵襲及轉移的分子和信號通路具有重要價值[11]。HMGB1為一種轉錄細胞因子,也為一種炎癥因子和損傷信號分子之一,HMGB1可介導炎性級聯反應從而導致組織發生損傷[12-13]。HMGB1能與特定的靶基因轉錄序列結合,誘導基因轉錄,使核轉錄因子NF-κB p65由細胞質向細胞核轉移,進而誘導IκB磷酸化降解。HMGB1均在子宮內膜癌組織中均存在異常高表達,靶向抑制HMGB1的表達可以顯著抑子宮內膜癌細胞的增殖和促進子宮內膜癌細胞的凋亡。本研究顯示轉染后36、72 h,pcDNA3.0-HMGB1組的細胞增殖指數高于pcDNA3.0組與對照組,細胞凋亡指數低于pcDNA3.0組與對照組,表明HMGB1過表達能促進子宮內膜癌細胞增殖、抑制細胞凋亡。
子宮內膜癌的發生與發展過程比較復雜,涉及腫瘤細胞的增殖與凋亡。腫瘤細胞的增殖與凋亡是相互調節的復雜過程,也受到細胞周期的調控[14-15]。本研究顯示轉染后36、72 h,pcDNA3.0-HMGB1組的G0/G1期比例高于pcDNA3.0組與對照組,S期和G2/M期比例低于pcDNA3.0組與對照組,表明HMGB1過表達能調節子宮內膜癌細胞周期。從機制上分析,HMGB1與腫瘤組織的血管生成存在相關性,由215個氨基酸組成,廣泛分布于肝臟、腎臟、肺臟、心臟等部位[16]。HMGB1的過表達可通過活化細胞的主動分泌或壞死細胞被動釋放進入胞外,從而激發機體出現過量炎性反應,導致細胞周期發生紊亂,促進腫瘤組織血管生成[17-18]。
在人體內的子宮內膜癌發生以及發展過程中,腫瘤的侵襲及轉移可能具有十分關鍵的作用。腫瘤的侵襲及轉移是子宮內膜癌發展與惡化的重要表現,也是導致子宮內膜癌患者病情惡化的主要因素[19-20]。本研究顯示轉染后36、72 h,pcDNA3.0-HMGB1組的細胞侵襲與轉移指數高于pcDNA3.0組與對照組,表明HMGB1過表達能促進子宮內膜癌細胞侵襲與轉移。HMGB1為調控基因復制、重組、轉錄等過程的重要蛋白,可被壞死或受損細胞被動釋放至胞外,并引發炎癥,導致機體病情惡化。本研究顯示轉染后36、72 h,pcDNA3.0-HMGB1組的Bmi-1、HMGB1蛋白相對表達水平高于pcDNA3.0組與對照組,表明HMGB1過表達能促進子宮內膜癌細胞Bmi-1蛋白的表達。由于經費限制,本研究沒有進行抑制HMGB1表達的分析,也沒有進行靶基因分析,將在后續研究中探討。
總之,HMGB1過表達能促進子宮內膜癌細胞增殖、侵襲、轉移及Bmi-1蛋白表達,抑制細胞凋亡,調節細胞周期。

