穗花杉雙黃酮對骨肉瘤細胞增殖及周期相關蛋白的影響
李正華,紀 濤,任建政,范躍星,陳小龍
(1.武警陜西省總隊醫院,陜西 西安 710054;2.武警山西省總隊醫院,山西 太原 030006;3.陜西省人民醫院,陜西 西安710068)
骨肉瘤作為一種原發性惡性骨腫瘤,主要發病于青少年[1],且在青少年中,發病率呈逐年上升趨勢,該疾病嚴重影響患者的正常生活甚至生命安全[2]。目前,放療、化療、手術切除等方法一般較多地用于臨床對骨肉瘤患者的治療,這些方法僅僅某種程度上延緩病情進展,但無法根治轉移性或復發性骨肉瘤患者[3-4]。因此,臨床上急切需要新的治療骨肉瘤的方法和藥物。研究[5]顯示,穗花杉雙黃酮(Amentoflame,AF)具有調節凋亡信號通路、清除自由基、抗炎和抗氧化應激等功能,除此之外,文獻[6-8]報道AF明顯抑制肺腺癌、乳腺癌、胃癌細胞的增殖。但AF抑制骨肉瘤細胞增殖的分子機制尚不清楚。本實驗通過CCK-8實驗,細胞周期實驗,Real time PCR及Western blot實驗探究AF抑制骨肉瘤細胞增殖及其信號通路,為臨床骨肉瘤的防治提供理論依據。
1 材料與方法
1.1 實驗材料 骨肉瘤細胞購自武漢普諾賽生命科技有限公司。免疫組化試劑盒購于北京中杉金橋生物技術有限公司,SDS-PAGE 凝膠配制試劑盒、RIPA 裂解液、BCA 蛋白濃度測定試劑盒均購自美國康寧公司,AF購于上海源葉生物科技有限公司,純度≥98%,AF由 DMSO 溶解。流式細胞儀購于美國BD Pharmingen 公司,細胞周期試劑盒購于美國BD公司,Cyclin D1、p21、β-catenin和GAPDH抗體均購于美國Cell Signal Technolgy公司,CCK-8試劑購于上海酶聯生物,全自動酶標儀購自美國伯騰儀器有限公司(Bio Tek)。
1.2 實驗方法
1.2.1 細胞培養:將細胞接種在含有DMEM完全培養基的5% CO2培養箱中,培養基每3 d更換1次,當細胞接近鋪滿瓶底時,根據后續實驗要求,對細胞進行處理。
1.2.2 CCK-8法檢測細胞活力:實驗分為0、25、50、75、125 μmol/L組,每孔接種吸取4×103個骨肉瘤細胞,24 h后,加入20 μl CCK-8反應液,繼續孵育4 h,在酶標儀波長為490 nm時,測定各孔吸光度(吸光度代表細胞活力),并進行統計學分析。
1.2.3 細胞周期檢測:向6 孔細胞板加入2 ml×105個/ml的骨肉瘤細胞懸液,次日,實驗分為對照組和AF(75 μmol/L AF)組,培養24 h后,收集細胞。將PBS洗滌3 次后的細胞進行染色后,上機檢測細胞周期。
1.2.4 Western blot檢測增殖相關蛋白表達:細胞處理方法和收獲細胞方法與1.2.3相同,BCA法用于總蛋白的濃度,將蛋白和1× loading buffer 1∶1混勻,每孔上樣20 μg,進行SDS-PAGE 電泳,之后用5%脫脂奶粉封閉2 h。將膜放入配制好的Cyclin D1(1∶1000)、β-catenin(1∶1000)、GAPDH(1∶1000)和p21(1∶1000)一抗稀釋液,將膜放入4 ℃孵育過夜,次日,用PBS洗膜3次,放入稀釋的 HRP 標記山羊抗兔 IgG稀釋液(1∶3000)并在室溫下孵育 1 h,GAPDH作為內參。使用ECL Western(Thermo Fisher Scientific,Inc.)記錄并分析染色蛋白條帶[Image Lab(圖像處理軟件)V4.0]。
1.2.5 Real time PCR法檢測增殖相關基因表達:細胞處理方法和獲取與1.2.3相同,收集細胞,以總RNA 為模板合成cDNA,配制含有20 μl的反應體系,進行PCR反應。采用2-ΔΔCt法分析各基因相對表達量,各引物序列見表1。

表1 PCR基因引物序列相關信息
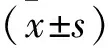
2 結 果
2.1 AF抑制骨肉瘤細胞活力 見圖1。25、50 μmol/L的AF對骨肉瘤細胞吸光度值沒有顯著作用,75、125 μmol/L AF顯著抑制骨肉瘤細胞吸光度值,與25、50 μmol/L AF比較差異有統計學意義(P<0.05)。本研究中75 μmol/L(AF組)是對骨肉瘤細胞具有抑制作用的最適宜濃度。

注:與25、50 μmol/L AF比較,*P<0.05
2.2 AF抑制骨肉瘤細胞從G1向S期過渡 見表2。與對照組(0 μmol/L)相比,AF組中,處于G0/G1期細胞百分比顯著增加(P<0.05),處于S期細胞百分比顯著減少(P<0.05)。

表2 兩組細胞周期分布比較(%)
2.3 AF抑制骨肉瘤細胞β-catenin核轉錄以及增殖相關蛋白和 mRNA表達 對照組中,β-catenin(綠色)的表達主要集中在細胞核,AF組中,β-catenin(綠色)的表達主要集中在細胞質,免疫熒光實驗結果表明,相比對照組,AF顯著抑制β-catenin(綠色)在骨肉瘤細胞核中的表達水平(圖2A)。與對照組相比,AF顯著抑制β-catenin蛋白表達水平,上調p21蛋白表達水平(均P<0.05)(圖2B、C)。相比對照組,AF顯著下調β-catenin、Cyclin D1 mRNA 表達、促進p21 mRNA表達(均P< 0.05)(圖3)。

A:免疫熒光法檢測β-catenin在細胞核表達水平;B:Western blot 檢測β-catenin蛋白表達水平;C:骨肉瘤細胞中β-catenin蛋白表達水平柱狀分析圖(與對照組比較,*P<0.05)

注:Real time PCR法檢測Cyclin D1(A)、p21(B)和β-catenin(C)mRNA表達水平(與對照組比較,*P<0.05)
3 討 論
骨肉瘤一般發生于長骨的干骺端,具有發病率高、惡性程度高、發展迅速、轉移率高、預后極差的特點[9-10]。目前,手術聯合化療方法較多地用于臨床治療原位骨肉瘤,但是,患者的治愈率低和復發程度高[11],因此,尋求新的有效的治療方案極為迫切。
本研究中,CCK-8 結果證實濃度為75 μmol/L的AF能夠抑制骨肉瘤細胞的增殖。流式細胞周期實驗進一步證實75 μmol/L AF可以顯著抑制骨肉瘤細胞從G1期向S期過渡。免疫熒光、Western blot和Real time PCR實驗證實AF顯著抑制β-catenin的核表達,進而抑制周期蛋白Cyclin D1,促進p21表達,最終抑制細胞周期和增殖。
AF作為黃酮類中藥單體,是一種卷柏提取物,文獻[12-14]報道AF具有抑制腫瘤細胞增殖和促進腫瘤細胞凋亡的作用,AF 通過干擾微管動力學和誘發DNA損傷引發SKOV3細胞分裂停滯在G2期。最新研究[15]表明,AF可以通過誘發人神經膠質瘤中的自噬依賴性鐵死亡進而抑制細胞增殖并誘導細胞凋亡。
在腫瘤的發展和形成中,Wnt/β-catenin信號通路發揮著重要的作用,參與腫瘤細胞的凋亡和增殖。作為Wnt/β-catenin 信號通路的關鍵調控蛋白,β-catenin在腫瘤中表達上調[16],并且在各類細胞中起著粘連并傳遞信號的作用[17],文獻[18]報道,β-catenin的表達與致癌活性有關。β-catenin作為一種典型的粘連蛋白,是經典的Wnt信號重要的轉錄因子,在各類細胞中起著粘連并傳遞信號的作用[19]。Cyclin D1在調節細胞周期進程中起著至關重要的作用,Lin等[20]發現了一個完美的T細胞因子4(Tcf4)結合位點(CTTGATC),該位點位于Cyclin D1啟動子區域中的核苷酸(-80和-73之間),該結論提示 β-catenin/Tcf4途徑可能參與了對T細胞因子4的調控下 Cyclin D1表達。文獻[21]報道在乳腺癌細胞系中,β-catenin/Tcf4途徑參與細胞 Cyclin D1啟動子的激活。Cyclin D1和p21,是細胞周期調控極為重要的調節因子,Cyclin D1主要參與細胞周期的基因突變和隨后細胞周期G1/S期的轉變[22]。p21 作為細胞周期蛋白依賴性激酶抑制劑(CKIs)家族成員之一,對CDK的抑制會在細胞周期的G1和G2階段觸發細胞周期停滯[23],β-catenin是黏附連接的關鍵成員,位于正常細胞膜胞質側的黏附復合物上,在病理條件下,由于藥物或者細胞因子的刺激,β-catenin可能會進入細胞核[24-26]。在細胞核中,β-catenin可與轉錄因子 LEF相互作用,觸發Wnt/β-catenin下游基因的轉錄和表達[27]。文獻[28]報道,龍葵堿通過調控p-AKT、Cleaved Caspase 3和p53蛋白表達抑制卵巢癌細胞增殖。TRIM21調控β-catenin抑制人結直腸癌細胞增殖[29]。
腫瘤發生的基礎是β-ctenin細胞核中的異常積累,原癌基因c-myc 激活,引發β-ctenin和Cyclin D1 的上調[30]。β-catenin作為Cyclin D1的直接調控基因,β-catenin上調可激活Cyclin D1表達[31]。Cyclin D1已被確定為調節細胞周期不可或缺的因素,是細胞周期蛋白家族的一員[32]。Cyclin D1和p21負責調控Cyclin D1/CDK/CKI信號通路,監測G1期到S期的過渡,從而調控細胞分裂和增殖[23]。p21 是一種含有 165 個氨基酸的蛋白質,細胞正常增殖時,在p21 N 端,p21與細胞周期蛋白 D/E/A 結合形成復合體[33]。在細胞中饑餓會引起p21積累,CDK/Cyclin復合物解聚,細胞則停留在G1期[34]。本研究證實AF抑制了骨肉瘤細胞內Cyclin D1并促進p21的表達,抑制骨肉瘤細胞增殖。文獻[35]報道,AF對卵巢癌細胞的抑制作用主要靠調控S 期激酶相關蛋白2(Skp2)的表達。有研究[36]證實,AF抑制人肝癌細胞增殖主要通過下調ERK 表達。
本研究證實AF可調控細胞內周期蛋白進而抑制骨肉瘤細胞增殖。這一發現為骨肉瘤的臨床診治提供了新的理論參考和依據。

