HBV相關肝癌與非病毒相關肝癌臨床特征對比分析
李建 成警花 田杰 李囿萱 廖德仲 徐靜
根據最新全球癌癥統計數據顯示,在所有癌癥中原發性肝癌(primary liver cancer,PLC)發病率(4.7%)排名第六,死亡率(8.3%)排在第三,而在中國其發病率及死亡率更是排在第五和第二[1-2]。盡管PLC目前已有多種治療手段,但其5年凈存活率仍僅有5%~30%,因此而造成的疾病負擔仍在繼續加重[3-5]。乙型肝炎病毒(hepatitis B virus,HBV)感染、丙型肝炎病毒(hepatitis C virus,HCV)感染、肝硬化等是該病常見的致病因素[6]。近年來隨著生活質量的提高,肥胖和糖尿病等非感染性PLC增加,但在亞洲這些慢性乙肝流行的地區,特別是中國,HBV感染仍是PLC的最主要致病因素[7-9]。而不同致病因素導致的PLC臨床特點有所差異,為此,本研究將對HBV-PLC與NBNC-PLC的臨床特征進行對比分析,并探討差異部分背后的原因,以期為HBV-PLC、NBNC-PLC的臨床診治及相關研究提供參考。
資料與方法
一、研究對象
選取從2018年3月至2021年3月在貴州中醫藥大學第二附屬醫院腫瘤內科住院的47例PLC患者,其中HBV-PLC 28例、NBNC-PLC19例。
二、納入、排除及分組標準
納入標準:①參照《原發性肝癌診療規范(2019年版)》[10]診斷標準,確診為PLC;②近3個月未接受過系統抗腫瘤治療。排除標準:①合并其他原發性腫瘤的患者;②合并HCV感染的患者。分組標準:入院血清HBsAg陽性和(或)HBV-DNA陽性患者納入HBV-PLC組,HBsAg陰性和HBV -DNA陰性患者納入 NBNC-PLC組。
三、數據收集
為避免治療帶來影響,所有臨床數據收集于患者入院第一天給予治療前;部分患者影像學及病理資料欠缺(具體見統計結果),1名患者缺失血生化檢查,余數據均完整。
四、統計學分析
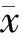
結 果
一、兩組性別、發病年齡、腫瘤分期以及影像學、病理資料比較
兩組性別無統計學差異,而HBV-PLC患者[(60.97±12.18)歲]發病年齡比NBNC-PLC患者[(69.28±11.73)歲]年輕約10歲,差異有統計學意義(P<0.05)。影像學上兩組在腫瘤個數、門靜脈癌栓形成、腫瘤大體病理分型以及淋巴轉移方面無統計學差異(P>0.05),但在腫瘤病灶位置上,HBV-PLC明顯好發于肝右葉(79.2%),NBNC-PLC傾向于肝左葉(50%)(P<0.05),且HBV-PLC比NBNC-PLC更容易發生遠處轉移(P<0.05)。組織病理分型上HBV-PLC傾向于HCC(92.9%),而NBNC-PLC傾向于CC(58.3%)(P<0.05),但在分化程度上兩組無統計學差異(P>0.05)。在TNM、BCLC分期上兩組沒有統計學差異(P>0.05)。見表1。
表1 兩組患者一般資料比較
二、血生化指標
兩組在TP、Alb、GLO、ALP、CHE、LDH上無顯著差異(P>0.05),但HBV-PLC中AST、ALT、TBil、DBil、IBil、TBA、γ-GT更高,且Child-Pugh分級也更高,差異有統計學意義(P<0.05),HBV-PLC血生化指標相對較差。見表2。
三、腫瘤標志物
腫瘤標志物上兩組的CEA、CA125、CA199、CA724沒有統計學差異(P>0.05),而HBV-PLC血清AFP明顯高于NBNC-PLC(P<0.05)。見表3。
四、凝血功能
凝血功能方面,HBV-PLC患者PT、INR、TT要更長,而PTA、FIB則相對較低(P<0.05),APTT上兩者無統計學差異(P>0.05)。HBV-PLC患者的凝血功能更差。見表4。
討 論
本研究患者中HBV-PLC組29名(61.7%),NBNC-PLC組18名(38.3%),說明在中國HBV是PLC的一個主要致病因素,也反映我國HBV感染形勢仍然十分嚴峻。相關研究表明,截至2017年中國HBV感染率仍有6.89%,西部地區更是達到8.92%[11]。
本研究發現PLC男性發病率(87.2%)遠高于女性(12.8%),但HBV-PLC與NBNC-PLC在性別上卻無統計學差異。而在發病年齡上,HBV-PLC患者則比NBNC-PLC患者年輕約10歲,這與既往報道相似[12]。原因可能是HBV引起的肝炎有助于炎癥-壞死-再生過程,或者是HBV的DNA可以直接插入肝細胞基因序列引起癌變,使得癌變的進程縮短[13-14]。

表2 兩組患者血生化指標比較
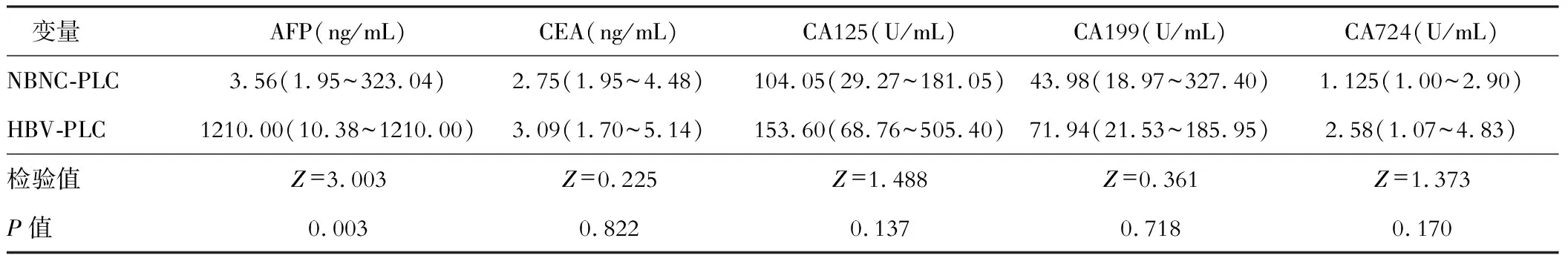
表3 腫瘤標志物比較

表4 凝血功能比較
本研究發現HBV-PLC更容易發生遠處轉移。這可能與HBV上調Twist1表達,促進上皮細胞-間充質轉化,以及轉化生長因子-β能激活乙肝病毒X蛋白(hepatitis B virus x protein,HBx)相關長鏈非編碼RNA通過誘導自噬促進細胞侵襲和遷移有關[15-16]。而在腫瘤病灶位置上HBV-PLC明顯好發于肝右葉,NBNC-PLC傾向于肝左葉,其余部位兩者發生的概率都很小。既往很少關于PLC病因與病灶位置關系的報道,但段文斌等[17]發現CC、HCC分別好發于肝左葉和肝右葉。恰巧本研究中(表1)HBV-PLC、NBNC-PLC患者分別主要為HCC和CC,所以可能是不同病因導致了PLC不同的病理類型,從而在病灶位置也產生了差異,但具體機制尚不清楚。對HBV-PLC傾向于HCC型,NBNC-PLC比較傾向于CC型而言,可能是為HBV宿主范圍狹窄,傾向于感染肝細胞,很少侵襲膽管細胞,導致了HBV-PLC多為HCC,而CC與糖尿病等非病毒感染的代謝性疾病相關,故NBNC-PLC比較傾向于CC型[18-19]。
既往研究表明,血生化指標越差PLC預后越不好[20]。本研究發現HBV-PLC中AST、ALT、TBil、DBil、IBil、TBA、γ-GT以及Child-Pugh分級都高于NBNC-PLC,表明其肝功能更差。轉氨酶是肝細胞損傷的重要標志物,而HBV的感染會引起肝細胞損傷、死亡這就導致HBV-PLC患者轉氨酶更高。與本研究相似,既往發現HBV感染PLC患者膽紅素更高[21]。這是因為IBil首先要在肝細胞內與葡糖醛酸結合, 才能形成DBil,最終分泌入膽汁排泄[22],而當肝細胞感染HBV被破壞之后,處理IBil能力減弱,且肝細胞損傷后肝細胞腫脹會壓迫小膽管,造成DBil排泄障礙,最終導致HBV-PLC患者膽紅素更高。同樣作為膽固醇在肝臟代謝的最終產物膽汁酸,也會因此造成代謝障礙,使血清TBA升高。然而對HBV-PLC中GGT更高的原因尚不明確,不過最近研究發現γ-GT對HBV-HCC有一定診斷價值,證明HBV與PLC中血清γ-GT有一定的聯系[23]。以上各種血生化指標表明HBV-PLC肝功能更差,這也導致了HBV-PLC患者Child-Pugh級別更高。
AFP主要由胎兒肝細胞及卵黃囊合成,在成人血清中含量極低[24]。臨床上AFP主要用于PLC的診斷及療效監測。不過近些年發現它還能調控PTEN、caspase-3等促進腫瘤的發生發展[25-26]。本研究中HBV-PLC患者的血清AFP遠高于NBNC-PLC。也許是因為p53基因能通過調控序列特異性DNA結合蛋白抑制AFP表達,而HBx能與DNA結合降低p53對AFP表達的抑制[27-28]。
肝臟是多種凝血因子的合成場所,當肝臟病變時凝血功能一般會發生異常。本研究中HBV-PLC患者PT、INR、TT要更長,而PTA、FIB則相對較低,而兩組APTT無統計學差異。這反映HBV-PLC患者凝血功能更差,特別是外源性凝血途徑上。既往相關研究也發現HBV-PLC患者FIB含量降低,PT、TT等不同程度的延長[29-30]。首先HBV感染損傷肝細胞會影響凝血因子合成,這是主要原因,其次可能HBx也會干擾凝血因子合成。
綜上所述,HBV-PLC多為HCC,有發病較年輕、病灶好發于肝右葉、易發生遠處轉移、血清AFP高,且肝功能、凝血功能差的特點;而NBNC-PLC多為CC,發病年紀更大、病灶好發于肝左葉,不易發生遠處轉移、血清AFP低,肝功能及凝血較好。提示對于60歲左右(甚至更年輕)的HBV感染患者,應盡早予抗HBV治療,能有效預防PLC,且當肝右葉以及肝功能、凝血功能異常時,更要及時篩查警惕HCC發生。同時HBV-PLC患者也應積極抗HBV,這或許能減少遠處轉移以及改善患者凝血和肝功能,且既往研究[31]表明還能改善其預后,即使是HBV-DNA以及轉氨酶正常者。此外,臨床上對HBV-PLC患者應注重保護肝功能,以及預防出血。而70歲左右伴有糖尿病等代謝性疾病的人群,要警惕CC的發生,特別當影像學發現肝左葉有異常時。由于肝左葉PLC患者術后復發風險更高,故左肝術后的PLC患者要積極監測預防復發[32]。
本研究納入樣本較少,且來自單個研究中心,部分病例缺乏影像學及病理學等臨床資料,如有條件應進一步進行更高質量的多中心、大樣本研究予以驗證。

