骨形態發生蛋白-7的過表達載體對骨髓間充質干細胞成骨分化的影響
黃生祥,梅海波,赫榮國,劉 昆,唐 進,伍海燕
兒童慢性骨髓炎是兒童骨科領域的常見病和多發病[1-2],其導致的骨缺損發生率較高,如未能予以有效治療將造成骨骼畸形,對患兒的生長和生活將造成不可挽回的損失與傷害[3-4]。目前,對于兒童骨髓炎導致的骨缺損缺少有效的治療方案,大多依靠患兒自身的愈合能力和藥物,但療效不佳[5-6]。骨髓間充質干細胞(BMSCs)具有多向分化潛能,可以分化成骨細胞、軟骨細胞等人體細胞,而且BMSCs來源于患者自體,移植后可避免機體的排斥反應。但是干細胞具有易老化、分化方向不定和傳代少的缺點[7-8]。本研究利用基因編輯技術構建骨形態發生蛋白-7(BMP-7)的過表達載體,通過慢病毒轉染BMSCs,探討其促成骨分化的作用,旨在為兒童骨髓炎骨缺損的治療提供新的思路和方法。
1 材料與方法
1.1 實驗材料胎牛血清購自BI公司;DMEM培養基購自Invitrogen公司;2.5 g/L胰蛋白酶、茜素紅染液、堿性磷酸酶(ALP)染液等均購自北京碧云天生物有限公司。
1.2 BMSCs的獲取和培養利用無菌骨穿針從10例健康志愿者的髂骨中取新鮮骨髓組織,用磷酸緩沖鹽溶液(PBS)進行稀釋,然后加入0.01 mol/L的胎牛血清,置于37 ℃、5% CO2的細胞培養箱中,采用差速培養法進行BMSCs的培養。本研究已獲得我院倫理委員會批準。
1.3 BMSCs的鑒定采用流式細胞儀檢測BMSCs中CD33、CD45、CD90、CD106等表面蛋白的表達,并檢測其表達含量。
1.4 BMP-7過表達載體的構建利用PubMed數據庫中GENE Bank查詢BMP-7的編碼基因內含子序列,以XhoI/BamHI為切入點設計單鏈mRNA序列,構建BMP-7的過表達載體。慢病毒的包被需要利用表達載體和包裝質粒同時共轉染細胞,在細胞中進行病毒的包裝,包裝好的假病毒顆粒分泌到細胞外的培養基中,離心取得上清液后,獲得高滴度慢病毒。將P2代BMSCs同質化處理后,根據感染復數(MOI)值轉染慢病毒,然后利用倒置熒光顯微鏡觀察轉染結果。
1.5 BMSCs的分組根據BMSCs是否轉染BMP-7過表達載體分為轉染組和未轉染組(作為對照)。
1.6 反轉錄聚合酶鏈反應(RT-PCR)檢測慢病毒轉染14 d后收集細胞,加入1 ml的Trizol試劑,提取總RNA,按照反轉錄試劑盒說明書將單鏈RNA反轉錄為cDNA,4 ℃保存,RT-PCR檢測試劑盒檢測RNA水平。引物序列如下:BMP-7:正義鏈5′-AGATTCTAAAGGTGCGTTGCTGCC-3′,反義鏈5′-TCTATTAACTGTAATCCTCCTCTGG-3′;ALP:正義鏈5′-TTATGCGTAAGTT CCGGTAATGCCC-3′,反義鏈 5′-AATTCCGTGTGTACGTGCTGCTGAC-3′;Runt相關轉錄因子2(Runx2):正義鏈5′-TTAAGTGCTCTCG-ACGTCGCACTGCT-3′,反義鏈5′-AATTGCTGCTAG-CTGACGTACGTACG-3′;骨鈣素(OCN):正義鏈5′-TTCGTGTGTGTGCACACATGACACAA-3′,反義鏈5′-TTGTGTGTGCACACAGTGTAAATGTCA-3′;3-磷酸甘油醛脫氫酶(GAPDH):正義鏈5′-GCGTGTACCGTCAAGGCTGAGAAC-3′,反義鏈5′-TGGTTTGCCTAAGACGCCAGTGGA-3′。
1.7 茜素紅染色慢病毒轉染14 d后收集細胞,接種于6孔板中進行培養,4%多聚甲醛固定后按照茜素紅染色試劑盒說明書要求,將茜素紅染液加入6孔板中進行孵育,倒置光學顯微鏡下觀察。
1.8 ALP染色慢病毒轉染14 d后收集細胞,接種于6孔板中進行培養,4%多聚甲醛固定后按照ALP染色試劑盒說明書要求,將ALP染液加入6孔板中進行孵育,倒置光學顯微鏡下觀察。
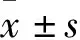
2 結果
2.1 BMSCs的培養結果和表達含量見圖1。CD90和CD106的表達為60.2%和58.3%;CD33和CD45的表達為3.4%和2.6%。
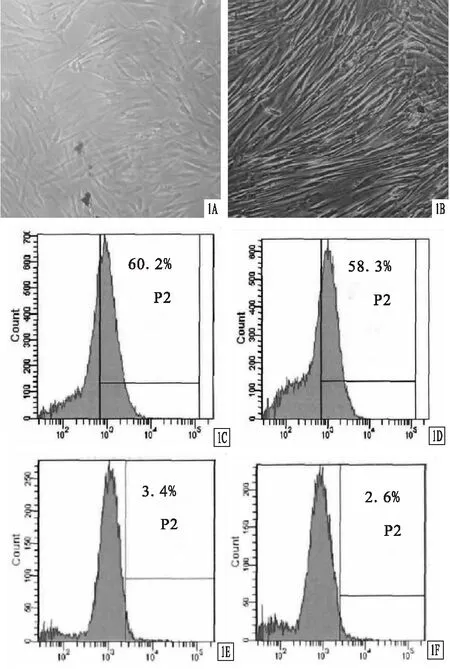
圖1 BMSCs的培養和表達(×200) A.原代BMSCs;B.第2代BMSCs;C.第2代BMSCs表面蛋白CD90的表達為60.2%;D.第2代BMSCs表面蛋白CD106的表達為58.3%;E.第2代BMSCs表面蛋白CD33的表達為3.4%;F.第2代BMSCs表面蛋白CD45的表達為2.6%
2.2 慢病毒轉染BMSCs的轉染結果見圖2。慢病毒轉染BMSCs的轉染滴度為3×108TU/ml。
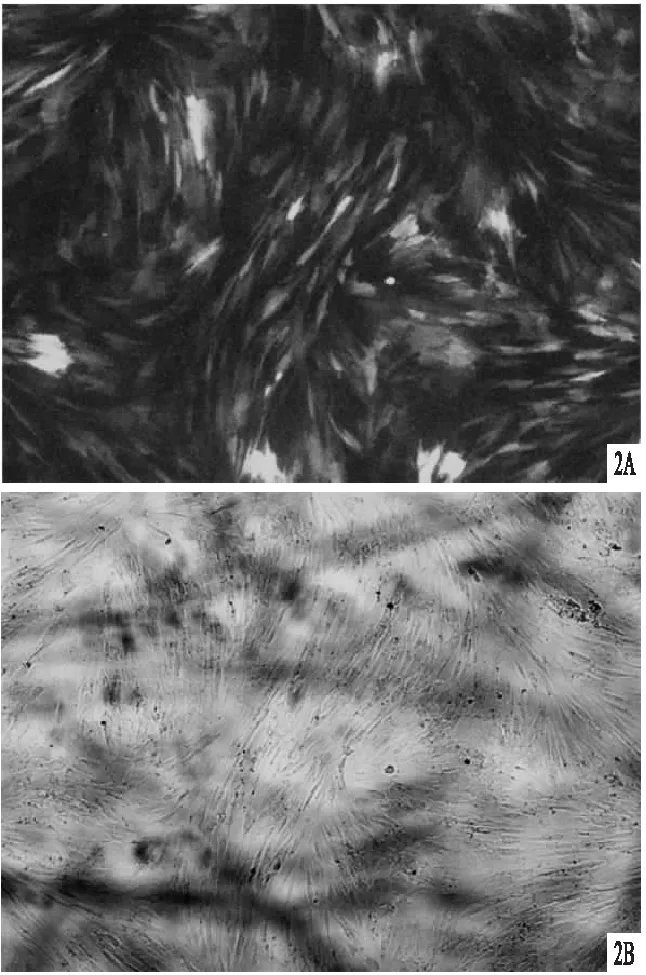
圖2 慢病毒轉染BMSCs的轉染結果(×200) A.熒光下視野;B.白光下視野
2.3 BMP-7以及成骨分化標志物ALP、Runx2和OCN的mRNA的相對表達量見圖3。BMP-7以及成骨分化標志物ALP、Runx2和OCN的mRNA的相對表達量轉染組均明顯高于未轉染組(P<0.05)。

圖3 BMP-7以及成骨分化標志物ALP、Runx2和OCN的mRNA的相對表達量 與未轉染組比較:*P<0.05
2.4 茜素紅染色結果見圖4。轉染組肉眼可見明顯的紅色染色區域,鏡下可見大量鈣結節點。

圖4 茜素紅染色 A.未轉染組肉眼視野;B.未轉染組鏡下視野(×200);C.轉染組肉眼視野;D.轉染組鏡下視野(×200) 圖5 ALP染色 A.未轉染組肉眼視野;B.未轉染組鏡下視野(×200);C.轉染組肉眼視野;D.轉染組鏡下視野(×200)
2.5 ALP染色結果見圖5。轉染組肉眼可見紫色染色區域,鏡下可見ALP染色呈強陽性。
3 討論
兒童骨髓炎導致的骨缺損在臨床上較常見,骨髓炎所致骨壞死、骨溶解、骨吸收以及局部的清創手術均可造成脛骨不連接,合并大段骨缺損和肢體短縮畸形,其臨床治療具有難度大。既往研究[9]表明,BMSCs復合異種骨基質明膠可以有效修復大鼠橈骨缺損,在組織支架的誘導作用下可以促進BMSCs向骨細胞轉化,進而修復骨缺損。但是,這種方法需要符合特定條件的組織工程支架,也就是需要特殊的“土壤”,BMSCs這個“種子”才能更好的在其內生長并且分化。另外,臨床應用的安全性有待調查[10]。研究[11]發現,利用慢病毒構建基因載體轉染BMSCs后,不影響BMSCs表型,說明利用基因工程原理構建基因過表達的BMSCs也是提高“種子”有效分化的一種手段。本研究基于此理論構建BMP-7過表達質粒慢病毒載體的BMSCs,制作新型“基因種子”,為骨缺損的研究做準備。
近年來,干細胞的應用受到明顯限制,主要存在以下幾個問題[12]:① 干細胞易老化,存活代數較少;② 分化程度低,且分化方向不定,無法達到預想結果。后基因組時代的標志是利用siRNA或者snRNA基因沉默或者過表達,從而增強或者沉默目的基因的功能。本研究的特色就是應用基因修飾的分子原理構建BMP-7的過表達載體,體外培養BMSCs,慢病毒轉染BMSCs,探究BMP-7的過表達載體對干細胞的促成骨分化作用,以期為臨床上兒童骨髓炎導致的骨缺損的治療提供思路與方法。
BMP-7是骨形態發生蛋白家族中的一員[13-14]。有研究[15]利用重組骨形態發生BMP-7用于脊柱融合,可見BMP-7具有一定的安全性。既往研究[16]顯示,采用ALP作為前骨細胞的分子標志物在前骨細胞向成熟骨細胞的分化中起到重要作用。另外,Runx2也是一種成骨分化的分子標志物[17],可以與順式轉錄作用原件結合,從而促進骨橋蛋白、骨涎蛋白的合成,進而促進骨細胞分化。本研究以ALP、Runx2、OCN作為成骨分化的標志物,利用RT-PCR進行定量檢測,結果表明慢病毒轉染BMP-7過表達載體后,ALP、Runx2、OCN的表達量明顯升高。ALP染色結果:轉染組肉眼可見紫色染色區域,鏡下可見ALP染色呈強陽性;茜素紅染色結果:轉染組肉眼可見明顯紅色區域染色,鏡下可見大量鈣結節點。
綜上所述,慢病毒轉染BMP-7可以促進BMSCs成骨分化。本研究的不足:① 轉染方法的選擇問題。因為慢病毒載體是一種滅活的人類免疫缺陷病毒,雖然轉染率較高,但安全性仍有待進一步改進。② 僅證明了BMP-7轉染后可以促進BMSCs成骨分化,但具體機制需要進一步研究。
- 臨床骨科雜志的其它文章
- 小議股骨頸骨折分型
- 后路全髖置換術后髖關節保護體位影響脫位率嗎?一項7項研究6 900例薈萃分析/CROMPTON J,OSAGIE-CLOUARD L,PATEL A//Acta Orthop,2020,91(6):687-692.
- 50歲以上膝關節晚期骨性關節炎患者全膝關節置換術比截骨術的臨床效果更好,失敗率更低/MIGLIORINI F,DRIESSEN A,OLIVA F,et al//J Orthop Surg Res,2020,15(1):545.
- 全膝關節置換術后關節鏡治療:不是良好的治療措施/LOVRO L R,KANG H P,BOLIA I K,et al//J Arthroplasty,2020,35(12):3575-3580.
- 在健康狀況最好的患者中,雙側同時行全膝關節置換術可能仍然不安全/WARREN J A,SIDDIQI A,KREBS V E,et al//J Bone Joint Surg Am,2021,103(4):303-311.
- 空心釘聯合克氏針鋼絲治療肱骨小頭伴滑車骨折

