肌紅蛋白血紅素輔基氧化修飾對肌球蛋白功能特性及凝膠特性的影響
朱宏星,高田毅,黃 楊,王 鑫,葛慶豐,王道營,*,孫 沖,*
(1.江蘇省農業科學院農產品加工研究所,江蘇 南京 210014;2.揚州大學食品科學與工程學院,江蘇 揚州 225127)
保水性是評價肉品品質的重要指標之一。肌球蛋白為鹽溶性蛋白,是肌肉中重要的蛋白成分也是形成凝膠的主要成分,對肉品的保水性起決定性作用[1]。肌球蛋白的分子形態為一個桿狀尾部和兩個球狀頭部,為不對稱結構,形如“Y”狀,尾部主要由α-螺旋構成。在凝膠形成過程中肌球蛋白會發生變性,結構展開,蛋白聚合交聯形成有序的凝膠網絡結構。但是,凝膠形成過程極易受蛋白結構變化影響,因此肌球蛋白結構狀態與凝膠的保水性密切相關[2]。近年來研究發現蛋白氧化也與肉品保水性相關[3]:適度氧化有利于蛋白凝膠形成穩定的三維凝膠網絡,改善凝膠的功能特性,從而改善肉品質地,提高肉品保水性;蛋白的過度氧化則會形成不利的凝膠結構,降低肉品的品質。
肌紅蛋白(myoglobin,Mb)是肉品的主要呈色物質,由血紅素輔基和珠蛋白組成。血紅素輔基與珠蛋白之間具有較強的親合力,能夠穩定Mb結構[4]。在肉品儲藏與加工過程中,pH值、溫度、內源酶等因素的變化都會對血紅素輔基與珠蛋白的結合力產生影響,從而造成Mb構象改變,血紅素輔基暴露甚至從Mb中脫落[5-9],脫落的血紅素輔基會對肉品品質造成影響。血紅素輔基是肉品中重要的促氧因子,能顯著促進氧化的發生[10]。目前,關于血紅素輔基功能特性的研究大都集中在血紅素輔基對脂質的氧化作用,關于血紅素輔基促脂質氧化的具體機理,通過如下過程發生:一方面,亞鐵血紅素自動氧化成高鐵血紅素,生成過氧羥自由基(HOO·)在其誘導脂質氧化過程中發揮重要作用[11-12];另一方面,血紅素輔基釋放后通過疏水作用力吸附在肌肉細胞的磷脂膜上,或者血紅素輔基環上帶正電荷的丙酸酯能通過靜電作用吸附在帶負電的磷脂頭部從而參與氧化反應[13]。前期研究發現血紅素輔基處理可以使肌球蛋白氧化,蛋白羰基含量上升,巰基交聯形成二硫鍵,導致肌球蛋白結構發生改變[14]。目前針對血紅素輔基對蛋白氧化的影響,進而與肉品品質關聯性的研究尚未有深入報道。因此本實驗探究血紅素輔基氧化處理導致肌球蛋白結構的改變對肌球蛋白凝膠特性及保水性的影響,旨在為控制肉品氧化、改善肉品保水性提供一定的參考依據。
1 材料與方法
1.1 材料與試劑
三黃雞購自江蘇立華牧業股份公司;將雞暗處靜置過夜后殺雞快速取出胸肉(胸大肌)用于提取肌球蛋白。
血紅素輔基 美國Sigma公司;十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、尿素、β-巰基乙醇(均為分析純) 國藥集團化學試劑有限公司。
1.2 儀器與設備
FE20/FG2 pH計、AL電子天平 瑞士梅特勒-托利多集團;T-25型數顯勻漿機 德國IKA公司;多功能酶標儀 美國BioTek儀器有限公司;Mini-PROTEAN Tetra Cell垂直電泳系統 美國Bio-Rad公司;JS-680C全自動凝膠成像分析儀 上海培清科技有限公司;UniCenMR臺式冷凍離心機 德國Herolab公司;SCIENTZ-IID超聲波細胞破碎儀 寧波新芝生物科技股份有限公司;NICOMP Z3000納米粒度電位儀美國PSS公司;MCR302旋轉流變儀 奧地利Anton Paar公司;TMS-TOUCH物性測定儀 美國FTC公司;MesoMR23-060H-1低場核磁共振成像與分析系統 蘇州紐邁分析儀器股份有限公司。
1.3 方法
1.3.1 肌球蛋白的提取
參考Hayakawa等[15]的方法并略作改動。將新鮮雞胸肉置于冰浴中快速降溫,剔除筋膜和脂肪,切碎后與提取液A(0.5 mol/L KCl、0.1 mol/L KH2PO4、50 mmol/L K2HPO4、5 mmol/L EDTA-2Na、4 mmol/L焦磷酸鈉,pH 6.5)以1∶3(g/mL)混合,5 000hg冰浴條件下勻漿5 s。將勻漿液在冰浴條件下進行超聲處理,超聲功率200 W,工作時間1 s,間隔時間3 s,超聲時長10 min。將超聲后并已攪拌20 min的勻漿液離心(4 ℃、5 000hg、10 min),用三層紗布過濾得上清液。用10 倍體積的預冷超純水對濾液進行稀釋,4 ℃條件下混勻靜置4 h后去除上清液得沉降物。將沉降物離心(4 ℃、8 000hg、10 min)得沉淀,沉淀與提取液B(0.3 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.0)以1∶3(g/mL)混勻20 min,再離心(4 ℃、10 000hg、20 min)得上清液。上清液加10 倍體積的預冷超純水混勻,4 ℃靜置過夜后離心(4 ℃、8 000hg、10 min)除上清液,收集沉淀,即為粗肌球蛋白。粗肌球蛋白與透析液(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)以1∶3(g/mL)溶解并于透析袋(mw=10 kDa)中透析16 h,得到的溶液10 000hg離心20 min,上清液即為肌球蛋白溶液。用雙縮脲法測定肌球蛋白的蛋白濃度。
提取的肌球蛋白的純度通過SDS-聚丙烯酰胺凝膠電泳(SDS-polyacrylamide gel electrophoresis,SDSPAGE)系統測定。
1.3.2 血紅素輔基的配制
準確稱取血紅素輔基粉末0.163 g,用30 mmol/L NaOH溶液配制成濃度為10 mmol/L儲備液,避光保存[16]。用磷酸鹽緩沖液(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)將儲備液稀釋成濃度為0.4、1.0、1.5、3.0 mmol/L的血紅素輔基溶液,4 ℃避光保存備用。
1.3.3 血紅素輔基介導肌球蛋白氧化體系的構建
向肌球蛋白沉淀中等體積混合血紅素輔基溶液(濃度分別為0、0.4、1.0、1.5、3.0 mmol/L),4 ℃避光條件下孵育16 h,將氧化后的肌球蛋白混合液用20 mmol/L的磷酸鹽緩沖液(20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)進行稀釋,4 ℃、10 000hg離心20 min得到不同氧化程度的肌球蛋白沉淀[17]。實驗所需肌球蛋白濃度通過磷酸鹽緩沖液(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)調整。
1.3.4 血紅素輔基氧化修飾肌球蛋白凝膠的制備
調整不同氧化程度的肌球蛋白樣品質量濃度為35 mg/mL,稱取相同體積蛋白樣品置于小燒杯中,用聚乙烯(polyethylene,PE)保鮮膜封口。將裝有蛋白樣品的燒杯置于水浴鍋內,20 ℃恒溫20 min后,勻速升溫至85 ℃(升溫速率1.5 ℃/min),保溫20 min。加熱完成后,取出樣品在室溫條件下放置至常溫,然后于4 ℃貯存過夜備用。每個處理組平行3次。
1.3.5 肌球蛋白溶解度及粒徑的測定
根據Liu Ru等[18]的方法略作修改,確定肌球蛋白的溶解度。將5 mg/mL氧化肌球蛋白溶液在4 ℃、離心10 min,采用考馬斯亮藍法測定離心前后肌球蛋白的質量濃度,溶解度按下式計算:

使用納米激光粒度分析儀測定肌球蛋白的粒徑。調整肌球蛋白溶液質量濃度為0.5 mg/mL,檢測3次后進行信息采集,每個樣品平行采集3次,取平均圖譜。
1.3.6 肌球蛋白乳化活性及乳化穩定性的測定
采用濁度法測定肌球蛋白的乳化性質[19]。調整肌球蛋白質量濃度為0.2 mg/mL,取4 mL置于離心管中,并加入1 mL大豆油,10 000hg均質1 min,立即從距離心管底5 mm處取勻漿液50 μL,加入到5 mL質量分數為0.1%的SDS溶液中,振蕩混勻后于500 nm處測定吸光度記為A0;靜置10 min后在相同的位置再次取勻漿液50 μL,加入到5 mL SDS溶液中,振蕩混勻后測定吸光度記為A10。以0.1% SDS溶液為空白對照,乳化活性和乳化穩定性計算公式如下:

式中:A0、A10為乳狀液在500 nm處第0、10分鐘的吸光度;φ為乳化液的油體積分數(φ=0.2);C為乳化前的蛋白質量濃度/(g/mL)。
1.3.7 肌球蛋白流變特性
參考Diedericks等[20]的方法略作修改。取一定量的肌球蛋白溶液置于動態流變儀的載物臺上,設置圓形平板與載物臺間距為1 000 μm,并用液體石蠟封住樣品。實驗參數設置如下:振動頻率0.1 Hz,應變力為2%,以2 ℃/min的升溫速率從20 ℃加熱到80 ℃。
1.3.8 肌球蛋白凝膠強度
取肌球蛋白凝膠樣品置于質構儀載物臺上,設置參數:應變力0.1 N,測試速率30 mm/min,形變量50%,穿刺距離10 mm,室溫條件下測定[2]。
1.3.9 凝膠持水力(water-holding capacity,WHC)
采用離心法測定凝膠WHC[21]。將制備好的蛋白凝膠置于離心管后,4 ℃、10 000hg離心15 min,記錄離心前后離心管的質量以及空離心管質量。計算公式如下:
總而言之,GPS系統具有數據測量的高效性、準確性和科學性,減少了工作流程中浪費的大量人力、財力、物力。現代科學技術的發展推動了GPS技術和地理信息系統的結合,二者的應用也為人們的工作和生活帶來了極大的便利。在未來的日子里,研究人員還要不斷完善GPS技術,為各行業提供準確有效的數據支持。
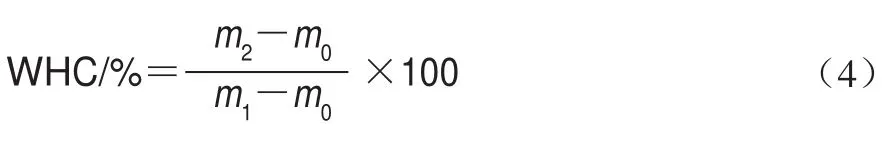
式中:m0為離心管的質量/g;m1為離心前離心管與凝膠的總質量/g;m2為離心后離心管與凝膠的總質量/g。
1.3.10 肌球蛋白凝膠低場核磁共振測定
采用低場核磁共振成像與分析系統對肌球蛋白凝膠進行測定以確定凝膠樣品的橫向弛豫時間(T2)[22]。將2 g樣品放入圓柱形玻璃管(直徑15 mm)中。參數設置如下:測量溫度32 ℃,質子共振頻率22.6 MHz,使用25 mm線圈,r值為200 μs,等待時間為4 000 ms,脈沖個數為15 000,兩個峰值間隔為0.25 ms,掃描次數為16,反演迭代次數為100 000,采用CPMG序列進行測量,每組3次平行。
1.3.11 肌球蛋白凝膠分子間作用力的測定
根據Yang Xiaoyu等[23]的方法并作修改,通過不同溶劑破壞肌球蛋白凝膠形成過程中的分子作用力。NaCl溶液(0.6 mol/L)破壞離子鍵,低濃度尿素(1.5 mol/L)可破壞氫鍵,高濃度尿素(8 mol/L)可同時破壞氫鍵和疏水相互作用,而β-巰基乙醇(0.5 mol/L)會破壞二硫鍵。將樣品分別溶解在以下溶劑中,以分析血紅素輔基誘導的肌球蛋白凝膠形成過程中不同分子作用的貢獻。選擇的4種溶劑為S1:0.6 mol/L NaCl;S2:0.6 mol/L NaCl+1.5 mol/L尿素;S3:0.6 mol/L NaCl+8 mol/L尿素;S4:0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/Lβ-巰基乙醇。將樣品(0.5 g)溶解在5 mL的不同溶劑中,勻漿后離心(8 000hg、4 ℃、15 min)。采用考馬斯亮藍法測定上清液中的蛋白質量濃度。離子鍵、氫鍵、疏水作用和二硫鍵的貢獻分別以S1、S2-S1、S3-S2、S4-S3的溶解度表示。
1.3.12 肌球蛋白凝膠微觀結構的觀察
參考Zheng Jiabao等[24]的方法用掃描電子顯微鏡在10 kV的掃描電壓下觀察肌球蛋白凝膠的微觀結構。將同樣大小的凝膠在液氮中快速冷凍,冷凍后的樣品通過真空冷凍干燥機干燥,將樣品截面朝上逐個粘貼在掃描電鏡樣品臺上,表面噴金鍍膜后于放大500 倍條件下觀察肌球蛋白凝膠的微觀結構。
1.4 數據統計分析
所得數據均為3次重復的平均值,結果表示為 fs。數據分析采用軟件IBM SPSS Statistics 25.0,運用單因素(方差分析法)ANOVA-Tukey對數據進行單因素檢驗分析,P<0.05,差異顯著,采用Origin 8.5軟件作圖。
2 結果與分析
2.1 血紅素輔基對肌球蛋白溶解度及粒徑的影響
在肉品加工中處于高度溶解狀態的蛋白能表現出良好的保水性[25]。由圖1A可知,0.2~0.5 mmol/L血紅素輔基處理下,肌球蛋白溶解度基本無變化;血紅素輔基濃度繼續升高,肌球蛋白溶解度呈現下降趨勢,當濃度提高至1.5 mmol/L,溶解度降低了28.13%。粒徑大小可用來表明肌球蛋白的聚集程度。由圖1B可知,肌球蛋白在添加血紅素輔基后,肌球蛋白的粒徑增大,血紅素濃度增加至1.0~1.5 mmol/L后,肌球蛋白的粒徑顯著增大(P<0.05)。肌球蛋白溶解度與粒徑結果表明適度的氧化導致肌球蛋白交聯聚集,形成可溶性聚集體,肌球蛋白仍表現出良好的溶解狀態,但其平均粒徑有所增大。在高濃度氧化攻擊下,蛋白發生過度氧化,蛋白分子交聯聚集,大量不溶性的聚集體的形成降低了蛋白的溶解性并且導致了肌球蛋白平均粒徑顯著增大(P<0.05)[26]。
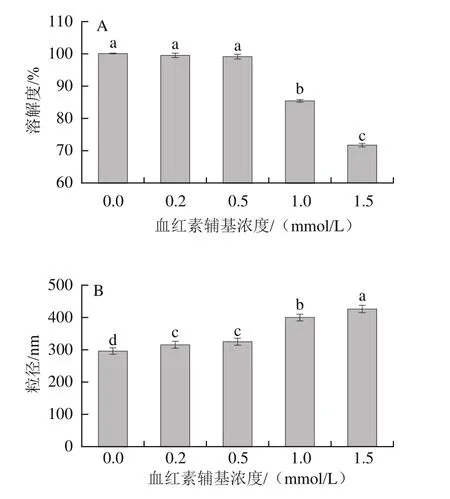
圖1 血紅素輔基濃度對肌球蛋白溶解度(A)和粒徑(B)的影響Fig.1 Effect of hemin prosthetic group concentration on solubility (A) and particle size (B) of myosin
2.2 血紅素輔基對肌球蛋白乳化活性及乳化穩定性的影響
乳化性可以通過乳化活性和乳化穩定性表達,乳化活性反映了蛋白在水油界面的吸附能力,乳化穩定性反映蛋白保持乳化體系中水油界面穩定狀況的重要指標[27]。如圖2所示,0.2~1.0 mmol/L血紅素輔基處理的肌球蛋白溶液乳化活性差異不顯著(P>0.05);當血紅素輔基濃度在0.2~0.5 mmol/L之間時,肌球蛋白乳化穩定性有所提高;當血紅素輔基濃度達1.5 mmol/L時,乳化活性與乳化穩定性顯著降低(P<0.05)。肌球蛋白乳化特性結果表明低濃度血紅素輔基對肌球蛋白氧化程度不高,肌球蛋白部分解折疊,疏水基團暴露有利于其在油滴表面形成穩定的蛋白膜[28],同時疏水氨基酸與親水、親油氨基酸暴露并相互影響,導致肌球蛋白乳化活性變化不顯著(P>0.05)[29];高濃度血紅素輔基處理下肌球蛋白過度氧化,變性程度加劇,分子交聯形成大量不溶性的蛋白聚集體,蛋白分子穩定性降低,難以形成穩定的界膜,同時蛋白與脂肪間的交聯能力降低,乳狀液分層加快,表現出乳化活性和乳化穩定性的降低[30]。
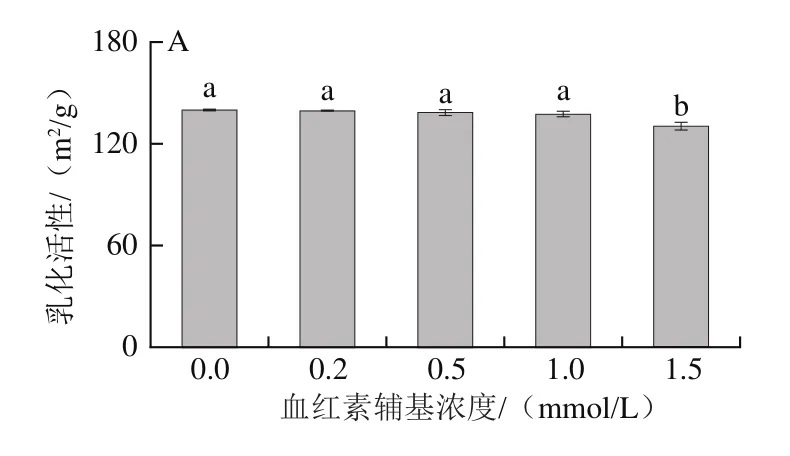

圖2 血紅素輔基濃度對肌球蛋白乳化活性(A)和乳化穩定性(B)的影響Fig.2 Effect of hemin prosthetic group concentration on emulsifying activity (A) and emulsion stability of myosin (B)
2.3 血紅素輔基對肌球蛋白凝膠流變學特性的影響
儲能模量(G’)又稱彈性模量,用來反映凝膠過程中的彈性部分,可以反映凝膠的質構及微觀結構等性質。損耗模量(G’’)代表凝膠的黏度,一般與G’的變化趨勢一致[31]。如圖3所示,不同濃度血紅素輔基處理后肌球蛋白G’和G’’的變化趨勢相似,且G’值始終高于G’’值,表明肌球蛋白的彈性及凝膠狀特性在黏彈性中占主導地位。未添加血紅素輔基的肌球蛋白,其G’值在53 ℃和60 ℃有2個轉變峰:53 ℃為肌球蛋白凝膠的形成期,此階段主要是肌球蛋白分子頭部的變性與聚合,隨后蛋白尾部解折疊,溫度升高使得低溫凝膠網絡被破壞,流動性增強,G’值降低,隨著溫度繼續升高,肌球蛋白最終形成不可逆的凝膠網絡結構[16]。添加適量的血紅素輔基后(0.2~0.5 mmol/L),肌球蛋白第1個轉變峰不明顯,這可能是因為血紅素輔基氧化導致肌球蛋白結構部分展開,從而削弱了肌球蛋白的頭部聚集,使得肌球蛋白在加熱初期的聚集模式由頭部聚集為主轉變為以尾部交聯為主[32]。隨后肌球蛋白G’值逐漸增大,原因主要是血紅素輔基氧化進一步促進了肌球蛋白分子解折疊,巰基氧化形成二硫鍵,蛋白分子發生交聯,最終形成了良好的網絡凝膠結構;當血紅素輔基濃度增加至1.5 mmol/L時,60 ℃峰幾乎消失,曲線變得平緩,這主要是由于高添加量的血紅素輔基造成肌球蛋白過度氧化變性,蛋白過度解折疊,疏水基團嚴重暴露,同時蛋白大量聚集,蛋白穩定性降低,不利于肌球蛋白加熱后進一步交聯形成有序的三維網狀凝膠結構。
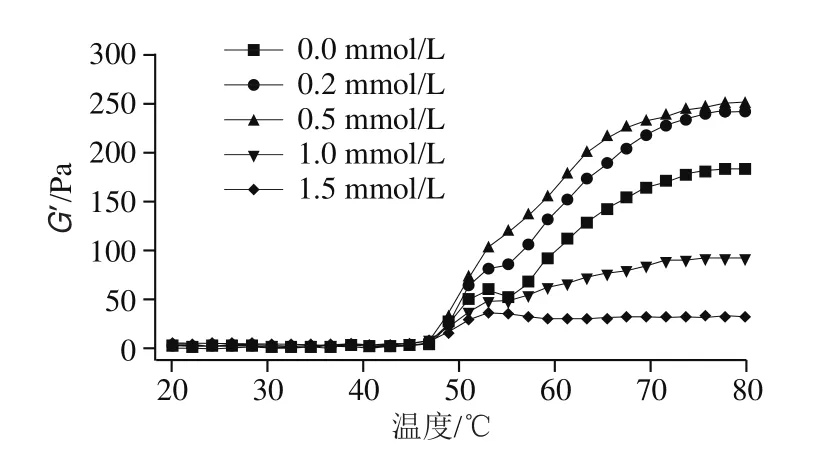
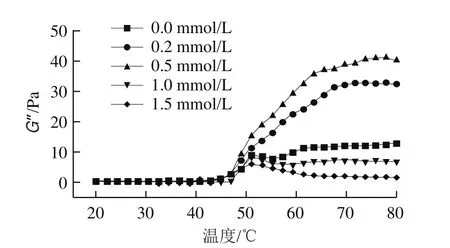
圖3 血紅素輔基濃度對肌球蛋白流變學特性的影響Fig.3 Effect of hemin prosthetic group concentration on rheological properties of myosin
2.4 血紅素輔基對肌球蛋白凝膠強度的影響
通過熱誘導作用形成肌球蛋白凝膠,其蛋白的凝膠特性與保水性有關[33]。由圖4可知,隨著氧化程度加深,肌球蛋白凝膠強度發生顯著改變。低濃度血紅素輔基(0.2~0.5 mmol/L)處理的蛋白凝膠,其凝膠強度較未處理組顯著提高(P<0.05);而高濃度血紅素輔基(1.5 mmol/L)氧化處理后,其凝膠強度顯著下降(P<0.05)。肌球蛋白凝膠強度結果表明:低濃度血紅素輔基對肌球蛋白凝膠的形成更為有利,這主要是由于適度氧化可以提高蛋白的溶解性,使蛋白結構伸展,分子交聯形成可溶性聚合物,蛋白的凝膠特性得到改善,蛋白的凝膠網絡結構強度得到提高。但過度氧化會使蛋白溶解度大大降低,由于蛋白的過度解旋,導致疏水基團的大量暴露,分子聚集形成不溶性聚合物,溶脹不充分,不利于凝膠體系的形成[33],這也與肌球蛋白流變學結果相符合。
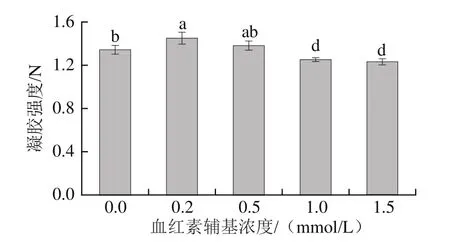
圖4 血紅素輔基濃度對肌球蛋白凝膠強度的影響Fig.4 Effect of hemin prosthetic group concentration on gel strength of myosin gels
2.5 血紅素輔基對肌球蛋白凝膠持水性的影響
如圖5所示,添加0.2~0.5 mmol/L血紅素輔基后,肌球蛋白凝膠的持水性提高了14.42%;當血紅素添加量提高至1.0~1.5 mmol/L后,肌球蛋白凝膠WHC顯著降低(P<0.05)。持水性的結果表明適度氧化能夠增強肌球蛋白疏水相互作用,導致蛋白分子交聯聚集形成可溶性聚集體,這一變化有助于加熱過程中肌球蛋白尾部的有序聚集,形成規則的網絡結構,提高肌球蛋白凝膠束縛水分的能力[34];高濃度血紅素輔基的過度氧化則降低了肌球蛋白的溶解度,破壞了肌球蛋白的穩定結構,肌球蛋白發生變性并過度聚集形成大量不溶性的聚集體,不利于穩定的三維凝膠網絡的形成,對水分的截留能力弱,水分流失嚴重,保水能力差。
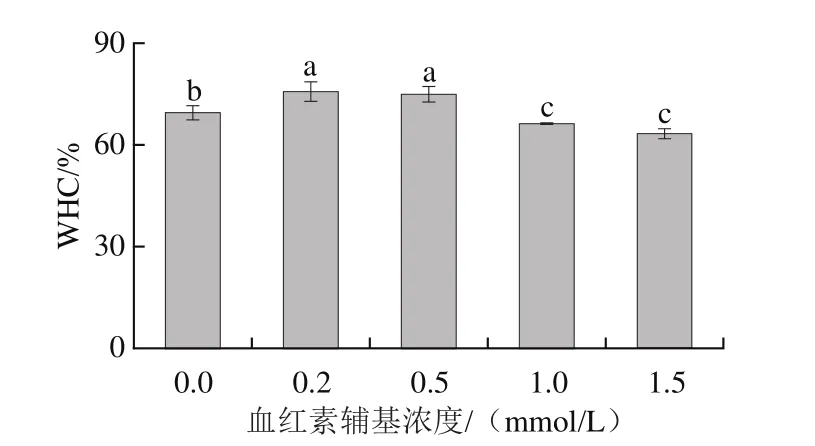
圖5 血紅素輔基濃度對肌球蛋白凝膠持水性的影響Fig.5 Effect of hemin prosthetic group concentration on water-holding capacity of myosin gels
2.6 血紅素輔基對肌球蛋白凝膠水分分布的影響
如圖6所示,肌球蛋白凝膠中4種狀態水分的橫向弛豫時間T2分別在0~5、8~30、147~534、1 417~3 765 ms之間,分別表示強結合水(T2b)、弱結合水(T21)、不易流動水(T22)和自由水(T23)[35]。其中T22信號最強,T23其次,表明肌球蛋白凝膠中的水分主要以不易流動水與自由水的形式存在。有關研究表明弛豫時間T2與凝膠中水分子的游離程度呈正相關,即弛豫時間越小,蛋白與水分子結合越緊密,水分自由度越低;反之弛豫時間越長,則水分與蛋白結合力越弱,水分越容易流失[36]。添加了血紅素輔基的肌球蛋白,其T2弛豫時間和峰比例均發生了明顯變化:0.2~0.5 mmol/L血紅素輔基處理肌球蛋白凝膠后,T22和T23減小,不易流動水峰面積比例P22顯著增高(P<0.05)、自由水峰面積比例P23顯著降低(P<0.05);1.0~1.5 mmol/L血紅素輔基處理后肌球蛋白凝膠T2提高,不易流動水峰面積比例P22顯著降低(P<0.05),自由水峰面積比例P23顯著增高(P<0.05)。這些結果說明了血紅素輔基適度氧化導致肌球蛋白更多極性基團的暴露,水的親和力增強,有助于肌球蛋白形成密集有序的三維凝膠網絡結構,鎖住更多的水分,降低凝膠中水分的流動性[37],血紅素輔基高度氧化導致肌球蛋白結構過度展開,大量的疏水基團暴露出來,蛋白分子發生聚集,同時高度氧化導致肌球蛋白發生變性,穩定性降低,不利于有序穩定的凝膠網絡結構的形成,自由水流動性增強,表現出凝膠持水率的降低。

圖6 不同濃度血紅素輔基對肌球蛋白凝膠水分分布的影響Fig.6 Effect of hemin prosthetic group concentration on moisture distribution of myosin gels
2.7 血紅素輔基對肌球蛋白凝膠分子間相互作用的影響
凝膠的三維網狀結構是蛋白與蛋白、蛋白與水分子之間二硫鍵、氫鍵和疏水相互作用達到平衡的結果[38]。凝膠中添加不同的變性劑,能夠破壞維持凝膠穩定的分子間作用力,提高蛋白的溶解度。在熱誘導肌球蛋白形成凝膠的過程中,熱可以破壞維持蛋白高級結構的作用力,蛋白在變性再聚集過程中又形成了新的分子間作用力穩定凝膠結構[39]。由圖7所示,維持肌球蛋白凝膠網絡結構的主要作用力為疏水相互作用和二硫鍵,添加了0.2 mmol/L血紅素輔基后,疏水相互作用和二硫鍵含量顯著增加(P<0.05),當血紅素輔基濃度提高至1.0 mmol/L后,蛋白凝膠中的疏水相互作用和二硫鍵含量開始降低。肌球蛋白凝膠分子間作用力的變化表明低濃度的血紅素輔基氧化導致蛋白疏水基團與巰基部分暴露,疏水相互作用增強,游離巰基結合形成二硫鍵,此時蛋白開始聚集,肌球蛋白結構在加熱前展開的程度更大,這有利于穩定的凝膠網絡的形成。而過度氧化使蛋白變性過度,結構大量展開,蛋白分子間發生過度交聯聚集,肌球蛋白在加熱前已變形成大量的聚集體,這不利于熱誘導過程中蛋白分子的交聯,因此形成粗糙、無序、不穩定的三維網絡結構。

圖7 血紅素輔基濃度對肌球蛋白凝膠化學作用力的影響Fig.7 Effect of hemin prosthetic group concentration on chemical forces of myosin gels
2.8 血紅素輔基對肌球蛋白凝膠微觀結構的影響
對肌球蛋白凝膠的三維網絡結構進行掃描電鏡研究有助于深入了解氧化對蛋白凝膠形成過程的影響[40]。肌球蛋白凝膠的狀態與蛋白持水性呈現相關性。未處理的肌球蛋白凝膠存在明顯的凝膠網絡結構(圖8A);當添加血紅素輔基濃度為0.2~0.5 mmol/L時(圖8B、C),肌球蛋白凝膠的三維網狀結構更為明顯,表面更平整,孔隙細膩且形狀規則均勻,結構致密,有較好的成膠能力。致密均勻的三維網絡結構有助于水分的截留,這與凝膠的保水性結果一致;當添加血紅素輔基濃度為1.0~1.5 mmol/L時(圖8D、E),蛋白凝膠的網絡結構逐漸不清晰,結構粗糙松散,孔隙變大,分布不均,肌球蛋白凝膠結構發生斷裂。這一結果表明高濃度的血紅素輔基使肌球蛋白過度氧化,導致蛋白變性,結構過度展開,蛋白分子間疏水性聚集導致蛋白過度交聯,阻礙了肌球蛋白熱誘導聚集交聯以及二硫鍵的形成,從而使蛋白膠束分布不均勻,不能形成良好的凝膠網絡結構,截留水分子的能力變弱,表現出保水性降低的現象。

圖8 血紅素輔基濃度對肌球蛋白凝膠微觀結構的影響Fig.8 Effect of hemin prosthetic group concentration on the microstructure of myosin gels
3 結 論
本實驗研究發現,隨著血紅素輔基濃度的增加,肌球蛋白溶解度呈現下降的趨勢,粒徑增加,這是由于血紅素輔基氧化肌球蛋白造成蛋白結構展開,蛋白分子發生聚集。低濃度血紅素輔基(0.2~0.5 mmol/L)處理后有助于提高肌球蛋白乳化穩定性,改善肌球蛋白凝膠強度,同時提高凝膠中不易流動水的比例,提升凝膠束縛水的能力;高濃度血紅素輔基(1.0~1.5 mmol/L)處理后,肌球蛋白結構大量展開并過度聚集,肌球蛋白變性加劇,降低了蛋白的乳化特性,因此肌球蛋白凝膠呈現粗糙的三維網狀結構,凝膠保水性下降,凝膠品質降低。在此基礎上,對血紅素輔基處理后肌球蛋白熱誘導凝膠形成過程中分子間作用力變化的研究表明,穩定肌球蛋白熱誘導凝膠的主要作用力為疏水相互作用和二硫鍵,適度氧化有利于肌球蛋白凝膠形成過程中疏水相互作用及二硫鍵的形成,凝膠網絡的穩定提高性;過度氧化的肌球蛋白在加熱前已大量聚集,不利于熱誘導過程中疏水相互作用以及二硫鍵的形成、分子的聚集以及穩定有序的凝膠三維網絡結構的形成。

