Cu3N自支撐電極制備及其電催化氮氣還原性能研究
何暉宇 ,王 晟 ,紀律律
(浙江理工大學 材料科學與工程學院,浙江 杭州 310018)
氨(NH3)是一種重要的化工原料,被廣泛應用于農業、醫藥、燃料等領域[1,2]。Haber-Bosch法是目前工業上合成NH3的主要方法,但該方法存在反應條件苛刻(高溫:400 ? 500 ℃;高壓:20.0 ? 35.0 MPa)、N2轉化率低(10% ? 15%)和大量CO2氣體排放(約占CO2年排放量的1.5%)等問題[3?5]。因此,開發高效率、低能耗、環境友好的新型合成NH3方法以替代傳統的Haber-Bosch法,對于可持續發展具有重要意義。利用可再生能源(如太陽能、風能、水能等)產生的電能,通過電催化N2還原(Nitrogen Reduction Reaction, NRR)合成NH3的方法為實現綠色發展提供了新思路。電催化NRR以N2和H2O為原料,可在常溫常壓下進行,整個過程可避免化石燃料的消耗和CO2氣體排放[6?8]。
然而,由于N2分子沒有偶極矩,極化率低,N≡N三鍵鍵能較高(941 kJ/mol),常溫常壓條件下活化N≡N三鍵較為困難,此外N2在水溶液中的溶解度較低(20 mg/L),傳質擴散速率較慢,導致整體催化電流密度較小[9]。同時,由于電催化NRR與電催化析氫反應(Hydrogen Evolution Reaction, HER)兩者之間的理論電位接近,而HER在大多數電極表面通常具有更快的反應動力學,因此,作為競爭反應嚴重抑制了NRR的法拉第效率[10]。為了提高NH3的產量和法拉第效率,需要設計開發高效率、高選擇性和高穩定性的NRR電催化劑[11]。
近年來,研究人員設計開發了各類NRR電催化劑,主要包括貴金屬(Ru、Rh、Ir等)基催化劑[12]、非貴金屬(Mo、V、W、Ti等)基催化劑[13?16]以及雜原子(N、B、P等)摻雜碳催化劑[17?19],取得了一系列有益的研究成果。其中,過渡金屬氮化物(TMNs)由于其良好的導電性、電化學穩定性和獨特的催化機制被認為是一類高效的NRR催化劑[20]。例如,Jin等[21]研究發現,W2N3表面豐富的N空位可抑制質子的競爭吸附,并有效降低電催化NRR的反應能壘,從而提高產NH3速率和選擇性。Ren等[22]將MoO2經過氮化后得到Mo2N,通過理論計算發現Mo2N具有比MoO2更低的電催化NRR的反應能壘。Yang等[14]制備了一種兼具高活性和高選擇性的VN納米顆粒,其產氨速率與FE均比貴金屬催化劑高約兩個數量級。
Cu是一種儲量豐富的廉價過渡金屬元素,Cu基材料曾被廣泛研究應用于多電子轉移的復雜電催化反應(如CO2還原、O2還原等),并表現出優異的電催化活性和選擇性[23,24]。目前,一些Cu基材料已初步應用于電催化NRR研究,包括了單原子Cu[25]、Cu基合金[26]、CuO[27]和Cu3P[28]等,然而關于氮化銅材料的電催化NRR研究報道極少。此外,已報道的Cu基催化劑均為粉末,需要使用黏連劑將催化劑負載在導電基底電極如碳紙或者玻碳電極表面,而黏連劑(如Nafion)的使用會覆蓋部分活性位點從而降低催化性能。
基于以上考慮,本研究利用簡單的一步氮化法,將泡沫銅(Copper Foam, CF)高溫氮化制備了三維自支撐型氮化銅催化電極(Cu3N/CF),系統研究了Cu3N/CF的電催化NRR性能,并揭示其電催化機理。在0.1 mol/L Na2SO4溶液中,?0.2 V的電位下,Cu3N/CF表現出最佳的NRR電催化活性和選擇性,NH3的生成速率達到1.12 × 10?10mol/(s·cm2),FE為1.5%,并且表現出良好的電催化穩定性。
1 實驗方法
1.1 試劑與儀器
泡沫銅、尿素、無水乙醇(C2H5OH)、丙酮(C3H6O)、氯化銨(NH4Cl)、水楊酸鈉(C7H5O3Na)、脫水檸檬酸鈉(C6H5Na3O7)、氫氧化鈉(NaOH)、硝普酸鈉(C5FeN6Na2O)、對二甲氨基苯甲醛(C9H11NO)、鹽酸(HCl)等。所有試劑都是分析純級別,不經過二次提純,溶液使用去離子水配制。
采用X射線衍射儀(XRD,Rigaku D/max-2200)測試樣品的物相和晶體結構。采用透射電子顯微鏡(TEM,JEM-2010 HR)、掃描電子顯微鏡(SEM,蔡司VLTRA-55)和能量散射X射線(EDX)分析測試樣品的表面形貌、元素組成等。采用電化學工作站(CHI 660E,上海辰華有限公司)進行電化學性能測試。采用紫外-可見分光光度計(島津,UV-1800)通過建立標準曲線定量分析樣品的電催化NRR性能。
1.2 Cu3N/CF電極的制備
首先,將剪裁好的CF(0.5 cm × 2.5 cm)分別在0.1 mol/L的鹽酸、丙酮、乙醇和去離子水中依次超聲清洗,60 ℃條件下烘干備用。隨后,將尿素(3 g)和CF分別置于兩個瓷舟中并將兩個瓷舟放置在管式爐的中心位置,其中,裝載了尿素的瓷舟位于氣流上游,裝載了CF的瓷舟位于氣流下游。在氬氣氣氛下,300 ℃高溫煅燒1 h,升溫速率控制為1 ℃/min。煅燒過程中位于氣流上游的尿素高溫分解產生NH3與下游的CF發生反應,從而將CF表面氮化得到Cu3N/CF。為了避免表面吸附的NH3對后續電催化NRR的影響,氮化之后的電極用0.1 mol/L的鹽酸超聲清洗三次,得到最終的Cu3N/CF電極。
1.3 電化學測試方法
電催化NRR性能測試在標準三電極體系下進行,Cu3N/CF作為工作電極,飽和甘汞電極作為參比電極,石墨棒作為對電極,0.1 mol/L Na2SO4溶液作為電解液,H型密封雙室電解池作為電解池。測試前,雙室電解池的Nafion膜分別在5% H2O2溶液和去離子水中80 ℃加熱1 h以去除可能的影響雜質,并對0.1 mol/L Na2SO4溶液通N230 min以獲得飽和N2溶液,測試過程中保持N2持續通入。本研究所涉及的電位值均換算成相對于可逆氫電極(Reversible Hydrogen Electrode, RHE)。所有電化學測試實驗均在室溫(22 ± 2) ℃下進行。
選擇恒電位電解法在不同電位下電解Cu3N/CF電極2 h進行測試,電位選擇分別為?0.1、?0.2、?0.3、?0.4和?0.5 V,電解2 h結束后收集電解池陰極的電解液。循環穩定性測試通過Cu3N/CF電極在?0.2 V電位下電解2 h循環五次開展,每個循環都使用新的電解液,收集每次電解后的陰極電解液。
1.4 電催化產NH3量的測定方法
電催化產NH3通過靛酚藍比色法定量測定。首先,制備以下四種溶液。氧化劑:0.05 mol/L NaClO溶液;著色劑:5 g C7H5O3Na、5 g C6H5Na3O7與4 g NaOH溶解在100mL H2O中;催化劑溶液:1% C5FeN6Na2O。標準溶液:配置0、0.123、0.246、0.369、0.492、0.615、1.23 μg/mL 的NH4Cl標準溶液。將1 mL氧化劑、2 mL著色劑和0.2 mL催化劑溶液依次加入2 mL NH4Cl標準溶液中,在室溫下避光靜置2 h后,使用紫外-可見分光光度計測量溶液在550?750 nm的吸光度曲線。根據標準溶液在655 nm處的吸光度,建立一系列NH4Cl溶液的濃度-吸光度標準曲線。
采用靛酚藍比色法測定電解結束后電解液在655 nm處的吸光度,再根據標準曲線確定電解液中的NH3質量濃度cNH3。
NH3生成率根據下式計算:

FE根據以下等式進行計算:

式中,V是電解液的體積(單位:mL),是檢測到的NH3質量濃度(單位:μg/mL),t是電解時間(單位:s),A是電極浸入溶液中的幾何面積(單位:cm2),F是法拉第常數(96485 C/mol),Q是施加的電量(單位:C)。
1.5 電催化產N2H4量的測定方法
電催化NRR過程有可能發生N2還原生成肼(N2H4)的副反應,可能產生的副產物N2H4通過Watt-Chrisp法測定。首先,配置以下幾種溶液。顯色劑:5.99 g C9H11NO加入30 mL HCl 和 300 mL C2H5OH的混合溶液中。標準溶液:配置質量濃度為0、0.103、0.206、0.412、0.6185、0.824、1.03 μg/mL的N2H4溶液。接著,在2 mL標準溶液中加入2 mL顯色試劑,室溫攪拌20 min。使用紫外-可見分光光度計測量溶液在420?480 nm的吸光度曲線。根據標準溶液在455 nm處的吸光度,建立一系列N2H4溶液的濃度-吸光度標準曲線。
采用Watt-Chrisp法測定電解結束后電解液在455 nm處的吸光度,再根據標準曲線確定電解液中的N2H4質量濃度。
N2H4生成率根據下式計算:

式中,V表示電解液的體積(單位:mL),是檢測到的N2H4質量濃度(單位:μg/mL),t是電解時間(單位:s),A是電極浸入溶液中的幾何面積(單位:cm2)。
2 結果與討論
2.1 Cu3N/CF電極的表征
圖1(a)為Cu3N/CF的XRD譜圖。位于43.5°、50.6°和74.3°的三個強峰是Cu(JCPDS No. 04-8306)的特征峰,歸屬于CF基底,位于22.9°、40.6°和47.3°的三個衍射峰歸屬于Cu3N(JCPDS No. 35-0768),表明CF表面已成功氮化為Cu3N。圖1(b)是氮化前CF的SEM照片,可以觀察到CF表面光滑平整。圖1(c)和(d)是Cu3N/CF的SEM照片,氮化之后CF表面形成了許多片狀結構Cu3N,這是由于氮化過程是N原子插入Cu金屬晶格形成間充型化合物Cu3N的過程,這一過程導致了表面Cu3N片狀結構的形成。圖1(e)是從Cu3N/CF電極表面刮下的Cu3N的TEM照片,驗證了其片狀的結構特征。圖1(f)的高分辨TEM(HRTEM)照片顯示了清晰的晶格條紋,其晶格間距為0.38 nm,歸屬于Cu3N的(100)晶面。XRD、SEM和TEM表征證明了Cu3N/CF電極的成功制備,其表面為片狀結構的Cu3N,內部為CF骨架。
2.2 電催化NRR性能測試分析
在進行電催化NRR性能測試前,首先通過靛酚藍比色法和Watt-Chrisp法分別對NH3與N2H4的濃度檢測建立了標準曲線。依照1.4的實驗步驟,得到了如圖2(a)所示的550 ? 750 nm一系列NH4Cl標準溶液的吸光度曲線。根據標準溶液在655 nm處的吸光度,建立如圖2(b)所示的NH4Cl溶液的濃度-吸光度標準曲線。圖2(b)插圖是一系列NH4Cl的標準溶液,從左到右濃度依次增大,同時溶液顏色也逐漸變綠。依照1.5的實驗步驟,得到了如圖2(c)所示的420 ? 480 nm一系列N2H4標準溶液的吸光度曲線。根據標準溶液在455 nm處的吸光度,建立如圖2(d)所示的N2H4溶液的濃度-吸光度標準曲線。圖2(d)插圖是一系列N2H4的標準溶液,從左到右N2H4濃度依次增大,同時溶液顏色也逐漸變黃。
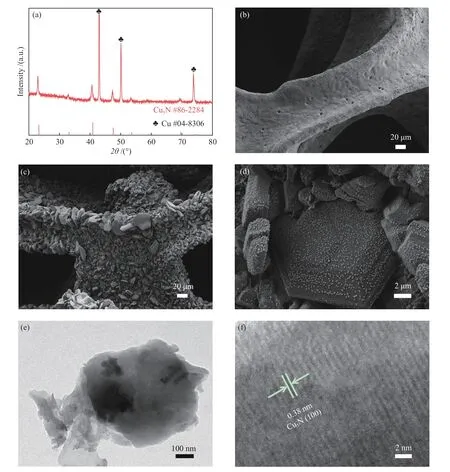
圖1 (a)Cu3N/CF的XRD譜圖;(b)CF的SEM照片;Cu3N/CF的((c)、(d))SEM照片、(e)TEM照片和(f)HRTEM照片Figure 1 (a) XRD pattern of Cu3N/CF; (b) SEM image of CF; ((c), (d)) SEM, (e) TEM, (f) HRTEM images of Cu3N/CF
Cu3N/CF電極的電催化NRR性能在0.1 mol/L Na2SO4溶液中標準三電極體系下測試,測試前需先通N230 min以獲得飽和N2溶液,測試過程中保持N2的持續通入。選擇恒電位電解法在不同電位下電解2 h進行測試,電位選擇分別為?0.1、?0.2、?0.3、?0.4和?0.5 V,電解2 h結束后收集陰極電解液,采用靛酚藍比色法和Watt-Chrisp法分別對電催化過程中產物NH3和可能副產物N2H4進行定量分析。圖3(a)是Cu3N/CF電極分別在飽和Ar和N2的0.1 mol/L Na2SO4溶液中的線性掃描伏安(LSV)曲線。飽和N2電解液中的LSV曲線與飽和Ar電解液中的LSV曲線大致重疊,但前者電流密度略有增加,表明Cu3N/CF具有電催化NRR活性。圖3(b)為Cu3N/CF電極在飽和N2電解液中開路電位下電解2 h后電解液的UV-vis光譜,在此條件下幾乎檢測不到NH3,表明在實驗和檢測中沒有外界的氨污染影響實驗結果,能夠檢測到的NH3僅由Cu3N/CF電極催化N2還原產生。如圖3(c)所示,電解后的電解液的UV-vis曲線可以明顯檢測到產物NH3的生成,伴隨電位逐漸變負,電解液中NH3的UVvis吸收強度呈現先增后減的態勢,且在?0.2 V時吸收強度達到峰值。如圖3(d)所示,發現電解液中N2H4的UV-vis吸收強度很弱,表明電催化NRR過程溶液中產生副產物N2H4的濃度極低。隨后,對Cu3N/CF電極的產NH3速率和FE進行了定量計算。如圖3(e)所示,電解液中的濃度通過靛酚藍比色法顯色法定量計算,結果表明,Cu3N/CF電極的產NH3速率和FE在?0.1到?0.5 V均伴隨電位變負而先增后減,并在?0.2 V電位下呈現峰值,其產NH3速率達到1.12 × 10?10mol/(s·cm2),FE達到1.5%。由于NRR和HER在該電位范圍內是一對競爭反應,N2分子和H2O分子在Cu3N/CF電極表面存在競爭吸附,更負的電位可能更有利于H2O分子的表面吸附。此外,同時也對電催化NRR的可能副產物N2H4生成速率進行了定量計算。如圖3(f)所示,在?0.5 V電位下,Cu3N/CF電極的產N2H4速率最高,達到1.15 × 10?12mol/(s·cm2),但與產NH3速率相比低了兩個數量級,因此,可以認為,Cu3N/CF電極在電催化NRR過程中產NH3的選擇性接近100%。
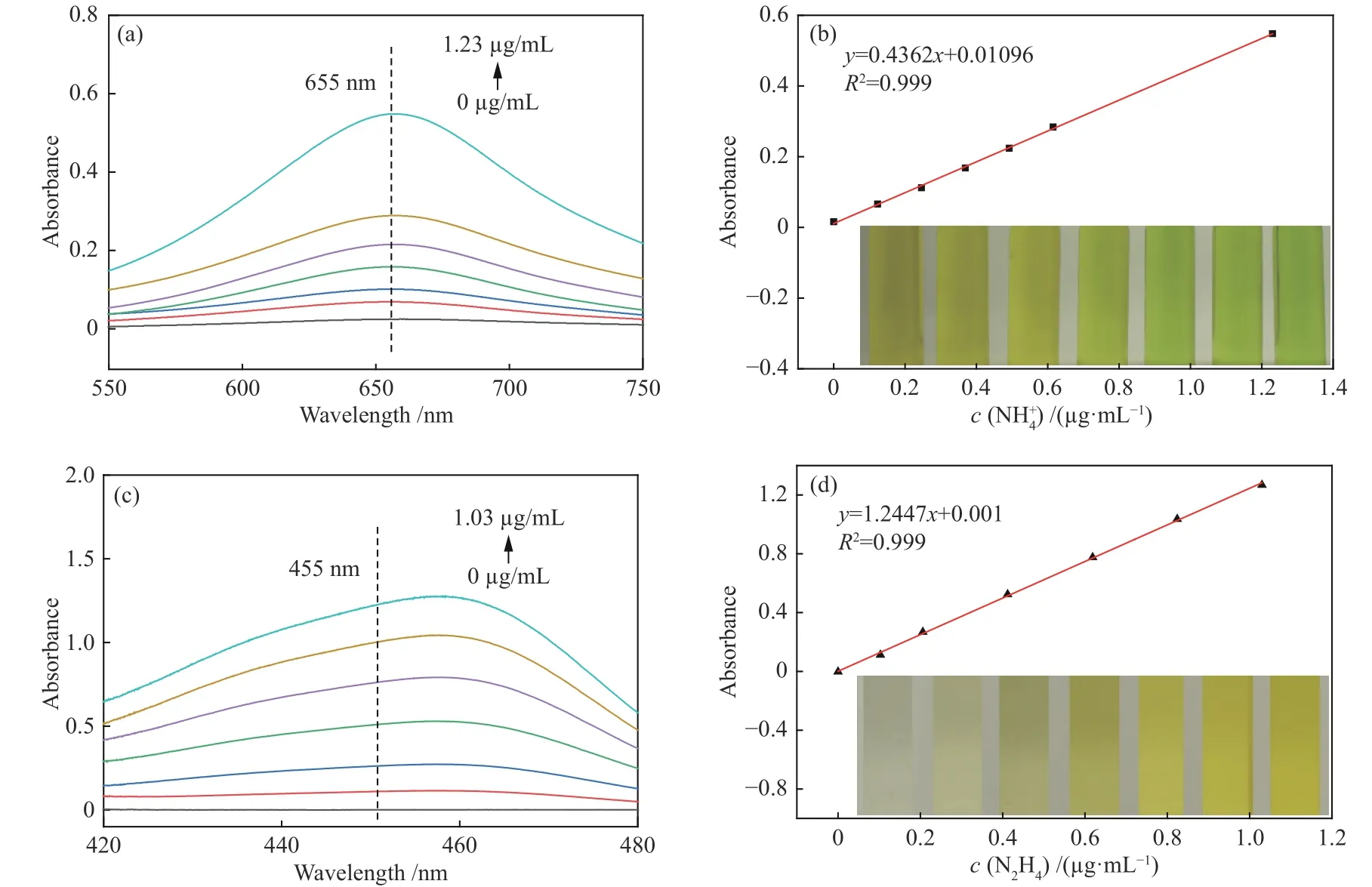
圖2 一系列標準質量濃度的溶液的(a)UV-vis譜圖和(b)在655 nm處的濃度-吸光度線性擬合曲線;一系列標準質量濃度的N2H4溶液的(c)UV-vis譜圖和(d)在455 nm處的濃度-吸光度線性擬合曲線Figure 2 (a) UV-vis absorption spectra and (b) the corresponding calibration curve of various concentrations; (c) UV-vis absorption spectra and (d) the corresponding calibration curve of various N2H4 concentrations
作為對比,對CF電極在?0.2 V電位下的電催化NRR性能也進行了測試,實驗結果表明,CF在該電位下的產NH3速率為1 × 10?11mol/(s·cm2),相同電位下較Cu3N/CF電極的產NH3速率低了一個數量級(如圖4(a)所示),表明Cu3N較金屬Cu具有更高的電催化NRR活性。為了比較Cu3N/CF電極和CF電極的電化學活性面積(ECSA),采用循環伏安法掃描法(CV)對兩個電極的電化學雙電層電容(Cdl)進行了測試。圖4(b)和圖4(c)分別為CF電極和Cu3N/CF電極在不同掃描速率下的CV曲線,隨著掃描速率的增大,CV曲線面積也隨之增大。通過CV曲線計算得到Cu3N/CF電極的Cdl值為12.4 mF/cm2,大于CF電極的Cdl值(3.8 mF/cm2),表明表面具有片狀結構的Cu3N/CF電極較表面光滑的CF電極具有更大的ECSA,因此,可以暴露更多的催化活性位點。為了進一步比較電催化NRR性能,表1列了文獻已報道的部分TMNs基材料、Cu基材料和自支撐型催化電極的電催化NRR性能,從中發現Cu3N/CF電極的產NH3速率和FE都具有一定的優勢。
電化學穩定性是評價催化劑性能的一個重要指標。圖5(a)顯示了Cu3N/CF電極在?0.2 V電位下電解14 h的催化電流密度-時間曲線,曲線前2 h電流密度略有下降,后期電流密度保持穩定。電解14 h后,Cu3N/CF電極的XRD譜圖與電解前未發生改變(圖5(b))。圖5(c)是Cu3N/CF電極電解后的SEM照片,可以發現其片狀的形貌結構在電解前后未發生變化。此外,對Cu3N/CF電極在?0.2 V電位下進行了循環五次的電解測試,每次循環都采用新的電解液。如圖5(d)所示,五次循環電解測試后計算得到Cu3N/CF電極的產NH3速率和FE都基本保持恒定。上述結果均表明了Cu3N/CF電極具有優異的電催化NRR穩定性。
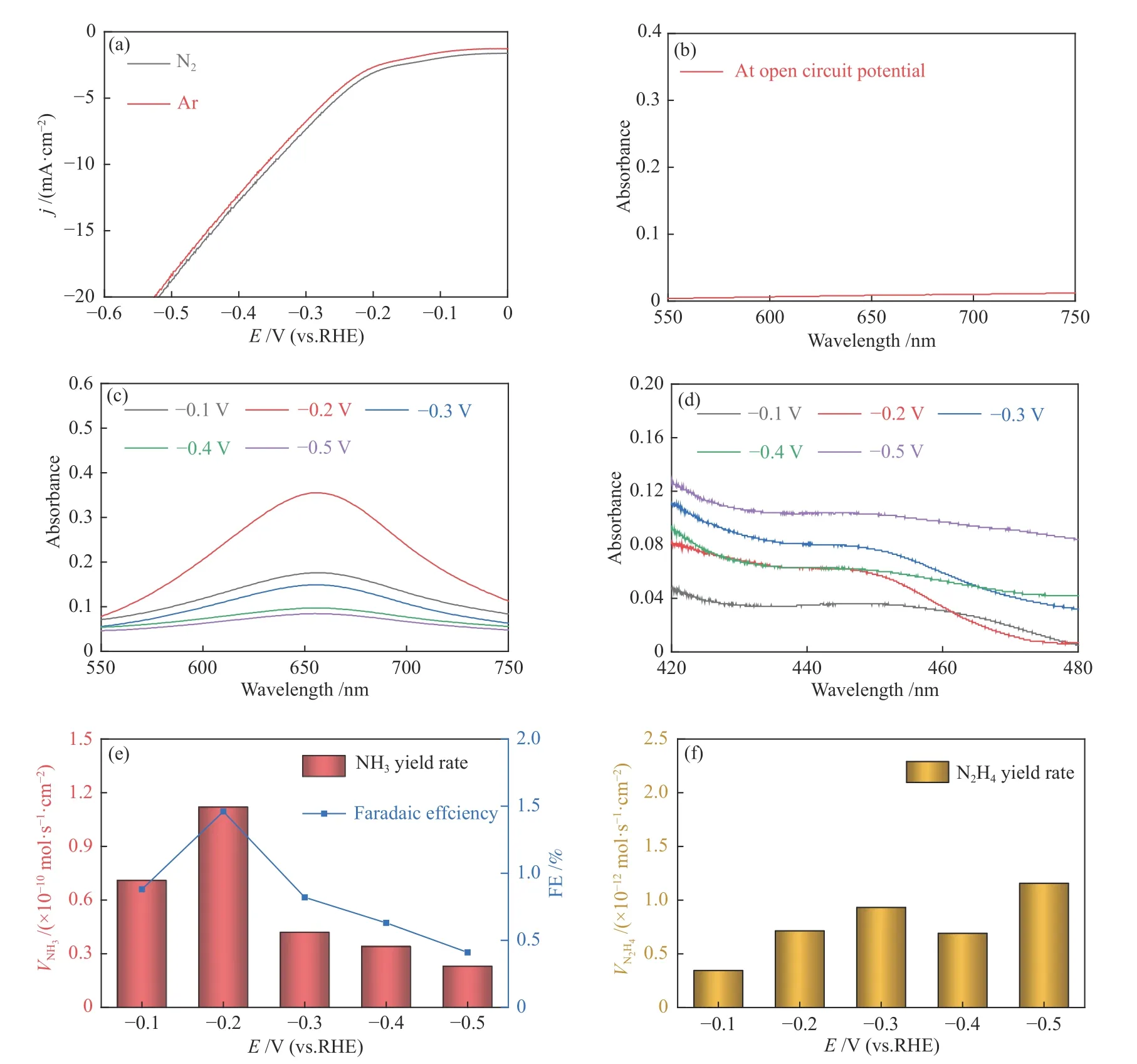
圖3 (a)Cu3N/CF電極分別在飽和Ar和N2的0.1 mol/L Na2SO4溶液中的LSV曲線;(b)Cu3N/CF電極在飽和N2電解液中開路電位下電解2 h后電解液的UV-vis光譜;不同方法檢測獲得的UV-vis譜圖與對應產物的生成速率和FE:(c)靛酚藍比色法;(d)Watt-Chrisp法;(e)NH3速率與FE;(f)N2H4速率Figure 3 (a) LSV curves of Cu3N/CF in Ar- and N2-saturated 0.1 mol/L Na2SO4, (b) UV-vis absorption spectra of the electrolyte after electrolysis of Cu3N/CF at open circuit potential in N2-saturated electrolyte for 2 h, UV-vis absorption spectra of the electrolyte by different detection methods and the corresponding product formation rate and FE, (c) Indophenol blue method;,(d) Watt-Chrisp method;(e) NH3 generation rate and FE, (f) N2H4 generation rate
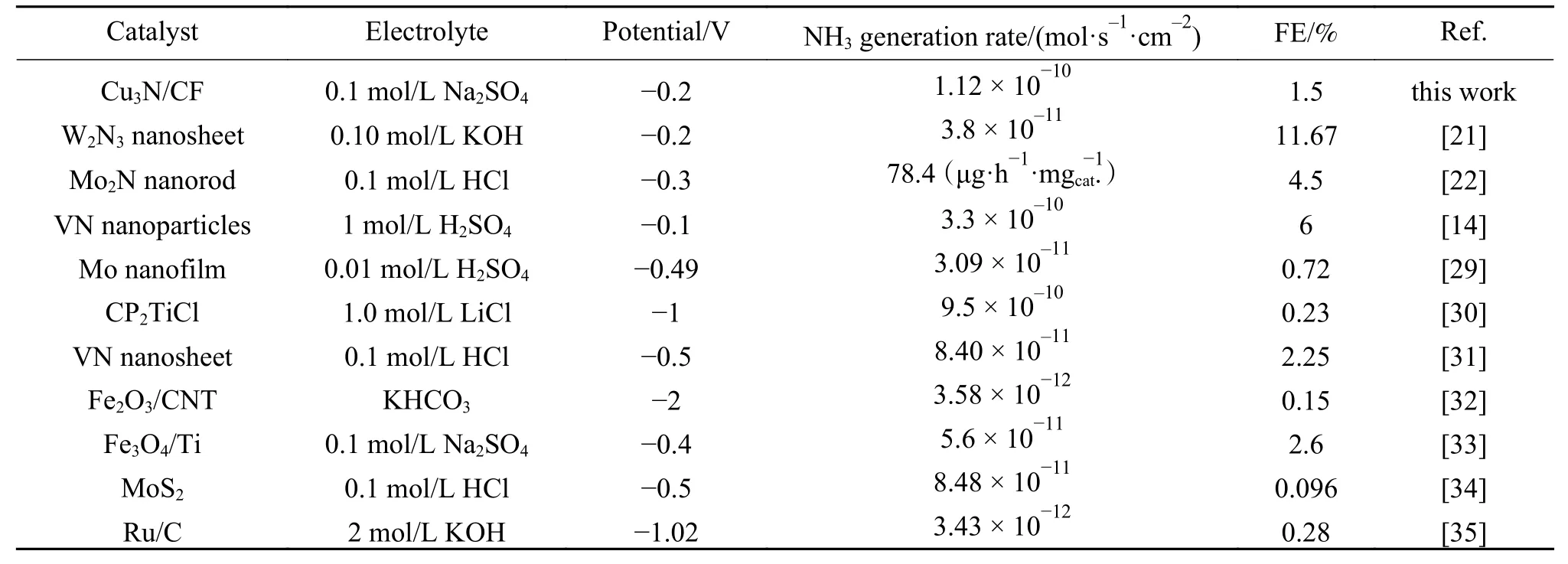
表1 Cu3N/CF與其它電催化劑產NH3速率和FE的比較Table 1 Comparison of NH3 generation rate and FE for Cu3N/CF with other reported electrocatalysts
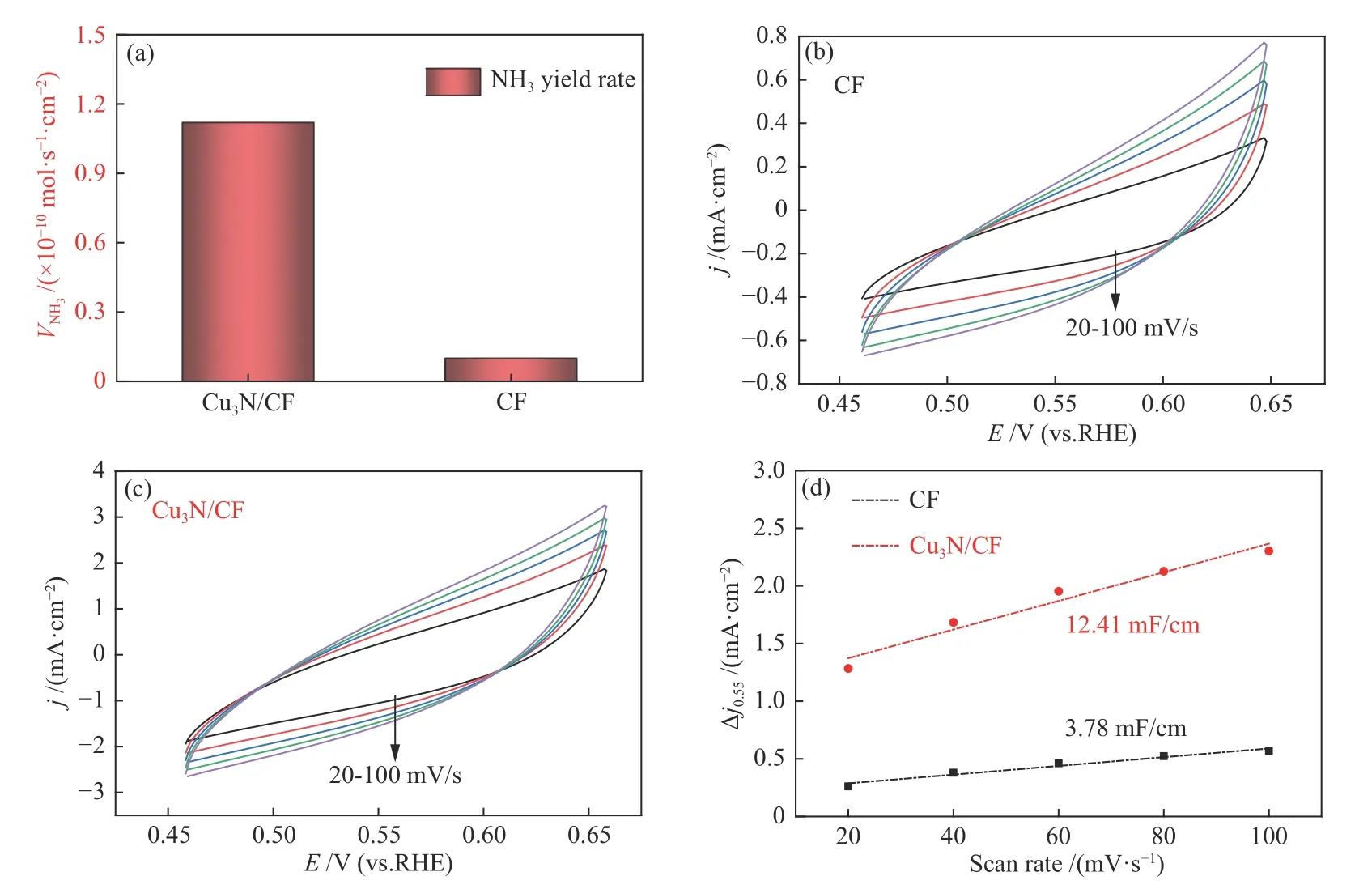
圖4 (a)CF與Cu3N/CF電極在?0.2 V電位下的電催化產NH3速率對比;(b)CF與(c)Cu3N/CF電極在0.1 mol/L Na2SO4溶液中不同掃描速率下的CV曲線;(d)CF與Cu3N/CF電極的電容電流-掃描速率關系曲線Figure 4 (a) NH3 generation rates for CF and Cu3N/CF at ?0.2 V vs. RHE in 0.1 mol/L Na2SO4, CV curves for (b) CF and (c)Cu3N/CF with various scan rates in 0.1 mol/L Na2SO4, (d) capacitive current as a function of scan rate for CF and Cu3N/CF
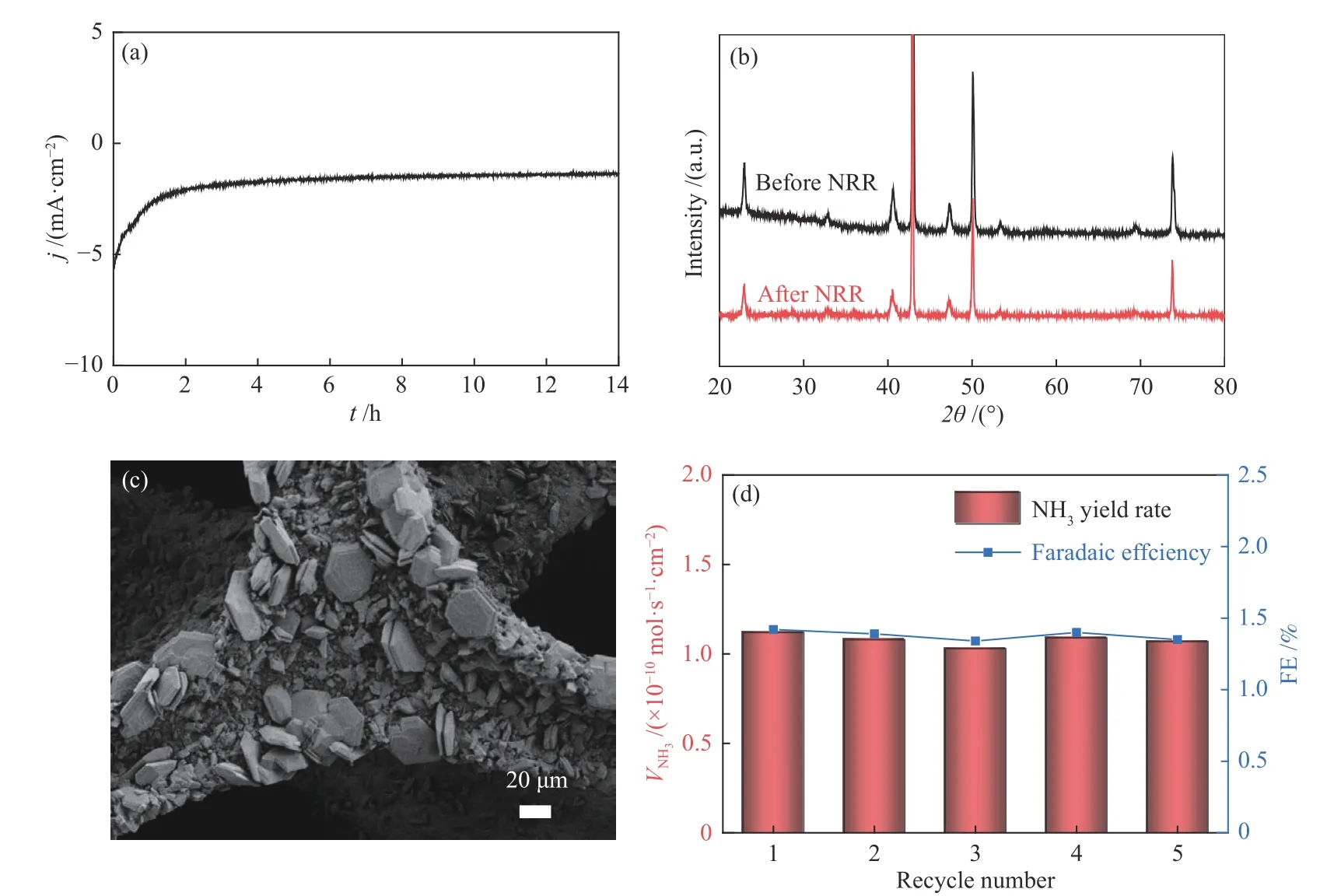
圖5 (a)Cu3N/CF電極在?0.2 V電位下的電解曲線;(b)Cu3N/CF電極在電解前后的XRD譜圖;(c)Cu3N/CF電極電解后的SEM照片;(d)Cu3N/CF電極循環電解五次的產NH3速率與FEFigure 5 (a) Long-term electrolysis curve of Cu3N/CF at ?0.2 V,(b) XRD patterns of Cu3N/CF before and after electrolysis,(c) SEM image of Cu3N/CF after electrolysis,(d) recycling test of Cu3N/CF at ?0.2 V
TMNs作為一類優異的NRR電催化劑近年來被廣泛研究報道,TMNs電催化NRR生成NH3過程基于Mars-van Krevelen催化機理[31,36],即TMNs表面的N原子首先作為N源與溶液中的質子不斷結合生成NH3并在表面形成一個N空位,隨后這個N空位被溶液中的N2分子填充補入,并進入下一個生成NH3的電催化過程(以Cu3N為例,如圖6(a)所示)。為了驗證Cu3N/CF電極的電催化NRR過程也是基于Mars-van Krevelen催化機理,將向電解液中通N2改為通惰性氣體Ar,并將Cu3N/CF電極在?0.2 V電位下電解4 h。電解結束后收集電解液,隨后采用靛酚藍比色法對溶液進行了UV-vis光譜表征。如圖6(b)所示,發現在Ar氣氛下的電解液呈現一定的UV-vis吸收強度,表明Cu3N/CF電極在惰性氣體Ar氣氛下利用了催化劑表面的N原子與水反應產生NH3,并形成大量表面N空位。對比了電解前后Cu3N/CF電極的XRD與EDX譜圖。XRD譜圖顯示Ar氣氛下電解后的Cu3N/CF電極Cu3N特征峰強度降低(圖6(c)),而EDX譜圖顯示該電極表面沒有檢測出N元素的存在(圖6(d)),這些結果表明,電解后的Cu3N/CF電極表面存在大量的N空位,而內部依舊保持了Cu3N的晶體結構,從而證實了Cu3N/CF電極的電催化NRR過程是基于Mars-van Krevelen催化機理。
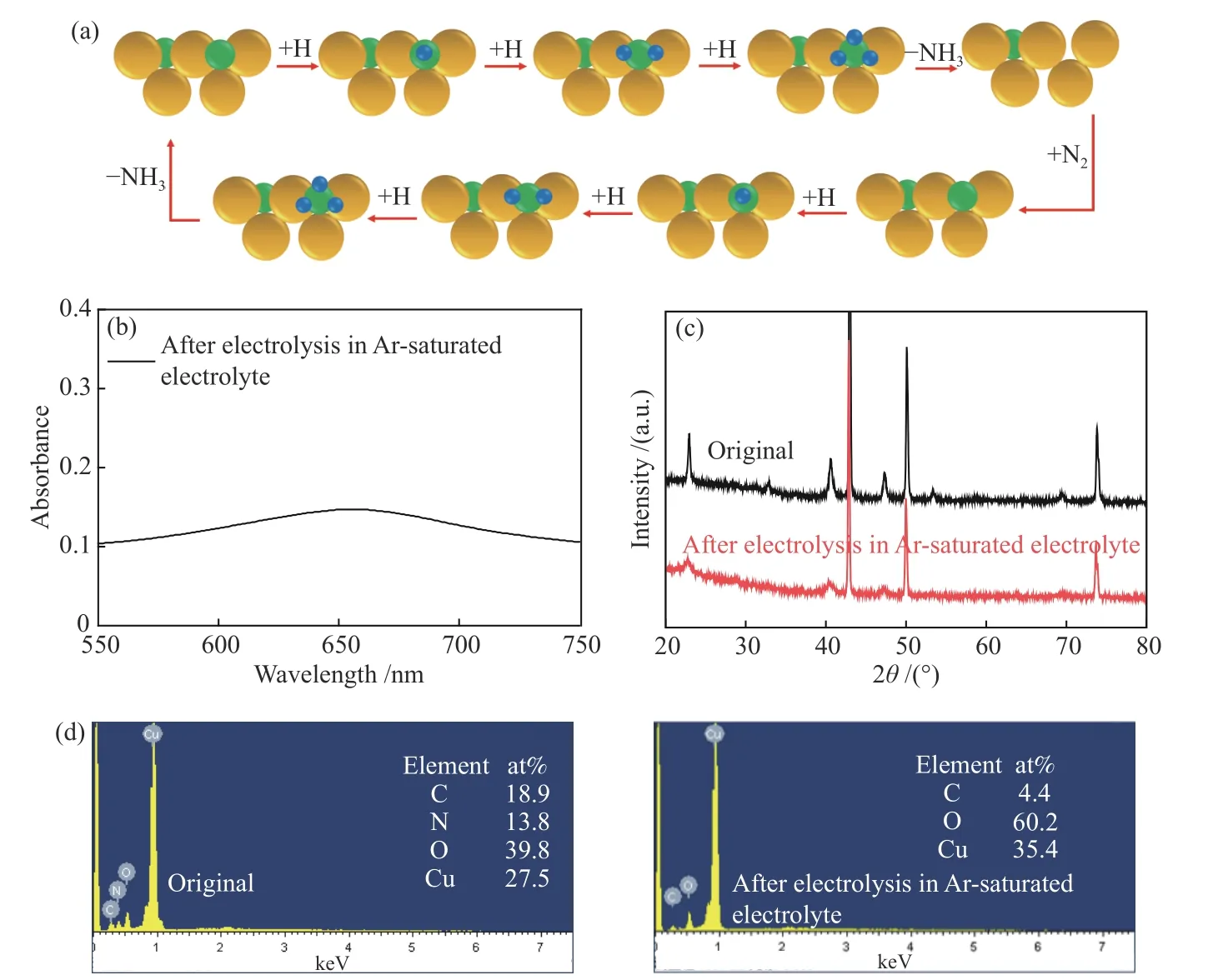
圖6 (a)Mars-van Krevelen催化機理(藍色、綠色和黃色球分別代表H、N和Cu原子);(b)Cu3N/CF電極在Ar氣氛下電解2 h電解液的UV-vis光譜;Cu3N/CF電極在Ar氣氛下電解前后的(c)XRD譜圖和(d)EDX譜圖Figure 6 (a) Proposed Mars-van Krevelen mechanism (blue, green, and yellow balls represent H, N, and Cu atoms, respectively), (b)UV-vis absorption spectrum of the Ar-saturated electrolyte after electrolysis of Cu3N/CF, (c) XRD patterns and (d) EDX spectra of Cu3N/CF before and after electrocatalysis of Cu3N/CF in Ar-saturated electrolyte
3 結 論
本研究以CF為基底,通過簡單一步氮化法制備了表面具有片狀結構的Cu3N/CF電極,并研究了Cu3N/CF電極在0.1 mol/L Na2SO4溶液中的電催化NRR活性和穩定性。研究發現,Cu3N/CF電極在?0.2 V電位下具有最高的電催化NRR活性,其產NH3速率達到1.12 × 10?10mol/(s·cm2),FE達到1.5%,同時具有良好的電催化穩定性,而且Cu3N/CF電極的電催化NRR性能優于對比樣CF。Cu3N/CF電極優異的電催化NRR性能可以歸因于以下因素:第一,Cu3N/CF電極表面片狀結構Cu3N提供了豐富的催化活性位點,內部的CF導電骨架為表面的Cu3N提供快速的電子轉移;第二,自支撐電極結構避免了黏連劑的使用,增強了催化劑材料的穩定性和耐久性,獨特3D泡沫金屬結構有利于電解液的接觸和傳質擴散;第三,Cu3N獨特的Mars-van Krevelen催化機理有利于N2分子在其表面的競爭吸附,從而提高產NH3速率和FE。
- 燃料化學學報的其它文章
- 鈮元素改性V2O5-WO3/TiO2催化劑降低脫硝過程 SO2 的氧化率
- 甲醇水蒸氣重整制氫Cu-Zn-Al尖晶石催化劑的研究
- Effects of TiO2 in Pd-TiO2/C for glycerol oxidation in a direct alkaline fuel cell
- Co3O4/WO3復合催化劑的合成及可見光催化轉化甲烷制甲醇
- Solvothermal synthesis of TiO2@MIL-101(Cr) for efficient photocatalytic fuel denitrification
- Preparation of Au-OVs-BiOBr-P25 Z-scheme photocatalyst and its photocatalytic performance in overall water splitting

