高氧離子電導鈣鈦礦的影響因素分析和設計策略
李文懷,周嵬
(南京工業大學化工學院,江蘇南京 211800;南京工業大學材料化學工程國家重點實驗室,江蘇南京 211800)
引 言
具有高氧離子電導率的氧離子導體廣泛應用于燃料電池、氧傳感器、氧泵以及透氧膜等設備。這些氧離子導體通常是氧化物,如螢石、褐鐵礦和鈣鈦礦,它們依靠體相中的氧離子傳輸通道進行快速氧離子傳輸。越來越多的研究正在探索氧傳輸機制以提高氧導體的性能。由于鈣鈦礦作為最受歡迎的氧離子導體廣泛應用于固體氧化物燃料電池(solid oxide fuel cell,SOFC)和其他氧傳輸設備[1?5],深入了解鈣鈦礦體相氧傳輸機理和影響因素對于這些設備性能的進一步提升具有重要意義。
鈣鈦礦氧化物,理想分子式為ABO3,其中O 一般代表的是氧,A 位是與氧離子形成12 配位的堿土、稀土類大半徑的陽離子,B 位通常是與氧離子形成6 配位的過渡金屬離子。實際上,鈣鈦礦結構具有很強的可調控性,可以允許一定的離子缺陷(A、B、O 都有可能),當小部分晶格氧從鈣鈦礦脫出并形成氧空位,這些空位就成為了氧離子傳輸的通道。研究者們常采用在A 位或B位摻雜不同價態的陽離子來實現體相高氧空位濃度,從而提高鈣鈦礦的氧傳輸性能。對于SOFC,鈣鈦礦SrCo0.8Nb0.1Ta0.1O3?δ(SCNT)和SrSc0.175Nb0.025Co0.8O3?δ(SSNC)因其高氧離子電導率和高電催化性能而被廣泛用作陰極組件[6?7]。氧傳感器常用的材料之一是摻雜鈣鈦礦SrTiO3,其固有的鍶離子點缺陷和豐富的氧空位,使得它能夠快速對氧物種發生響應[8]。具有豐富氧空位的鈣鈦礦 氧 化 物,例 如Ba0.5Sr0.5Co0.8Fe0.2O3?δ(BSCF) 和La0.5Sr0.5Co0.8Fe0.2O3?δ(LSCF),也廣泛應用于透氧膜并實現高氧滲透性[9?10]。因此,鈣鈦礦氧化物的氧傳輸性能與其氧空位特性密切相關。
已經有許多研究揭示了鈣鈦礦氧化物的氧傳輸特性與其結構之間的相關性,并深入探索了鈣鈦礦氧化物體相中氧傳輸的過程和機制。一般來說,鈣鈦礦體相中氧的遷移是通過氧空位傳輸通道進行的,空位的移動被認為是一種常規的跳躍機制[11]。鈣鈦礦的氧傳輸性能很大程度上取決于體相氧空位的性質,并且受到晶體結構和陽離子性質的影響。例如,Mogensen 等[12]提出由離子半徑失配引起的晶格畸變(晶格應力或偏離立方對稱性)能夠明顯影響離子電導率的大小,并且晶格畸變的程度比許多其他晶體結構參數更加重要。
截至目前,研究者們提出了很多控制鈣鈦礦氧化物氧傳輸的影響因素,然而,這些影響因素之間的相關性和更深的作用機理還不是很清楚,這給設計合適的鈣鈦礦氧導體帶來了一定的困難,進而影響SOFC、透氧膜等領域的商業化道路。本文將首先簡要介紹鈣鈦礦體相中氧傳輸的機制,然后詳細討論影響氧傳輸性能的主要因素和相應的表征方法,接著介紹模擬計算在氧傳輸領域中的應用。最后,將給出對鈣鈦礦氧導體的氧傳輸性質的總結和展望。
1 機 理
鈣鈦礦氧化物有三種主要的結構類型被廣泛應用于氧離子導體領域:簡單立方型鈣鈦礦(ABO3)、層 狀 鈣 鈦 礦(AA′B2O6) 和 Ruddlesden?Popper(An+1BnO3n+1)結構[13]。圖1 顯示了這些氧化物的晶體結構。三種結構的B位為過渡金屬離子并與氧形成八面體結構(BO6),A 位為堿土金屬或鑭系元素離子(Lnn+)位于包含八面體的立方體的頂點上,與氧形成12配位。堿土金屬離子和Lnn+的分布決定了不同的晶體結構以及氧缺陷的類型和位置,這是三種結構電子和離子導電特性差異化的主要原因[14]。對于立方型鈣鈦礦[圖1(a)],堿土金屬(Ca、Sr、Ba)或鑭系元素(Ln = La、Pr、Nd 等)陽離子隨機分布在A 位,氧空位也隨機分布在由BO6組成的氧亞晶格上,因此氧的傳輸通道是三維隨機分布的。對于層狀鈣鈦礦,堿土金屬和Lnn+的離子半徑之間的差異誘導了陽離子排序,構成了交替層AO?BO2?A′O?BO2[圖1(b)]。其中,Lnn+更容易失去氧,從而使得氧空位主要位于LnO 層上,這就導致了AA′B2O6中氧離子擴散的二維遷移路徑[15]。在Ruddlesden?Popper 結構的A2BO4晶格中,A—O 和B—O 鍵長之間的明顯差異造成了鈣鈦礦晶格層之間的不匹配,從而產生了特殊的層狀結構AO?ABO3[圖1(c)],這樣的分層結構同樣造成了氧離子的二維擴散。與層狀鈣鈦礦不同的是,在A2BO4氧化物中,AO 層上的自由空間允許在四面體位點上引入間隙氧,從而導致氧的遷移通道從主要的氧空位變為氧間隙。由于三種鈣鈦礦具有不同的體相氧傳輸方式,且ABO3型鈣鈦礦的三維氧傳輸過程更具代表性,因此本文只討論影響ABO3型鈣鈦礦氧傳輸的因素。
鈣鈦礦體相中的氧傳輸是一種基本且復雜的現象,其最明顯的特征是陰離子和陽離子亞晶格會限制離子向其自身的亞晶格傳輸,同時傳輸過程仍然受到主體陽離子亞晶格的影響[16]。一般來說,晶體中的氧傳輸可以用擴散機制來描述,即氧從一個平衡位置移動到相鄰位置,點缺陷(空位)在這種擴散過程中至關重要。而對于鈣鈦礦晶體材料,有一種普遍接受的機制:空位機制,也就是氧離子通過跳躍到相鄰的氧空位而擴散,該擴散速率會深受系統中氧空位周圍環境的影響。除此之外,氧空位的濃度對擴散動力學也有著至關重要的影響。最后,氧空位的分布,即遷移路徑的分布,也是一個氧傳輸性質的重要影響因素。氧離子在立方鈣鈦礦體系中的遷移路徑如圖2 所示。總而言之,鈣鈦礦體相中的氧擴散非常依賴氧空位,氧空位不同方面的性質會直接影響氧擴散性能的表現。接下來,將主要討論以下四個因素對鈣鈦礦體相氧傳輸性能的影響:晶體結構、平均金屬?氧鍵能、氧空位的濃度和氧空位的分布。
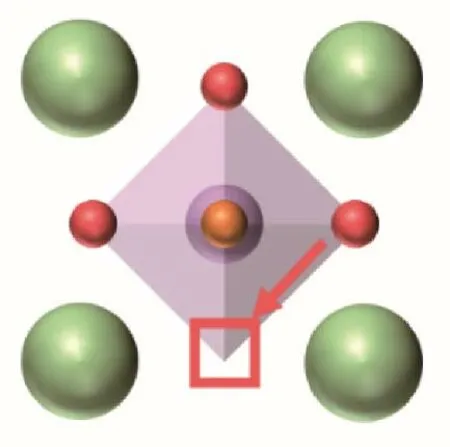
圖2 立方鈣鈦礦氧空位遷移路徑Fig.2 Oxygen migration path in the cubic perovskite structure
2 影響氧傳輸的因素
氧離子在鈣鈦礦體相中傳輸不僅會受到傳輸通道的數量及分布的影響,也受到其周圍環境的作用。氧空位遷移能描述了氧離子在鈣鈦礦體相遷移路徑中跳躍的難易程度,最能表示周圍環境對氧空位遷移的影響。在過渡態理論體系中[17],以氧空位為遷移路徑的氧離子交換率(v)由Boltzmann 關系表示為:

式中,EM是沿著這條路徑的遷移能壘;v0是一個常數。氧空位遷移能取決于遷移路徑附近的以下關鍵因素[18?19]:(1)氧遷移路徑周圍的陽離子,特別是氧遷移時穿過的陽離子對;(2)氧空位初始和最終位點附近的氧空位距離和位置;(3)氧空位初始和最終位點附近摻雜陽離子的距離和位置。因此,氧空位遷移能的大小主要與通往下一個空位的障礙以及打破氧與B位金屬鍵(B—O鍵)的難度有關。前者主要受晶體結構影響,后者主要由B—O鍵能決定。
除了氧空位的周圍環境,顯然氧空位的濃度與分布也是影響鈣鈦礦體相氧傳輸的重要因素。考慮到氧擴散速率和空位之間的平衡,氧擴散速率DO與空位擴散速率Dv相關,其數學形式為:

式中,cv是空位濃度。值得注意的是,在cv較小時,DO幾乎與cv成線性比例,這也進一步證明了空位濃度與氧擴散速率之間的強正相關性。
不僅如此,空位擴散率Dv與氧空位的均方位移〈R2〉也具有相關性,數學形式表示為:

這表明氧空位分布的均勻程度與擴散效率呈正相關。因此,氧空位的分布也是影響氧傳輸的重要因素。
2.1 晶體結構
2.1.1 晶體對稱性 在理想的ABO3型鈣鈦礦中,A位離子具有與氧離子相同的尺寸,并且與氧離子一起構成最密立方堆積。而氧離子組成的八面體的中心恰巧由B 位離子填充,此時鈣鈦礦的結構最穩定。不僅如此,鈣鈦礦可以在保持結構穩定的前提下,容納不同半徑和價態的陽離子,因此可以通過摻雜實現高濃度的氧空位和高氧離子電導率。然而,不是任何半徑的陽離子都可以摻入鈣鈦礦體相中,Goldschmidt 引入了一個稱為容差因子t的幾何參數來判定鈣鈦礦的結構是否穩定[20?21],它定義為:

式中,rA、rB、rO分別是An+、Bn+、O2?的半徑。當t=1 時,該結構為理想的立方鈣鈦礦。而t與1 的差值越大,表明該結構偏離理想狀態越明顯,直至無法維持鈣鈦礦結構。據觀察,保持鈣鈦礦氧化物結構穩定的t值范圍為0.75 <t<1.1。t與1 的偏差將通過較低的對稱性來適應結構變化,例如使O—B—O鍵彎曲,使得鍵角<180°,從而與O—A—O 鍵進行匹配,而形成正交和單斜晶系[22?23]。擁有不同晶體對稱性的鈣鈦礦氧化物,其內部各原子之間的距離存在較大差異,因此氧在晶體內部遷移受到的作用力以及遷移路徑的長短都不相同,造成了不同晶體對稱性鈣鈦礦氧化物之間的氧傳輸性能的巨大差異。
Lybye 等[24]詳 細 研 究 了La0.9Sr0.1B0.9Mg0.1O2.9(B=Al3+,Ga3+,Sc3+,In3+)四種鈣鈦礦的結構與其氧離子電導率的關系,發現高晶格對稱性的鈣鈦礦具有最大的氧離子電導率,考慮到晶格應力,也可以解釋為無應力晶格促使氧離子傳輸。除了常見的燃料電池電解質材料,在透氧膜上也發現了類似的規律。Wang 等[25]制 備 的Ce0.9Pr0.1O2?δ?Pr0.6Ca0.4FeO3?δ復 合 透氧膜表現出優異的透氧性能和抗CO2穩定性,其主要原因是鈣鈦礦相Pr0.6Ca0.4FeO3?δ的高晶體對稱性。目前,普遍認為高對稱的立方相有利于氧的滲透,因為氧離子在立方相中可以在三維方向上傳遞,而在正交或斜方相中會受到限制。例如,在屬于正交晶系的La0.64(Ti0.92Nb0.08)O2.99化合物中,氧離子很容易在ab平面上遷移而很難沿c軸遷移[26]。
為了實現這種無應力晶格或者高對稱性的鈣鈦礦結構,必須合理考慮構成鈣鈦礦的A 位和B 位的離子半徑以使得鈣鈦礦的容差因子t接近于1。由式(4)可得,此時A位離子應盡可能等于氧離子的尺寸,也就是說,理想的A 位離子半徑rm,A為1.40 ?(氧6 配位時的半徑)(1?=0.1 nm)。因此,La3+(12 配位下r= 1.36 ?) 和Sr2+(12 配位下r= 1.44 ?)通常是高氧離子電導率鈣鈦礦常用的A 位離子。同理,B 位離子半徑應該足夠匹配BO6八面體的空間大小(roh=0.58 ?)。考慮到實際鈣鈦礦中的高氧空位濃度,則合適的B 離子半徑應大于roh的10%,得到rm,B=0.64 ?。對于這個值來說,Al3+(r=0.54 ?)略小,而Sc3+(r=075 ?)和In3+(r= 0.80 ?)太大了。Ga3+(r= 0.62 ?)與roh非常接近。因此,鈣鈦礦La0.9Sr0.1GaO2.9是常見高氧離子導體的母體材料。
與該rm,B相比,Mg2+半徑(r=0.72 ?)偏高,在高氧離子電導率鈣鈦礦La0.9Sr0.1Ga0.9Mg0.2O2.8中會產生少許的晶格扭曲。Singhal 等[27]報道,用更小半徑的Co或Ni 取代La0.8Sr0.2Ga0.8Mg0.2O2.8中的部分Mg2+,能夠顯著提高氧離子電導率,這表明晶體對稱性的增加有利于增加氧離子電導率。不僅如此,Slater 等[28]采用粉末中子衍射詳細研究了鈣鈦礦La0.9Sr0.1Ga0.8Mg0.2O2.85不同溫度下的結構,結果指出當鈣鈦礦結構未變形時,氧離子能夠容易地移動到相鄰的氧空位位點。
但 也 有 例 外,Kajitani 等[29]研 究 了Al 摻 雜 對LaGa0.9Mg0.1O2.95鈣鈦礦氧化物的晶體結構和氧離子電導率的影響。他們發現隨著摻雜量的增加,LaGa0.9?xAlxMg0.1O2.95的結構從正交變為菱形,最后變為立方。這說明Al 摻雜能夠有效地形成具有更高對稱性的晶格。但是,隨著摻雜量的提升,LaGa0.9Mg0.1O2.95的氧離子電導率卻降低了。這表明,不能只考慮晶體對稱性對鈣鈦礦體相氧傳輸性能的影響。
2.1.2 晶格自由體積 如前所述,盡管通過在LaGa0.9Mg0.1O2.95摻雜Al形成立方鈣鈦礦,但并未提高體相氧離子電導率,這是因為Al的摻雜也同樣改變了鈣鈦礦的晶格自由體積,這也是一個影響鈣鈦礦體相氧傳輸的重要因素。晶格自由體積(Vf)是描述鈣鈦礦單個晶胞剩余空間的重要參數,實際上代表了晶胞體積與晶胞內所有離子占據的體積總和之差。
Hayashi 等[30]報道,大的Vf對于鈣鈦礦結構中的氧離子傳導是有利的。Nomura等[31]發現具有更大Vf(13 ?3)的La0.9Sr0.1GaO3?δ的 氧 離 子 電 導 率 高 于La0.9Sr0.1AlO3?δ(Vf=9 ?3)。Kajitani 等[29]研 究 了Al 摻 雜LaGa0.9Mg0.1O2.95鈣鈦礦氧化物的晶體結構和氧離子電導率的關系,發現隨著Vf的降低,LaGa0.9?xAlxMg0.1O2.95的氧離子電導率降低。這些結果表明,晶格自由體積也是影響鈣鈦礦氧離子傳導性能的重要因素。晶胞自由體積越大,氧離子遷移通道的半徑越大,遷移越容易,遷移能就越小。
Gao 等[32]通 過 應 變 工 程 實 現 了 對La0.9Sr0.1Ga0.95Mg0.05O3?δ(LSGM)中的Vf和BO6八面體旋轉的量化控制。結果發現,Vf和BO6八面體旋轉均對鈣鈦礦結構中的氧離子遷移有重大影響,最佳結構是在具有大的Vf前提下產生一定的八面體旋轉。隨后的DFT 計算揭示出較大的Vf可以減少遷移能壘,而大的八面體旋轉會產生低能量的遷移途徑。作者設計的LSGM 超晶格結構能夠同時具有大的Vf和一定的八面體旋轉,這導致氧離子導電性的增強。不僅如此,大的Vf能夠提高鈣鈦礦的氧離子電導率的結論也被很多研究者[33?38]在其他材料上得到驗證。
然而,Vf并不是越大越好,根據Sammells 等[39]的實驗結果,在BaTh0.9Gd0.1O3?δ鈣鈦礦結構中存在著使氧離子傳導最佳的Vf(30~35 ?3)。而Kakinuma 等[40]通過研究Ba0.3Sr0.2La0.5(In1?xMx)O2.75(M = Sc 或Yb)體系的氧離子電導率與Vf之間的關系驗證了這個猜想。他們發現這些體系鈣鈦礦的氧離子電導率隨著Vf的增大而增加,但當Vf增大到24.3 ?3時,電導率反而下降。雖然對于不同的鈣鈦礦結構,最佳Vf值可能會存在差異,但是很多研究都表明過大的Vf會導致氧八面體的局部混亂,阻礙氧離子的傳輸[32,41?43]。
除晶格自由體積之外,也有研究者用臨界半徑(rc)來表示氧離子傳輸的通道大小,兩者具有很強的相關性。對于rc,首先由Kilner 等[20]提出,他們指出要使一個氧離子在兩個氧位點之間跳躍,它必須通過一個由三個陽離子接壤的間隙,并將該間隙的半徑命名為臨界半徑(rc)。圖3 顯示了立方鈣鈦礦110平面中的這種間隙。rc主要受A 位和B 位的離子半徑影響,當陽離子半徑使rc越大時,空位運動的障礙越小,此時鈣鈦礦體相的氧離子電導率就會越高。值得注意的是,晶體結構對rc也有顯著影響,通常認為立方鈣鈦礦比六方和斜方鈣鈦礦具有更大的,而晶體結構也很大程度上由構成鈣鈦礦的A 位和B 位離子半徑所決定。值得注意的是,對于常見的高性能鈣鈦礦氧導體,計算得出的rc≤1.05 ?,明顯小于Shannon[44]計算出的六配位氧離子半徑1.40 ?。雖然氧離子在傳輸過程中,可暫時采用三配位將半徑減小到1.36 ?,但是氧離子若想穿過比自身小的rc,必須依靠陽離子的熱振動來使rc短暫增大。而陽離子的熱移動的幅度與離子質量呈負相關。因此,氧離子電導率應隨著金屬離子質量的增加而降低。

圖3 立方鈣鈦礦中的臨界半徑(rc)Fig.3 The critical radius(rc)in a cubic perovskite
如果同時考慮晶體對稱性和Vf,可以發現在一個特定的鈣鈦礦結構中,往往不能同時實現兩個參數各自的最優值。這一點也有研究者通過探究(La0.9Sr0.1)LnO3-δ(Ln = Al, Ga, Sc, In, Lu)體系得出,發現擁有最高氧離子電導率的為(La0.9Sr0.1)GaO3-δ鈣鈦礦,其實現了Vf和晶體對稱性之間的平衡[31]。因此,如何調控晶體結構從而提高鈣鈦礦體相氧傳輸性能,還需要結合實際情況來選擇適合的A 位和B 位離子。
2.2 平均金屬-氧鍵能
氧離子在鈣鈦礦體相中的遷移必然伴隨著其與金屬離子的斷鍵與成鍵。一般來說,斷鍵越容易,氧離子越容易遷移,衡量斷鍵難易程度的就是鍵能。常用平均金屬?氧鍵能(average bonding energy, ABE)來表示鈣鈦礦體相中氧離子斷鍵的難易程度。相比于A 位離子來說,B 位離子的尺寸和電荷是影響ABE的更重要的參數。因為BO6八面體構成鈣鈦礦結構的基本框架,并且氧與更小更近的B 位金屬離子的成鍵要明顯比A 位金屬離子更強。所以,在研究氧離子遷移難易時,也有研究者將平均金屬?氧鍵能簡化為平均B位金屬?氧鍵能。
有相當多的研究進一步證明了B位離子的大小的重要性。如在NdGaO3(rNd3+=1.27 ?)和PrGaO3(rPr3+=1.31 ?)中,即使當A 位陽離子小于理想半徑rm,A時,氧離子電導率仍然相對較高,這是因為氧離子與B位陽離子之間存在合適的鍵能,使得其傳輸更加容易[45?47]。如果只考慮B—O 鍵能對氧離子傳輸的影響,應在A3+B3+O3型鈣鈦礦中尋找最佳的氧離子導體。Hayashi 等[30]也得出了這一相同的結論,B 位離子和氧離子之間的鍵能在A2+B4+O3和A1+B5+O3型鈣鈦礦中顯著增加,而這會阻礙氧離子的傳輸。例如在SrTi0.8Ga0.2O2.9的氧化物離子電導率中,盡管rSr2+=1.44 ?和rTi4+=0.61 ? 非常接近于理想的A 位和B位離子半徑rm,A和rm,B,但其在800℃下僅有1 mS/cm 的氧離子電導率[24]。然而,只考慮B—O 鍵能而忽略晶體結構對氧離子電導率的影響也是不可取的,大多數情況下Sr2+還是合適A位離子的選擇。
對于B—O 鍵能,一般認為,這很大程度上是由B 位陽離子的種類和價態決定[48?49]。B 位金屬在元素周期表的位置與其B—O 鍵能有一定的規律性,將在表征部分進行詳細討論。而相同元素的價態越高,其B—O鍵能越大。
因此,若想減小氧空位周圍環境阻力以增加氧傳輸性能,必須先考慮A 位和B 位陽離子的基本性質,如原子序數、離子半徑和氧化態,這些性質會從根本上改變氧空位遷移能的大小。除此之外,鈣鈦礦晶格可以容忍一定程度的陽離子非化學計量,而保持結構穩定。過去的研究表明,A 位和B 位整體缺陷都可以增強鈣鈦礦BSCF 作為透氧膜的氧滲透性能和作為SOFC 陰極的氧還原反應(ORR)活性[50?51]。實際上,A 位和B 位整體缺陷會改變臨界半徑,從而影響鈣鈦礦的氧傳輸性能。Ding 等[52]通過在鈣鈦礦SrCo0.8Nb0.1Ta0.1O3?δ(S100CNT)中引入A 位缺陷制備Sr0.95Co0.8Nb0.1Ta0.1O3?δ(S095CNT)降低了體相的ABE,從而降低了氧遷移能壘。這表明,A 位和B 位整體缺陷對氧離子電導率也有不可忽視的影響。
2.3 氧空位的濃度
氧空位是氧離子在鈣鈦礦中遷移的通道。因此,在保持晶體結構穩定的前提下,氧空位濃度越高,氧傳輸速率越快。空位濃度與氧擴散性能關系示意圖如圖4所示。作為鈣鈦礦中常見的點缺陷類型,氧空位很容易自發或被調控產生。在鈣鈦礦A位和B位摻雜不同價態的堿土金屬或過渡金屬是增加氧空位濃度的常用方法。例如,鈣鈦礦Ba0.5Sr0.5Co0.8Fe0.2O3?δ(BSCF)作 為SOFC 的 經 典 陰 極,是通過分別在SrCoO3?δ的A位和B位摻雜Ba和Fe合成的。擁有高氧空位濃度的BSCF 實現了高氧離子電導率和在500℃下0.135 Ω·cm2的低面積比電阻[53]。同樣地,在鈣鈦礦SrTiO3的A 位摻雜La 可以合成具有高氧空位濃度的Sr0.995La0.005TiO3?δ(SLT),其作為氧傳感器表現出了快速的氧響應速度[54]。然而,當摻雜濃度變得非常高時,氧空位過多可能會導致材料發生相變,變為類鈣鐵鋁石結構。相對于鈣鈦礦結構而言,這些缺失的氧不能再被視為有效缺陷,并且難以移動[5]。

圖4 鈣鈦礦體系氧遷移路徑的示意圖Fig.4 The schematic diagram of oxygen migrates in perovskite
因此,鈣鈦礦體相中氧空位的濃度可以通過簡單的摻雜策略進行調控。然而,更重要的是鈣鈦礦需要在高氧空位濃度下不發生相變。研究表明,當t= 1 時,鈣鈦礦結構最穩定,可以容納更多的氧空位[55]。
增加鈣鈦礦氧空位容納上限的另一種策略是增大晶胞自由體積。氧空位的產生會導致B 位金屬離子的化合價降低,從而增加B 位離子的半徑,這容易引發鈣鈦礦的相變。而大的晶胞自由體積可以在保持結構穩定的前提下允許更大的B 位離子半徑,換句話說,它可以容納更多的氧空位。例如,摻 雜 鈣 鈦 礦BSCF 比La0.5Sr0.5Co0.8Fe0.2O3?δ(LSCF)具有更多的氧空位[56?58]。這是因為Ba2+半徑大于Sr2+和La3+,所以BSCF 具有更大的晶胞自由體積從而增加了氧空位濃度上限。由此看來,具有高對稱性和較大晶胞自由體積的鈣鈦礦不僅從空間結構上更利于氧離子傳輸,也更有利于氧離子傳輸通道的增加。
值得注意的是,A 位和B 位整體缺陷也是提高氧空位濃度的方法之一。這種整體缺陷會造成鈣鈦礦體相陽離子正電荷的缺失,使得材料產生更多氧空位以維持電中性。迄今為止,一些A 位整體缺陷的鈣鈦礦,已被開發作為SOFC 陰極的Sr0.95Nb0.1Co0.9O3?δ、 Ba0.9Co0.7Fe0.2Mo0.1O3?δ和Sr0.8Ce0.1Fe0.7Co0.3O3?δ,均顯示出比未缺陷鈣鈦礦更高的氧空位濃度和更好的氧傳輸性能[59?61]。不僅如此,Kuai 等[50]通過在鈣鈦礦氧化物BaCo0.4Fe0.4Zr0.1Y0.1O3?δ中引入輕微的B 位陽離子缺陷,也使體相產生更高濃度的氧空位。
2.4 氧空位的分布
逐漸有研究表明,氧空位濃度不是越高越好。氧空位濃度過高會導致氧空位之間距離過近而形成有序結構,有序結構中的氧空位作為穩定結構的一部分,失去了傳輸氧離子的能力[62?63]。不僅如此,即使鈣鈦礦體相中的氧空位濃度較低,若是氧空位分布不均勻,局部也會形成有序的氧空位,這些局部有序的氧空位也不再是氧離子傳輸的通道,而是它們傳輸的障礙。
這種缺陷有序的現象與鈣鈦礦結構的基本性質有關。在鈣鈦礦結構中,存在三種缺陷與缺陷之間的相互作用,分別為空位(Vo)?空位、陽離子(Lnn+)?陽離子以及Vo?Lnn+缺陷簇。它們的大小與之間的締合(結合)能有關,并受靜電、電子和彈性應力的控制[64?65]。在這三種缺陷?缺陷相互作用中,Vo?Vo相互作用最強,其次是Vo?Lnn+和Lnn+?Lnn+相互作用。Vo?Lnn+相互作用主要影響空位相對于主體和摻雜離子的位置。例如,在摻雜鈣鈦礦中,由于彈性應力松弛,氧空位最靠近主體陽離子,其次是大半徑的摻雜陽離子。Vo?Vo和Lnn+?Lnn+相互作用主要決定了這些缺陷的聚集或有序化趨勢。而當氧空位分布不均且局部氧空位相互靠近時,Vo?Vo相互作用將起決定性作用。這些氧空位之間會有很強的作用力形成團簇,這會阻礙氧空位的傳輸。這也是鈣鈦礦體相氧空位濃度過高,氧傳輸性能反而下降的原因,如圖5所示。
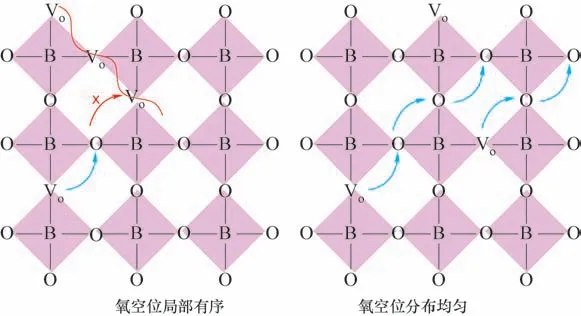
圖5 氧空位局部有序影響氧傳輸示意圖Fig.5 The schematic diagram of the local order of oxygen vacancy affecting oxygen transport
最初是在螢石氧化物中發現了氧空位局部有序的現象。Yamamura 等[66]發現隨著摻雜比例增大,螢石氧化物Ce1?x?yLaxSryO2?δ的氧空位濃度增加,而理論晶格常數與實際晶格常數之間的差異越來越明顯。這是由于隨著氧空位濃度的增加,局部氧空位有序化程度更加明顯,部分氧空位形成了新的結構,從而導致晶格常數降低。與螢石氧化物類似,后續也有報道指出鈣鈦礦在晶體結構中也存在局部有序的氧空位[67],這是通過掃描透射電子顯微鏡(scanning transmission electron microscopy, STEM)或其他先進檢測技術觀察到的,然而,很少有研究者將其直接與鈣鈦礦的體相氧傳輸性能聯系起來。
總而言之,氧空位的分布對鈣鈦礦的氧傳輸性能起著重要作用,在設計高氧離子電導率的鈣鈦礦時,不能忽略這個重要因素。局部氧空位的有序化不僅會降低氧空位的有效濃度,而且局部有序形成的締合結構會阻礙氧離子的進一步傳輸,而抑制氧空位的局部有序。換句話說,提高氧空位的有效濃度,需要氧空位的分布更加均勻,減少相互接觸的機會。對于螢石氧化物,有研究指出采用多重摻雜效應,也就是將多種元素摻雜到主相中,可以抑制氧空位的有序化[66]。但在鈣鈦礦中,尚未出現抑制氧空位排序的報道。推測鈣鈦礦體相中也可能存在多重摻雜效應抑制局部氧空位有序化的現象。本課題組正在進行相關實驗,并得到了初步的驗證。利用兩個半徑和電負性都相似的Nb5+和Ta5+構建鈣鈦礦SrCo0.8Nb0.1Ta0.1O3?δ(SCNT)體系,通過SCNT 與單摻雜的SrCo0.8Nb0.2O3?δ(SCN)和SrCo0.8Ta0.2O3?δ(SCT)進行比較,再結合X 射線吸收譜和模擬計算結果,基本推斷出共摻雜有助于抑制氧空位的有序化這一結論。
3 氧傳輸影響因素的驗證
由于鈣鈦礦作為電化學元件重要組成部分時的器件整體性能評價不能直接表征材料的氧離子傳輸性能,因此通常采用透氧性能測試或電導率弛豫(electronic conductivity relaxation, ECR)技術測得材料的氧離子電導率或氧離子擴散系數對其氧離子傳輸性能進行比較[7,54,68]。透氧性能測試不僅可以得到材料的氧滲透通量,還可以得到材料的氧離子電導率,這對評價鈣鈦礦電化學元件的性能至關重要。為了進行透氧性能測試,通常需要將鈣鈦礦粉末燒結、壓片和拋光,最后密封到致密陶瓷管上。將施加到富氧側的環境空氣用作吹掃氣,從而在膜上產生氧分壓梯度。滲透的氧氣由配備毛細管分子柱和熱導檢測器的氣相色譜儀進行檢測。氧滲透通量可以使用式(5)進行量化:

式中,F是出口氣體的流速;S是膜的幾何表面積;cN、cO分別是吹掃側流出物中氮和氧的測量濃度。而對于氧滲透通量和氧離子電導率之間可由Wagner公式進行轉換[69]:
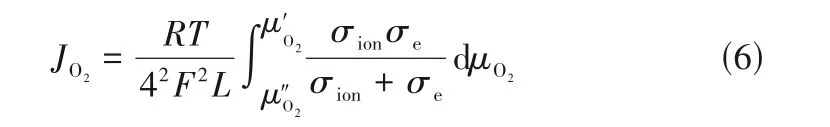
式中,σion、σe分別是材料的氧離子電導率及電子電導率;F是法拉第常數;T是熱力學溫度;R是氣體常數;L是膜體的厚度;μ′O2、μ″O2分別是膜體高氧分壓端及低氧分壓端的氧化學勢。一般而言,材料的電子電導率往往比氧離子電導率高1~3 個數量級,而且在理想狀態的熱力學系統中,氧化學勢可以表示為:

則氧離子電導率與氧滲透通量的關系最終可以簡化為:

式中,P'O2、P″O2分別是膜高氧分壓端和低氧分壓端的氧分壓。
還可以采用ECR 技術測試鈣鈦礦的氧體擴散系數(Dchem)來描述氧傳輸性能的高低。首先將鈣鈦礦粉末燒結成致密的塊狀體,然后在管式爐中加熱到一定溫度后,瞬間改變氧分壓,此時立即使用四探針直流方法測量電導率,最后對電導率弛豫曲線進行擬合得到Dchem[7]。其計算公式如下:

式中,σ(0)、σ(t)、σ(∞)分別是改變氧分壓初始時刻、t時刻和穩定時刻的電導率;無量綱常數C1、C2、C3是塊狀體尺寸與擴散系數之間的比率,C1=l1/Ld,C2=l2/Ld,C3=l3/Ld,Ld=Dchem/kchem;kchem是氧表面交換系數;α1n、α2m、α3p分別是以下方程的第n、m、p根:C1=α1ntanα1n,C2=α2mtanα2m,C3=α3ptanα3p;n、m、p的值固定為10。
對于電化學元件,如SOFC 陰極,電化學阻抗譜(electrochemical impedance spectroscopy, EIS)技術也可用于測試鈣鈦礦的氧傳輸性能[70?71],結合阻抗擬合和弛豫時間分布函數(distribution function of relaxation times,DRT),可以定性研究待測樣品的離子傳導特性。接下來,將詳細討論如何對鈣鈦礦氧傳輸性能的影響因素進行表征和估算。
3.1 晶體結構
3.1.1 晶體對稱性 容差因子t可以粗略判斷鈣鈦礦結構的晶體對稱性,更詳細的結果可以通過實驗手段來確認。X 射線衍射(X?ray diffraction,XRD)是一種常用且簡便的表征鈣鈦礦晶體對稱性的手段。不同晶體對稱性的鈣鈦礦結構均能在譜圖上表現出來,如圖6所示[29]。通過XRD結合Rietveld等精修手段可以得出B—O—B 鍵長鍵角等更詳細的結構參數。目前,常常采用原位XRD 分析技術得到材料在工作狀態下的晶體結構,從而進行更深入的研究。通常為了更加準確地判定鈣鈦礦的結構,可以采用高倍率透射顯微鏡(high resolution transmission electron microscope, HRTEM)得到的晶格間距信息與XRD 譜圖相互印證的方式來增加數據的可信度。值得注意的是,拉曼光譜(Raman spectra)常用于分子結構的表征,對部分鈣鈦礦的不對稱結構非常敏感,也可以得到晶體對稱性等結構信息[72?73]。
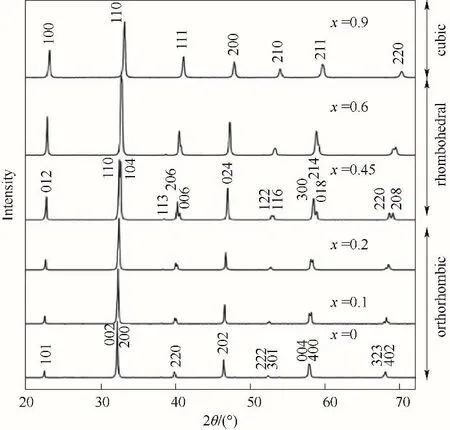
圖6 常溫下鈣鈦礦LaGa0.9?xAlxMg0.1O2.95的XRD譜圖[29]Fig.6 Powder XRD patterns of LaGa0.9?xAlxMg0.1O2.95 at room temperature[29]
3.1.2 晶胞自由體積 簡單鈣鈦礦的晶胞自由體積可按Fukunaga等[74]給出的經驗公式直接計算:

式中,t是容差因子,可由式(4)直接計算得出。
臨界半徑(rc)可由晶格常數(a0)及A 位和B 位的離子半徑求得。A 位和B 位離子半徑可以根據Shannon[44]和Jia[23]的研究進行計算。例如,常用的A 位離子Ba2+、Sr2+、La3+、Pr3+在12 配位狀態下的離子半徑值分別為1.61、1.44、1.36、1.32 ?。常見的六配位B 位離子Co4+、Fe3+、Sc3+、Ti4+的離子半徑分別為0.54、0.65、0.75、0.60 ?。臨界半徑可以用式(11)來量化:

式中,rA、rB分別是An+、Bn+的離子半徑;a0是晶格常數。對于簡單立方鈣鈦礦,晶格常數可以直接通過A位和B位的離子半徑來計算[20]。
值得注意的是,中子和X 射線粉末衍射數據的Rietveld 聯合分析可以方便、準確地獲得待測鈣鈦礦氧化物的晶體結構信息[75?76]。本方法的意義在于,可以在材料的設計階段便可以大致估算晶胞自由體積和臨界半徑的值,為合成實驗提供一定的指導,節省大量的時間和精力。
3.2 平均金屬-氧鍵能
如上文所述,平均金屬?氧鍵能在某些情況下可以簡化為平均B—O 鍵能,而且兩者的表征方法基本是一致的,因此本節將重點討論B—O 鍵能的計算和實驗方法。
B—O 鍵能與B 位金屬離子的電負性和價態密切相關[77?78]。鈣鈦礦中的B—O 鍵能可根據之前研究者們的相關工作進行估算[48?49]。B—O 鍵能的大小可以用式(2)來量化:
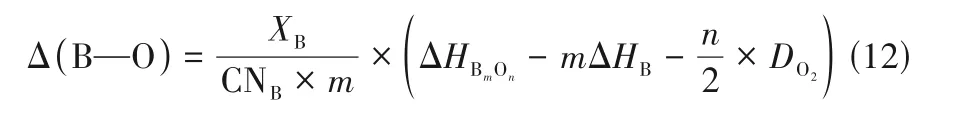
式 中,XB是B 位 金 屬 的 摩 爾 分 數;CNB是6;ΔHBmOn、ΔHB分別是1 mol BmOn的生成焓及B 位金屬在25℃的升華能;DO2是O2的離解能(500.2 kJ/mol)。而平均金屬?氧鍵能(ABE)可以同理計算出A—O 鍵能,合并歸一化即可。
氧氣程序升溫脫附(O2?temperature programmed desorption,O2?TPD)曲線是檢測B—O 鍵能的一項重要技術[51]。在高溫下,隨著鈣鈦礦中B 位離子的熱還原,氧會從鈣鈦礦體相中脫出(可使用質譜儀原位檢測)。可以根據氧脫出峰的位置和強度來確定B—O鍵能的相對大小和性質[50],如圖7所示。

圖7 鈣鈦礦氧化物O2?TPD曲線[50]Fig.7 O2?TPD profiles of perovskite oxides[50]
3.3 氧空位的濃度
在室溫下,鈣鈦礦氧化物的氧空位濃度通常通過碘滴定法(iodine titration,IT)測定。常見的操作步驟為:首先,將鈣鈦礦粉末溶解在酸化的硫酸鐵溶液中。然后,亞鐵離子將所有的B 位金屬還原成低價。以二苯胺磺酸鈉為指示劑,用標定的K2Cr2O7溶液滴定剩余的Fe(Ⅱ)至紫色。常見鈣鈦礦的氧空位濃度由式(13)確定[79?80]:

式中,δ是氧非化學計量比,這是表示氧空位濃度的另一種形式;W是樣品的質量,mg;cFe2+和cK2Cr2O7分別是Fe(Ⅱ)溶液和K2Cr2O7標準溶液的濃度,mol/L;VK2Cr2O7是K2Cr2O7標準溶液的消耗體積,ml。該方法的誤差來源于滴定誤差,可以通過多次平行實驗來盡量避免,總體而言準確度較高。值得注意的是,結合IT 和熱重分析(thermogravimetric analysis,TGA),可以計算出不同溫度下的鈣鈦礦體相氧空位濃度,這些信息對需要在高溫條件下操作的設備非常重要,如SOFC 等[81]。中子和X 射線粉末衍射數據的精修分析也可以確定鈣鈦礦體相中氧空位濃度[6],但是實驗室X 射線對樣品中的氧元素不敏感,采用中子衍射可以很好地探測到氧的信息,準確度更高。
也有一些間接的方法來確定氧空位濃度。X射線光電子能譜(X?ray photoelectron spectroscopy,XPS) 和 X 射 線 吸 收 光 譜(X?ray absorption spectroscopy,XAS)能準確測定鈣鈦礦氧化物中金屬離子的價態,根據電中性原理可間接獲得氧的化學計量比(δ)[75?76]。上述手段再結合先進的原位測試技術,也可以得到高溫下鈣鈦礦體相中的氧空位濃度[82]。值得注意的是,XPS 只能得到樣品表面的價態信息(5 nm),而XAS 可以穿透樣品,得到的價態信息比XPS 更準確。同樣地,采用同步輻射X 射線代替實驗室X 射線得到的價態結果誤差不超過0.05,可以準確地測出樣品中的氧空位濃度。
電子順磁共振(electron paramagnetic resonance,EPR)技術也可以定性分析鈣鈦礦體相中的氧空位濃度[83],特征峰強度越高,氧空位濃度越高。也有報道指出,拉曼光譜也可以探測鈣鈦礦體相中的氧空位[84]。這是由于氧空位會降低鈣鈦礦晶格中BO6八面體的對稱性,會在拉曼光譜中出現特征峰。值得注意的是,上述兩種方法不能給出氧空位濃度的具體值,只能比較同一體系下不同樣品氧空位濃度的相對大小。
3.4 氧空位的分布
目前,有關鈣鈦礦型氧化物中局部有序氧空位的報道相對較少,對于氧空位分布的均勻性還沒有系統的表征方法。球差矯正的電子顯微鏡(spherical aberration corrected transmission electron microscope, AC?TEM)是直接觀察氧空位的最佳設備。然而,它只能獲得局部(10 nm)的氧空位分布,對鈣鈦礦晶格中氧空位的整體信息難以給出準確的判斷。
Ou 等[85]發現,使用TEM 和電子能量損失譜可以在摻雜氧化鈰中觀察到局部氧空位有序,如圖8所示。相似地,Tomura 等[67]利用掃描透射電子顯微鏡(scanning transmission electron microscopy,STEM)觀 察 到 鈣 鈦 礦Bi1?xSrxFeO3?δ(BSFs)中 氧 空 位的局部有序性,如圖9 所示。遺憾的是,目前的研究只能觀察到局部氧空位有序的存在,而無法確定體相氧空位整體的均勻程度,從而難以對氧傳輸性能做出預測。

圖8 摻Y氧化鈰的Ce和Y的顯微照片(a)以及Sm(b)、Dy(c)、Y(d)和Yb(e)摻雜氧化鈰的選區電子衍射圖案[85]Fig.8 Ce and Y maps of Y?doped ceria(a)and selected area electron diffraction(SAED)patterns of ceria doped with Sm(b),Dy(c),Y(d),and Yb(e)[85]

圖9 (a)從110晶面入射光束方向拍攝的BSF30的HRTEM圖像;(b)BSF30的SAED模式;(c),(d)分別沿001和110方向的(b)的線剖面;(e),(g)BSF30的放大圖像;(f),(h)對應于(e),(g)的快速傅里葉變換圖像[67]Fig.9 (a)HRTEM image of BSF30 taken from the(110)incident beam direction;(b)SAED pattern of BSF30;(c),(d)Line profiles of(b)along the 001 and 110 directions,respectively;(e),(g)Magnified images of BSF30;(f),(h)Fast Fourier transform(FFT)images corresponding to(e),(g),respectively[67]
4 模擬計算
模擬計算可以提供一些實驗無法獲得的信息,已經廣泛應用于許多研究領域,包括鈣鈦礦晶格中的氧傳輸過程分析。第一性原理計算和其中最常用的密度泛函理論(density functional theory,DFT)計算方法,都能夠準確地預測或獲得所研究系統的物理和化學性質,應用于鈣鈦礦體相氧傳輸已經取得了許多優異的成果。
首先,模擬計算預測鈣鈦礦體相氧傳輸性能的兩個最常用參數就是氧空位遷移能和氧空位形成能。氧空位遷移能代表了晶格中氧空位遷移的難易程度,是控制鈣鈦礦體相中氧傳輸的重要因素[6?7]。Gangopadhyay 等[86]用平面波DFT 預測鈣鈦礦BSCF 氧空位遷移的穩定性和活化能,并證實Co 和Ba 陽離子的存在會降低氧空位遷移的活化能。Tahini 等[87]使用第一性原理計算,從熱力學、電子學和動力學的角度研究鈣鈦礦SrCoO3?δ中的氧空位,發現氧空位非常容易移動,遷移能量約為0.5 eV。這些發現可以幫助預測鈣鈦礦的氧傳輸特性,為材料的合成提供指導。
對于氧空位濃度,目前模擬計算還無法做出直接而準確的預測。但是氧空位形成能對氧空位濃度的影響至關重要,其大小決定了鈣鈦礦晶格中氧空位形成的容易程度,而模擬計算可以給出準確的計算結果。Hanselman 等[88]利用鈣鈦礦Ba1?xFeInxO3?δ作為模型,詳細研究了原子尺度下的B 位摻雜對氧空位形成的作用。不僅如此,他們還計算了氧過剩能,這是評估體相氧離子擴散的可靠描述符。Aschauer 等[89]發現拉伸應變降低了鈣鈦礦CaMnO3?δ晶格中的氧空位形成能,這可能跟氧空位的增加導致的化學膨脹有關。根據進一步的第一性原理計算,氧空位形成能確實具有很強的應變依賴性。最近,Mao 等[90]利用理論計算詳細研究了SrCoO3?δ基鈣鈦礦中B 位摻雜離子(Sc, Zr, Mo, Nb, Ta 等)的半徑和電負性對氧空位遷移能和形成能的影響,發現了它們之間的強線性關系,如圖10 所示。摻雜離子的平均半徑的提高有利于降低氧空位形成能,但會提高氧空位遷移能;摻雜離子的平均電負性的提高有利于降低氧空位遷移能,但會提高氧空位形成能,同時摻雜離子的半徑和電負性也存在著相關性。因此,摻雜離子的半徑和電負性存在一個平衡值,使得鈣鈦礦體相氧傳輸性能最優,這 也 是 鈣 鈦 礦SrCo0.8Nb0.1Ta0.1O3?δ具 有 高 氧 離 子 電導率的原因。

圖10 (a)氧空位形成能(藍線)和氧空位遷移能(紅線)與半徑的相關性;(b)氧空位形成能(藍線)和氧空位遷移能(紅線)與電負性的相關性(紫紅色圓形代表了單原子摻雜SrCoO3?δ基鈣鈦礦的最有希望區域)[90]Fig.10 (a)Correlation of VO formation energy(blue line)and oxygen transportation barrier(red line)against radius;(b)Correlation of VO formation energy(blue line)and oxygen transportation barrier(red line)against electronegativity(The pink circle area represents the promising zone of the best single metal atom doped SrCoO3?δ perovskite catalysts)[90]
模擬計算雖然不能得到鈣鈦礦晶格中氧空位的分布,但結合氧空位的遷移能和形成能,可以推斷出氧空位在鈣鈦礦晶格中的遷移路徑,這在實驗上是不能觀察到的[91]。氧空位的遷移路徑對理解鈣鈦礦晶格中氧空位的傳輸機制也有著重要作用。Jones 等[92]利用原子模擬技術研究了鈣鈦礦氧化物LaFeO3?δ中氧遷移的多種途徑并發現了此過程的最低活化能是通過兩個O 位之間的彎曲路徑,如圖11所示。Yang 等[93]研究了ab雙軸應變對鈣鈦礦BaTiO3?δ中氧空位及其遷移過程的影響。通過第一性原理總能量計算,發現Vc(氧空位位于c軸)和Vab(氧空位位于ab平面)之間的氧空位遷移路徑呈“S”形,如圖12所示。理論計算也可以用來計算氧空位的締合焓,對分析鈣鈦礦體相氧空位的分布也有重要作用。

圖11 氧離子在氧占據位和氧空位之間遷移的計算路徑(曲線)的示意圖(鞍點的位置用?表示,灰色小球代表Fe離子)[92]Fig.11 Schematic representation of the calculated pathway(curved line)of oxide ion migration between occupied and vacant O2 sites(The position of the saddle point is shown with a cross.Small gray spheres represent Fe ions)[92]

圖12 氧空位遷移的選擇路徑和計算程序的示意圖(粉紅色的水平虛線代表xy平面,移動的氧可以在z坐標固定的情況下傳輸并找到最低能量位置)[93]Fig.12 Schematic of chosen path and the calculation procedure for oxygen vacancy migration(The pink horizontal dotted line represents the xy?plane for the moving oxygen to relax and find the lowest energy position with the z?coordinate fixed)[93]
模擬計算結果也證實了之前關于晶體結構的結論:ABO3型鈣鈦礦結構中A 位和B 位陽離子的半徑是影響離子電導率的重要因素。Cherry 等[11,57]使用定義好的電勢計算了一系列不同的A 位和B 位陽離子半徑的空位跳躍的遷移能量,結果表現出兩個特點:首先,具有較小A 位離子半徑的鈣鈦礦氧化物的體相氧空位遷移能較低,存在約0.95 ?的最佳值,低于此值遷移能會急劇上升。其次,氧空位遷移能隨著B 位陽離子尺寸的增加而降低,存在0.75 ? 的最小值。為了進一步驗證這些結果,研究者們還建立了容差因子(t)與氧空位遷移能的聯系[94]。計算表明,當t≈0.81 時,鈣鈦礦體相的氧空位遷移能和氧擴散速率會更快,但該t值下鈣鈦礦結構并不穩定,因此實際情況下的工作效率可能會很低。
雖然模擬計算可以直接得到許多需要復雜實驗過程的結果,但有時也會與實際情況存在偏差。通過模擬計算與實驗結果相結合,對合理的科學研究進行修正,有利于指導下一步的實驗方案。
5 結 論
本文綜述了影響ABO3型鈣鈦礦氧傳輸性能的主要因素。鈣鈦礦晶格中氧傳輸的機制是空位機制,這意味著氧離子需要通過跳躍到相鄰的空位而擴散。其中,影響鈣鈦礦氧傳輸性能的因素主要有四個:晶體結構、平均金屬?氧鍵能、氧空位濃度和氧空位分布。晶體結構和平均金屬?氧鍵能最終由A 位和B 位陽離子的基本性質決定,例如原子序數、離子半徑和氧化態。摻雜策略是提高鈣鈦礦體相氧空位濃度的有效手段。除此之外,增加晶格常數以允許更大的失配也可以增加鈣鈦礦體相的氧空位濃度。至于氧空位的分布,關于其影響鈣鈦礦晶格氧傳輸的相關報道還很少,這可能是一個新的重要研究方向。為了更好地預測材料的性能并高效篩選高氧離子電導率的鈣鈦礦,還介紹了這些影響因素常用的表征方法。最后,總結了一些用于研究鈣鈦礦晶格中氧傳輸特性的理論計算結果。值得注意的是,晶體結構、平均金屬?氧鍵能、氧空位濃度和氧空位分布也會相互影響。目前合理的設計高氧離子電導率的鈣鈦礦材料的策略應該是選擇合適半徑的A 位和B 位離子,使得盡可能保持立方結構的情況下增大晶胞自由體積,然后選擇合適的摻雜離子調節B—O 鍵能以及提高氧空位濃度,最后可以嘗試多摻雜策略提高氧空位分布的均勻性。同時,在未來提高鈣鈦礦晶格氧擴散速率可以繼續從以下幾方面進行突破。
(1)尋找更簡便的描述符。目前存在很多影響鈣鈦礦晶格氧擴散速率的因素,然而它們之間也會互相影響,無法從單一影響因素來預測氧傳輸性能的好壞,這會給挑選合適的材料增加困難。未來可以通過建立合適的體系,逐步探究影響鈣鈦礦氧傳輸性能的主要和次要因素。然后按照合適的權重或者增加修正項的方式建立準確而簡單的描述符,促進高氧離子電導鈣鈦礦的開發。
(2)原位觀測氧傳輸過程。氧在微觀層面的傳輸很可能與在宏觀層面的理解有所差別。例如,氧離子的半徑與其外層電子云息息相關,然而電子云并不是電子真實填充于此,只是電子出現的概率,這會導致實際氧在晶格內傳輸存在突破半徑大小限制的可能。因此,通過近些年迅速發展起來的原位技術結合精密的表征,例如原位球差矯正的透射電子顯微鏡,可以準確捕捉氧在晶格內的運動,進而更加準確地理解材料結構與性能之間的關系。
(3)準確表征氧空位的分布。氧空位作為氧在晶格內傳輸的重要通道,其分布與氧傳輸性能關系較為密切。然而,目前對氧空位分布的研究還比較少,主要是缺少合適的表征方法,只能通過間接手段或者局部信息來推測整體的氧空位分布情況。下一步,探究高效的鈣鈦礦晶格中氧空位有序程度的表征手段,從而完善對鈣鈦礦氧傳輸性能的預測方法。
(4)更加符合實際的模擬計算。目前有很多采用模擬計算研究鈣鈦礦氧傳輸性質的工作,但大多都只建立靜態單一的模型,缺少對氧分壓、溫度、電勢和形貌等材料工作狀態下的考慮,這與實際的氧傳輸情況可能會有差別,進而導致計算結果的誤差。同時,模擬計算也是尋找氧傳輸性能描述符的重要手段,未來也期待在這方面有更大作用。

