熒光光譜法探究幾種金屬離子與牛血清白蛋白的相互作用
彭婷婷
(白城師范學院 化學學院,吉林 白城137000)
0 引言
金屬離子在生命進程中起著重要的作用,它可以參與基因表達和酶催化反應,亦可參與人體的生長發育、新陳代謝等重要的生理活動.其在生命體內維持一定的濃度,對生理活動起著不可或缺的作用.血清蛋白是血漿里最豐富的蛋白質,擔負著攜帶、運輸各種小分子物質的功能[1].牛血清白蛋白(BSA)與人血清白蛋白具有高度的同源性,且BSA 價格較低,常用作為研究模型[2].本文在模擬人體生理環境下,利用熒光光譜法初步明確了Ni2+,Mg2+,Ca2+和Cu2+與牛血清白蛋白的相互作用機制,能為評價這四種金屬離子在生物體內的吸收、代謝提供一定的參考.
1 實驗部分
1.1 儀器與試劑
LS-55 型熒光光譜儀(購自美國珀金埃爾默公司);BSA(購自北京鼎國昌盛生物技術公司)用三次蒸餾水溶解配制成5.68×10-5mol·L-1的儲備液,于冰箱中4 ℃保存備用;pH=7.40 的Tris 緩沖溶液;其他試劑均為分析純,實驗使用二次蒸餾水.
1.2 實驗方法
在pH 為7.40的Tris緩沖溶液中加入固定量5.68×10-5mol·L-1的BSA 溶液,改變金屬離子的濃度.金屬離子-BSA 體系熒光光譜在λem=350 nm,λex=279 nm 處,激發狹縫寬度為10 nm 和發射狹縫寬度為5 nm,波長范圍為300~400 nm時,體系在21 ℃和37 ℃下測定熒光發射光譜.
2 結果與討論
BSA的熒光主要來自色氨酸殘基和酪氨酸殘基,當其附近微環境發生變化,BSA的內源熒光強度會發生變化.
2.1 BSA與金屬離子作用的熒光光譜
BSA 與不同物質的量濃度的Ni2+,Mg2+,Ca2+和Cu2+溶液在溫度為294 K 時的熒光光譜如圖1所示.由圖1 可知,隨著溶液中各金屬離子濃度的增大,BSA 位于350 nm 附近的熒光峰強度有規律地減弱,金屬離子在300~400 nm 范圍內不發射熒光,表明金屬離子能夠猝滅BSA 的內源性熒光.隨著Ni2+,Cu2+濃度增加,色氨酸殘基和酪氨酸殘基的最大發射波長略有紅移,說明這兩種殘基所處的微環境極性增加,疏水性降低[3].
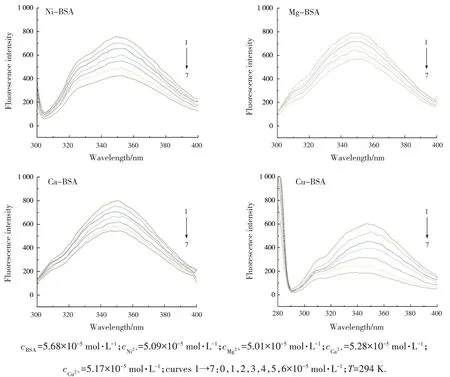
圖1 BSA與金屬離子作用的熒光光譜
2.2 金屬離子對BSA內源熒光的猝滅類型
熒光猝滅可分為動態猝滅和靜態猝滅[4],BSA 熒光猝滅可用斯特恩-沃爾默(Stern-Volmer)方程[5]進行描述,即:

其中:F0和F分別為未加入和加入金屬離子時BSA 的熒光強度;[D]為金屬離子的濃度;由實驗數據計算出不同金屬離子對BSA 的熒光猝滅的動態猝滅常數KSV,如表1 所示.根據Stern-Volmer 方程作圖,如圖2所示,高溫斜率大于低溫斜率為動態猝滅;反之,則為靜態猝滅[6-7].由圖2和表1可知,F0/F與[D]間存在著良好線性關系;Ni2+,Mg2+離子存在時,KSV(294 K)>KSV(310 K),可知Ni2+,Mg2+離子對BSA的熒光猝滅類型為靜態猝滅;Ca2+,Cu2+離子存在時,KSV(310 K)>KSV(294 K),可知Ca2+,Cu2+離子對BSA的熒光猝滅類型為動態猝滅.
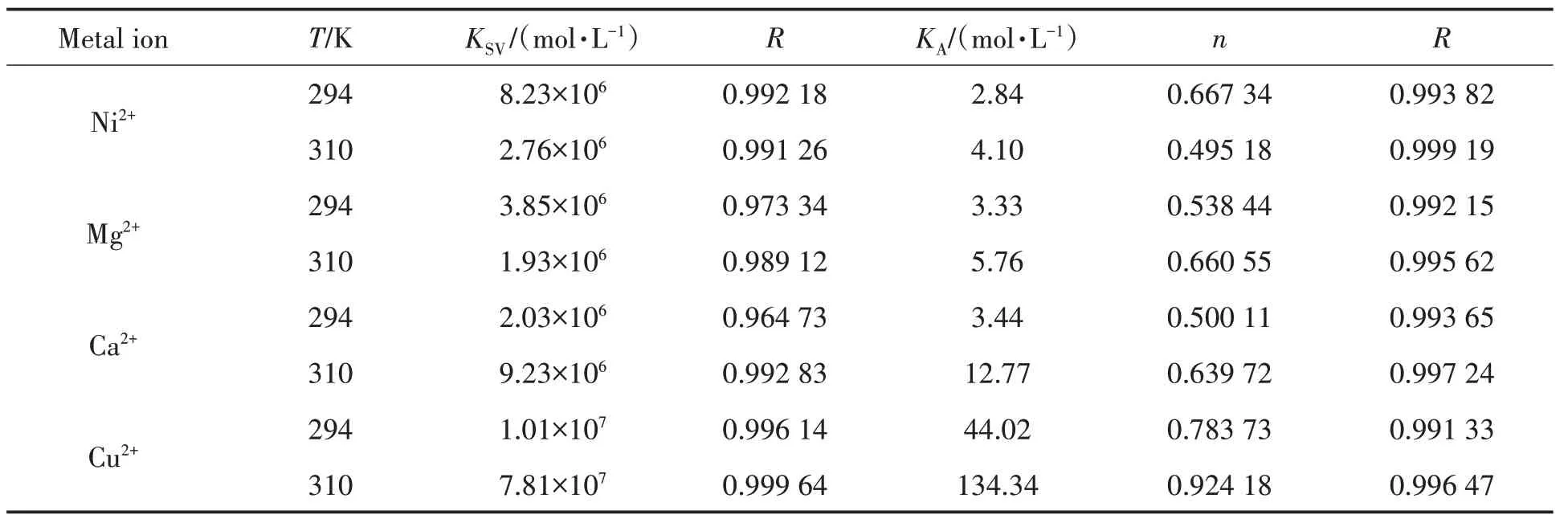
表1 BSA與金屬離子作用的猝滅常數、結合常數及結合位點數
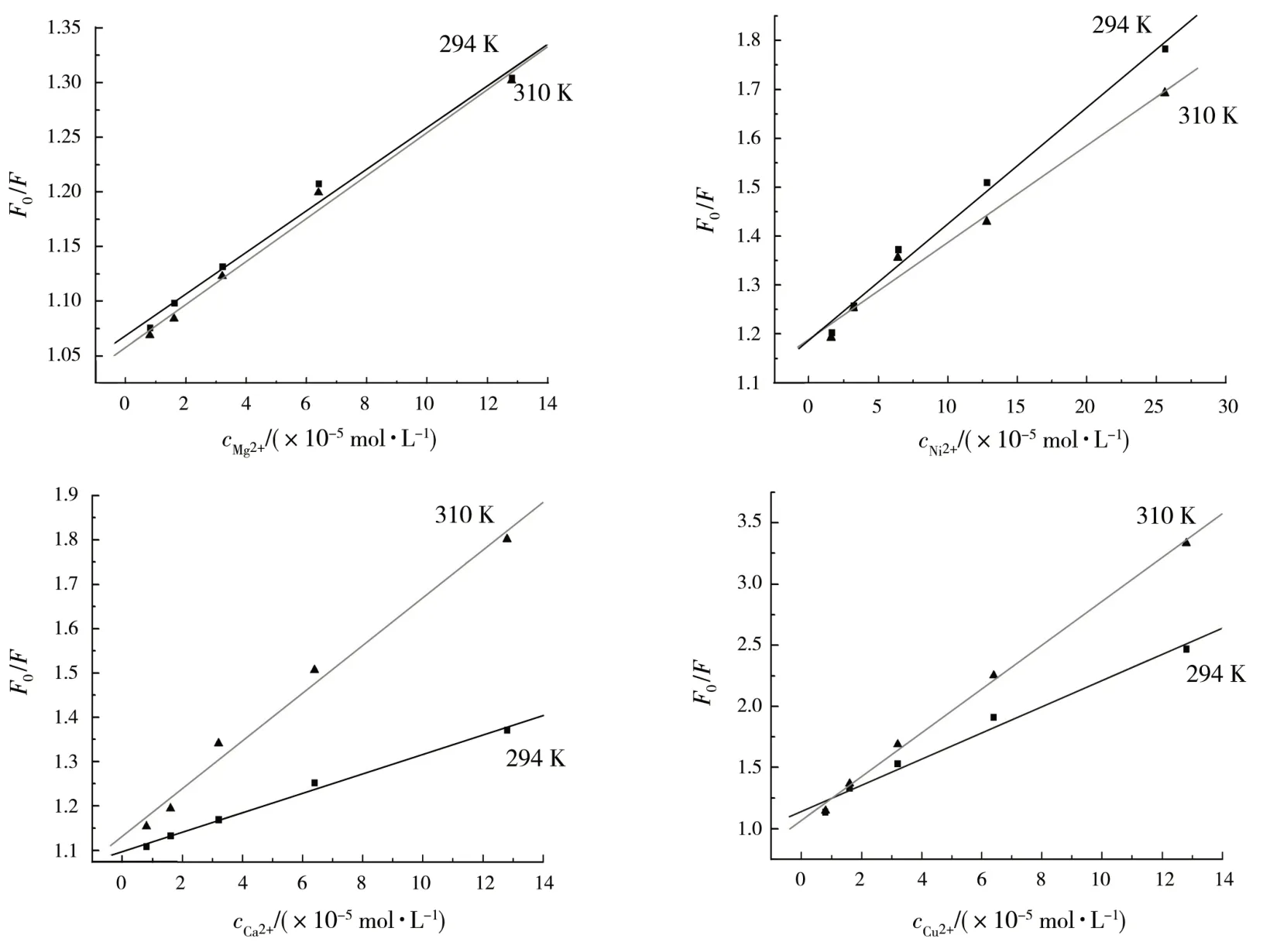
圖2 BSA與金屬離子相互作用的Stern-Volmer曲線
2.3 BSA與金屬離子作用的猝滅常數、結合常數及結合位點數
金屬離子與牛血清白蛋白之間的結合常數和結合位點數可由方程(2)進行計算:
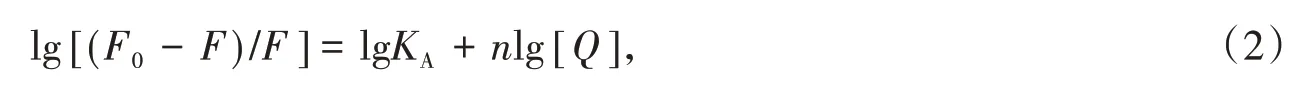
其中:[Q]為金屬離子的濃度;KA為結合常數;n為結合位點數.由表1 可知,294 K 時四種金屬離子與BSA 結合作用強度大小為KA(Cu2+)>KA(Ca2+)>KA(Mg2+)>KA(Ni2+).Cu2+結合常數最大,表明其與BSA形成配合物最穩定.310 K 時四種金屬離子與BSA 結合常數均增大,說明溫度升高,四種金屬離子與BSA 作用均增強.四種金屬離子與BSA 的結合位點數均小于1,說明四種金屬離子與BSA 只有一個結合位點.
2.4 BSA與金屬離子作用的熱力學參數及作用力類型
小分子與蛋白質結合的作用力類型通過熱力學參數可以確定,公式為

其中:KA1,KA2分別為T1,T2溫度下的結合常數.當ΔH<0或ΔH≈0,ΔS>0時,主要的作用力是靜電結合;當ΔH<0,ΔS<0時,主要作用力是范德華力或者氫鍵;當ΔH>0,ΔS>0時,主要作用力是疏水鍵[8].
根據公式(3)~(5)計算得出的熱力學參數如表2所示.由表2可知,Ni2+與BSA 間的作用力主要是范德華力或者氫鍵;Mg2+,Ca2+,Cu2+與BSA間的作用力主要是疏水鍵.
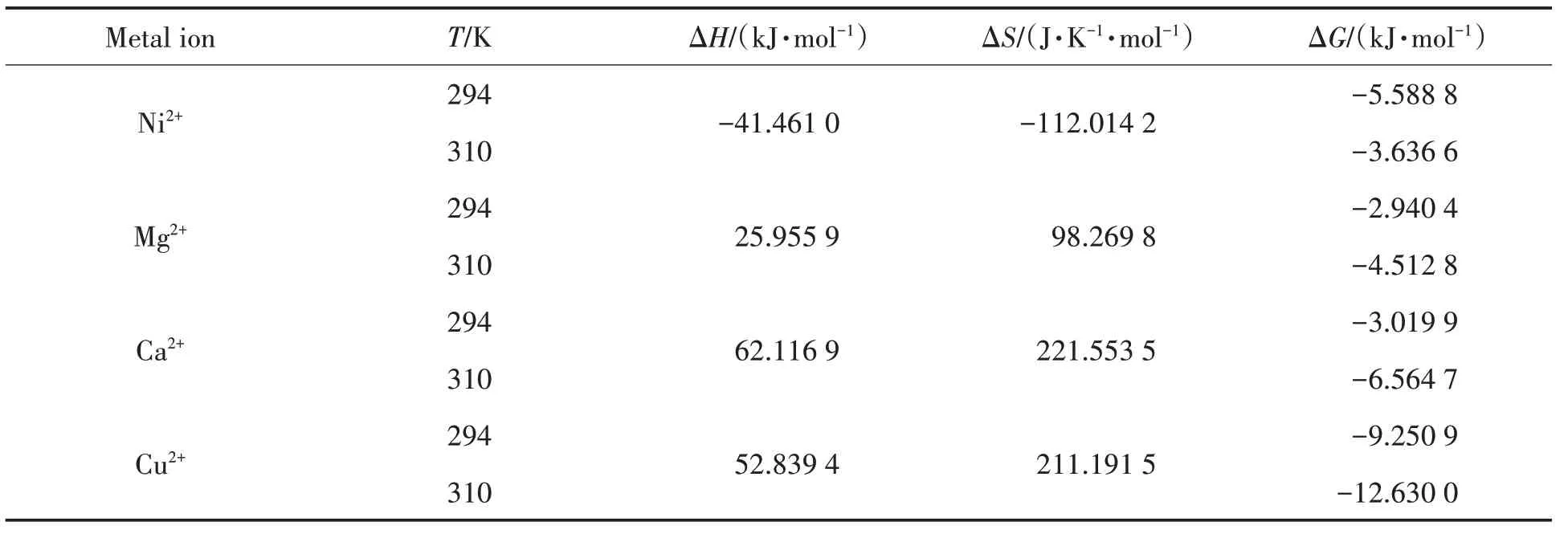
表2 BSA與金屬離子作用的熱力學參數
3 結論
Ni2+,Mg2+,Ca2+和Cu2+都可以與BSA 發生作用,使得BSA 的內源熒光強度降低.實驗結果可得出BSA與金屬離子相互作用的強弱順序為KA(Cu2+)>KA(Ca2+)>KA(Mg2+)>KA(Ni2+).

